抗B型肉毒毒素治疗性胞内抗体的制备及活性研究
吉元刚,张国利,李泽鸿,岳玉环,吴广谋,田园,刘雨玲,李玉洁,赵鑫付玉和,王冬冬,张培培,侯天全,徐艳玲,马洪园
(1.吉林农业大学生命科学学院,长春 130118;2.军事医学科学院军事兽医研究所,长春130122)
抗B型肉毒毒素治疗性胞内抗体的制备及活性研究
吉元刚1,2,张国利2,李泽鸿1,岳玉环2,吴广谋2,田园2,刘雨玲2,李玉洁1,赵鑫1,2付玉和1,2,王冬冬2,张培培2,侯天全2,徐艳玲2,马洪园1,2
(1.吉林农业大学生命科学学院,长春 130118;2.军事医学科学院军事兽医研究所,长春130122)
以克隆表达的B型肉毒毒素轻链蛋白(BoNT/BL)为抗原,从噬菌体抗体库Tomlinson I+J筛选出得到活性高和特异性高的全人源单链抗体(ScFv),结合能够携带外源蛋白有效通过生物膜的小片段跨膜肽(TAT)制备跨膜单链抗体(TAT-ScFv)。经PCR后酶切,克隆到原核表达载体(pET-28a-TAT)中,构建含有跨膜肽(TAT)的抗B型肉毒毒素胞内抗体融合蛋白,并在大肠杆菌中诱导表达,进行纯化工艺,对产物进行浓度纯度、亲和常数测定及生物活性研究。成功构建TAT-ScFv表达载体,融合蛋白相对分子量为32.7 kDa,主要以可溶形式表达,纯度也达到95%以上,胞内抗体中和B型肉毒毒素致病轻链得到TAT-ScFv的亲和常数为(1.133±0.273)×106L/mol,小鼠神经细胞乙酰胆碱定量测定实验证明胞内抗体具有较好的抗毒素活性。此结果为B型肉毒毒素治疗性胞内抗体的研制和肉毒中毒治疗奠定了基础。
跨膜肽(TAT);重组蛋白;表达;蛋白纯化;亲和常数;乙酰胆碱
肉毒芽胞梭菌是一种革兰氏阳性菌,菌体形态不一,多数呈现直杆状或稍带弯曲[1]。肉毒毒素BoNT是由肉毒梭菌分泌的一类具有致死性毒性极强的神经毒素,在国际上被归为A类生物战剂[2]。目前发现有7个血清型(A~G),有一定的相似结构,每个肉毒毒素是一个近似的分子量为150 kDa的蛋白分子[3]。但是具有不同的抗原性,其中A、B型最为常见,A、B、E和F型是引起人类中毒的主要亚型[4]。肉毒神经毒素是通过裂解SNARE蛋白抑制钙依赖的胞吐释放神经递质乙酰胆碱和突触的弛缓性麻痹引起潜在的死亡[5]。各型的肉毒毒素对靶蛋白特异性位点的切割,干扰了突触小泡的功能,阻断了神经介质的外泌作用,减少了神经介质乙酰胆碱的释放[6],最终引起机体肌肉驰缓性麻痹。其中B型肉毒毒素以单一位点切割SNARE蛋白中突触小泡膜蛋白(VAMP)[7]。谈及其治疗中毒有效的药物,目前要数多价马血清,但由于种属原因人体存在过敏反应等不良作用,并且制备程序昂贵复杂;另外马匹数量的有限性,也使其得不到推广利用[8]。从免疫人血清中提取纯化抗体这一方案,更是无法满足对抗体的需求。目前新型肉毒毒素疫苗和中和抗体的研究主要以Hc为抗原进行[9],包括有重链抗原表位预测研究,对重链功能进行诠释;重链受体结合区的表达及免疫原性研究;重链结构域单克隆抗体制备和筛选[10]。生物技术和先进设备的显著发展,使基因工程手段成为开发制备BoNT/B中和抗体的一种有效可行策略,这也是目前众多研究领域中常用设计方法和新思路。本课题针对于从人源噬菌体库中筛选出的BoNT/B轻链活性最高的中和抗体,与具有穿梭细胞膜功能的TAT蛋白核心肽段进行基因重组,表达具有穿梭功能的抗BoNT/B人源单链抗体,以期为研发B型BoNT中和抗体治疗药物奠定基础。
1 材料与方法
1.1 质粒、菌种及检测蛋白 受体菌 JM109及BL21(DE3) 工程菌均由军事兽医研究所生物技术应用研究室保存;B型肉毒毒素轻链抗体由军事兽医研究所六室制备保存;抗B型肉毒毒素单链抗体(ScFv)由军事兽医研究所生物技术应用研究室筛选保存;原核表达载体(pET-28a-TAT-EGFP)由解放军军事医学科学院军事兽医研究所生物技术应用研究室保存。
1.2 主要试剂 T4DNA连接酶和Taq DNA聚合酶、限制性核酸内切酶EcoRⅠ和HindⅢ等分子生物学工具酶及BSA均购于大连宝生物工程技术有限公司;DNA凝胶回收试剂盒购于康为试剂生物科技有限公司;卡那霉素及氨苄西林购于宝泰克生物技术有限公司;甘氨酸、丙烯酰胺、诱导剂IPTG及SDS购于Progmega公司;过硫酸铵、溴酚蓝及TEMED购于Sigma公司;质粒提取试剂盒购于Omega Biotek Inc;抗B型肉毒毒素单链抗体PCR引物合成由宝生物工程技术公司完成,引物序列如表1所示。

表1 克隆目的基因(ScFv)的引物
1.3 抗B型肉毒毒素单链抗体(ScFv)基因克隆及重组质粒的构建 以筛选的单链抗体基因组DNA为模板,PCR扩增目的基因片段(ScFv),1.5%琼脂糖凝胶电泳检测PCR扩增的结果,按照DNA胶回收试剂盒的步骤回收,经EcoRⅠ和HindⅢ双酶切3 h,用T4 Ligase和T4 Ligase Buffer克隆到同样双酶切的原核表达载体上16 ℃过夜,构建重组表达载体(pET-28a-TAT-ScFv),表达载体转化到制备好的感受态E.coliJM109中,将菌液涂布于LB抗性平板上(含有50 μg/mL Kan),37 ℃培养箱过夜培养。从抗性平板中挑取单菌落,扩大培养。
1.4 重组质粒(TAT-ScFv)的鉴定 经菌落PCR鉴定,提取质粒进行双酶切鉴定,选取阳性克隆菌株进行重组质粒(TAT-ScFv)提取,用T7promotor和T7terminator引物委托宝生物工程有限公司进行测序鉴定。
1.5 胞内抗体融合蛋白(TAT-ScFv)的诱导表达 将测序正确的重组表达质粒以氯化钙法转化到表达菌E.coliBL21(DE3)中,从长满菌落的LB平板上随机挑选优异的单菌落转接于5 mL LB培养基中(含有50 μg/mL Kan),37 ℃摇床培养,次日转接进行大瓶培养,加入诱导剂IPTG至终浓度为1 mmol/L,30 ℃诱导表达3.5 h。10000 r/min离心10 min,弃上清,用PBS(pH 7.0)重悬菌体,超声破碎处理,并镜检确定细胞破碎完全,4 ℃ 10000 r/min离心5 min,收集上清,沉淀用PBS(pH 7.0)重悬,进行SDS-PAGE分析蛋白表达形式,以未诱导的菌体做阴性对照。
1.6 融合蛋白的纯化
1.6.1 Cu2+金属螯合层析纯化蛋白 A液:20 mmol/L PBS (pH 7.0),B液:20 mmol/L PBS 20 mmol/L 咪唑( pH 7.0),C液:20 mmol/L PBS 80 mmol/L 咪唑( pH 7.0),D液:20 mmol/L PBS 200 mmol/L咪唑( pH 7.0)。样品进行Cu2+Chelating SepharoseTMFast Flow金属螯合层析,用A液平衡层析柱约5个柱床体积,2 mL/min上样(菌体裂解离心得到的上清液),上样结束以A液以相同流速洗脱流川,用B液以相同的流速洗脱至读数不再下降,收集洗脱液,用C液以不变的流速洗脱,读数不再下降时,收集洗脱液,用D液以不变的流速洗脱,收集洗脱液。然后用0.1 mol/L NaOH洗脱柱子上残留的杂蛋白,大约5个柱床体积,用水洗脱,最后用20%乙醇封闭。
1.6.2 rProtein-A FF亲和层析纯化蛋白 A液:20 mmol/L PBS (pH 7.0),B液:0.1 mol/L甘氨酸(pH 3.0),C液:1 mol/L Tris (pH 8.0),采用A液平衡Protein A FF,将过Cu2+金属螯合层析柱的80 mmol/L和200 mmol/L咪唑洗脱液分别上样,用A液以相同的流速洗脱至读数不再下降,用B液缓慢洗脱,同时用C液以1/10接样(0.5 mL C液接甘氨酸洗脱流川至5 mL),最后用甘氨酸(pH 2.5)和C液交替洗脱柱子,用NaN3封柱。
1.7 蛋白亲和常数测定 取无菌96孔板一个,抗原1/2梯度稀释包被每孔,4 ℃过夜。次日,倾去包被液,倒置拍板,以去除残余的包被液。Wash buffer洗板3次,每次3 min,拍干。添加200 μL 2%牛奶(取牛奶1 g,加PBS 50 mL)封闭37 ℃反应2 h。洗板3次。每孔加1/2梯度稀释一抗100 μL,留2孔作阴性对照(200 μL 2%牛奶),37 ℃反应2 h,洗板3次,加二抗100 μL,37 ℃反应1 h,洗板3次。最后加100 μL显色液避光反应15 min,加50 μL终止液2 mol/L H2SO4,酶标仪读数。每个样品三组平行实验,根据抗原抗体结合反应的S型曲线图,能够求解出在不同抗原浓度下,半数吸光值时ScFv浓度,带入到公式KA=(n-1)/2(nAb’-Ab)计算亲和常数,其中Ab’和Ab表示当抗原为Ag’和Ag时,半数吸光值的ScFv浓度(mol/L),n=Ag/Ag’,当n=2时,可以得到3个KA值,n=4时,可以得到2个KA值,n=8时,可以得到1个KA值,把6个KA值取平均值数即最终的亲和常数。
1.8 小鼠神经细胞乙酰胆碱定量测定实验 培养小鼠神经瘤树突状细胞,采用小鼠乙酰胆碱酶联免疫分析试剂盒,用于体外定量检测培养基中小鼠乙酰胆碱的含量,如果细胞培养加入B型肉毒毒素,干扰了突触小泡的功能,阻断了神经介质的外泌作用,减少了神经介质乙酰胆碱的释放,培养基中的乙酰胆碱含量就会减少,加入跨膜肽融合抗体进入到小鼠神经细胞并中和毒素,具有一定的治疗作用。实验大体分四组:DC神经细胞;DC神经细胞+跨膜抗体蛋白;DC神经细胞+Bont-B;DC神经细胞+Bont-B+跨膜抗体蛋白。
2 结果与分析
2.1 重组质粒(TAT-ScFv)的鉴定 重组表达质粒PCR和质粒双酶切产物经1.5%琼脂糖凝胶电泳分析,可见930 bp片段,委托吉林省库美生物科技有限公司进行测序,测序结果表明,插入DNA片段与设计基因序列一致(图1~图2)。
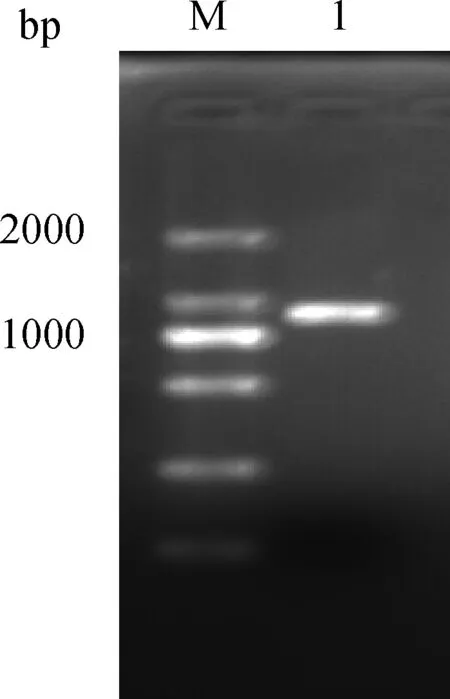
1:PCR产物;M:DNA marker DL200图1 重组质粒PCR鉴定

1~4:质粒的双酶切产物;M:DNA marker DL2000图2 重组质粒的双酶切鉴定
2.2 表达产物(TAT-ScFv)鉴定 诱导表达菌及菌体裂解产物经12% SDS-PAGE电泳,未诱导做阴性对照,在约32.7 kDa处出现一条明显表达带,与融合蛋白预期大小一致。电泳表明大部分目的蛋白呈可溶性表达形式(图3)。
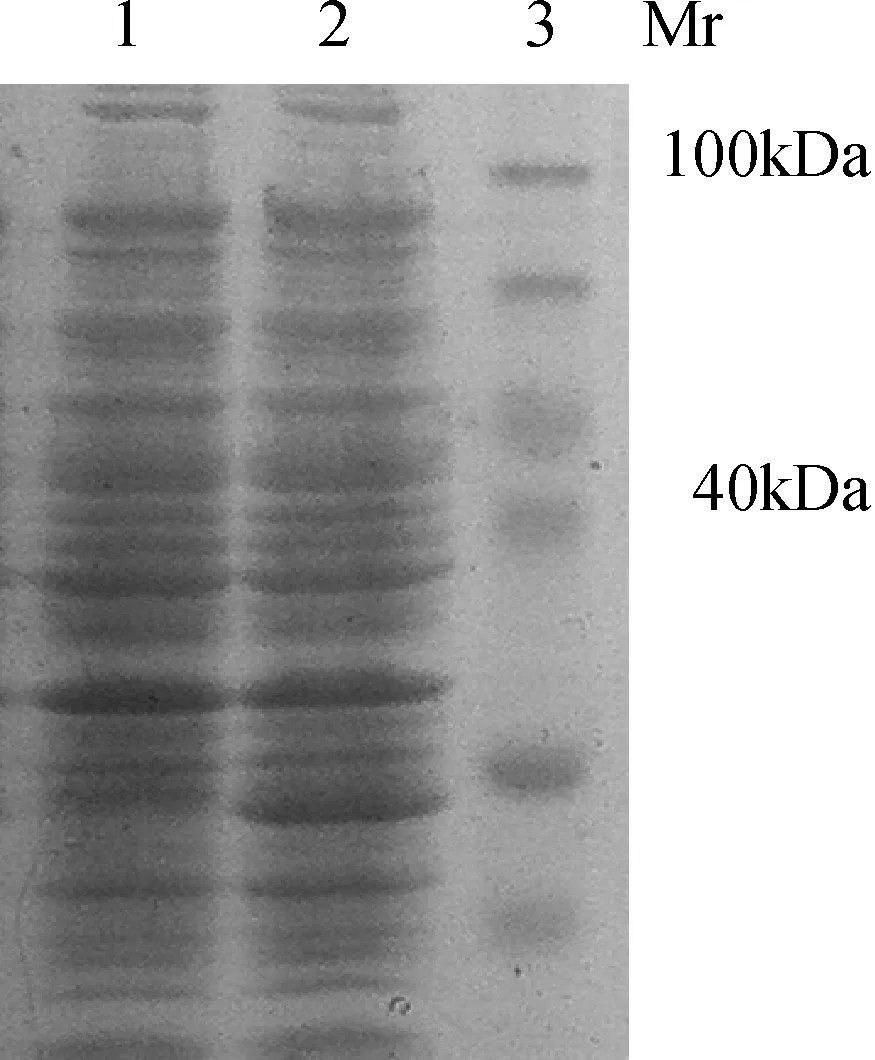
1:对照组 2:诱导组3:蛋白质marker图3 表达产物的SDS-PAGE分析
2.3 跨膜抗体蛋白(TAT-ScFv)纯化 表达产物经金属螯合Cu2+柱,梯度洗脱后,最终80 mmol/L和200 mmol/L 咪唑洗脱液得到含有杂带的目的蛋白,SDS-PAGE电泳监测表明,目的蛋白的相对分子质量为32.7 kDa,SDS-PAGE电泳结果与此相符(图4)。将金属螯合Cu2+柱80 mmol/L和200 mmol/L 咪唑洗脱液进行Protein A柱层析,与预期条带相符,如图5所示。
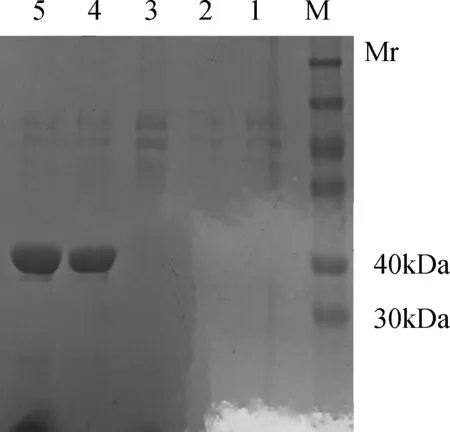
M:蛋白质marker; 1~3:流川液、20 mmol/L Tris·Cl流川液和20 mmol/L 咪唑洗脱;4、5:80 mmol/L和200mmol/L 咪唑洗脱图4 纯化产物的SDS-PAGE分析
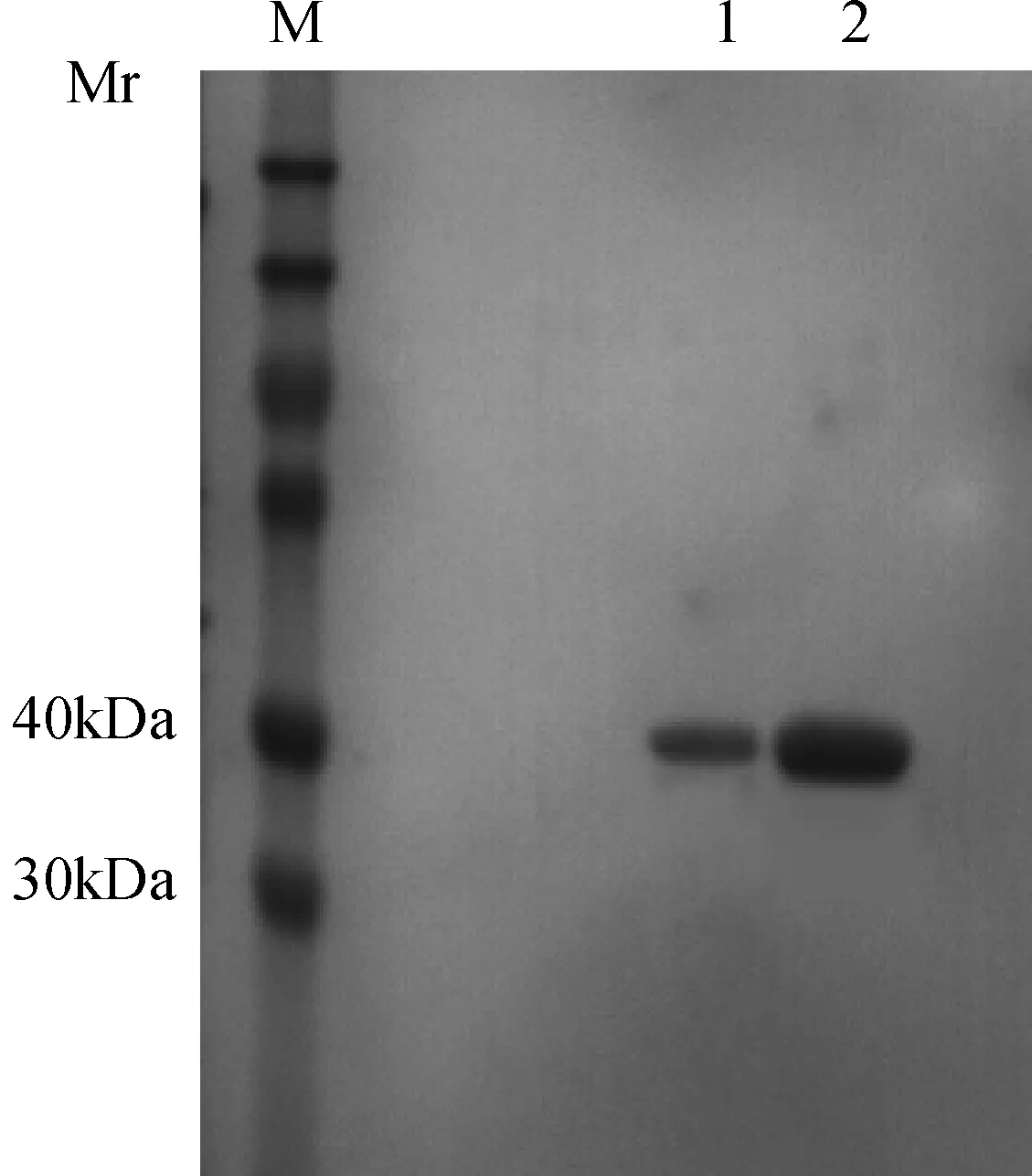
M:蛋白质marker; 1、2:80 mmol/L和200mmol/L 咪唑洗脱的目的蛋白图5 纯化产物的SDS-PAGE分析
2.4 蛋白浓度测定 采用BSA法测定两组纯化蛋白的浓度。测得蛋白标准曲线为y=0.6392x+0.0656。80 mmol/L 和200 mmol/L咪唑洗脱液光吸收值分别为0.371和0.518,对应纯化的跨膜抗体蛋白的浓度分别是0.47 mg/mL和0.7 mg/mL。
2.5 跨膜抗体蛋白亲和常数测定 利用非竞争酶免疫法测定TAT-ScFv的亲和常数,分别对在不同抗原浓度下得到的曲线进行模拟,能够得到4个半数吸光值的TAT-ScFv浓度(图6),然后利用公式KA=(n-1)/2(nAb’-Ab),得到6个KA值,从表2中可以看出TAT-ScFv的亲和常数为(1.133±0.273)×106L/mol。

表2 TAT-ScFv亲和力测定曲线进行模拟后得到的KA值
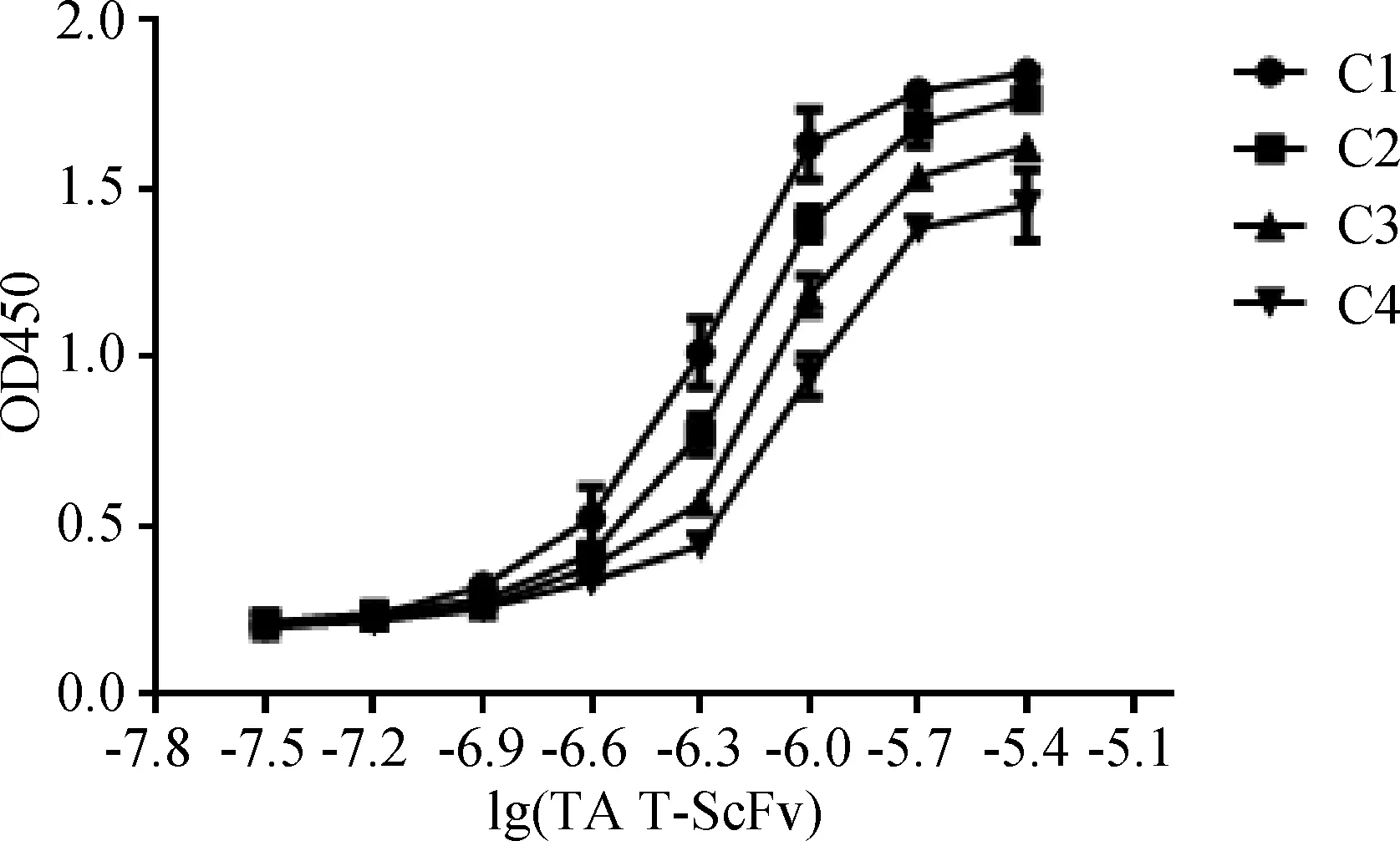
图6 TAT-ScFv亲和力测定曲线
2.6 小鼠神经细胞乙酰胆碱定量测定实验 小鼠神经细胞培养铺板,每孔细胞数是2×104个。实验组1是DC细胞,实验组2是DC细胞加跨膜抗体蛋白,实验组7是DC细胞加B型肉毒毒素,实验组3~6是DC细胞加B型肉毒毒素加跨膜抗体蛋白1/2稀释,通过实验组1和2,培养基中乙酰胆碱的含量基本没有变化,证明融合抗体蛋白对小鼠神经细胞乙酰胆碱的释放基本没有影响。通过实验组1和7,培养基中乙酰胆碱的含量明显不同,用肉毒毒素作用的小鼠神经细胞培养基中乙酰胆碱较正常有明显减少,证明了肉毒毒素抑止小鼠神经细胞乙酰胆碱的释放。通过实验组3,4,5和6,培养基中乙酰胆碱的含量都有显著不同,随着跨膜抗体蛋白浓度的降低,培养基中乙酰胆碱的含量减少。对比其他三组,证明跨膜抗体蛋白对肉毒毒素具有中和活性(图7)。
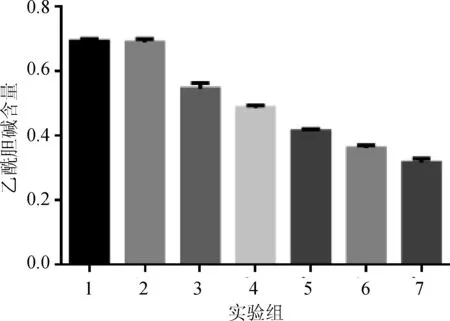
图7 小鼠神经细胞培养基中乙酰胆碱含量
3 讨论与小结
目前,没有特定的药物针对性治疗B型肉毒毒素中毒,疫苗和抗血清治疗是研究治疗肉毒中毒的主要方向,人类最广泛使用的疫苗是灭活疫苗如PBT。一些科学家研制出对肉毒毒素有抑制作用的抑制剂,尚无显著地治疗案例[11]。B型肉毒毒素轻链的单克隆抗体尚未有人研制出。先前的研究主要集中于肉毒毒素基因及蛋白结构,包括有功能蛋白的研究,随着肉毒毒素基因组测定以及基因解读工作的不断完善,揭示部分型别的肉毒毒素基因结构及蛋白质。结构研究表明,重链和轻链是肉毒毒素的主要结构成分,先前对B型肉毒毒素的治疗研究侧重于重链,主要集中在采用大肠杆菌和酵母表达系统对肉毒毒素重链蛋白作为抗原方面[12]。但是重链的抗原决定簇难以定位且可产生中和性抗体,而轻链是肉毒毒素的致病部位[13]。
本实验结果表明,B型肉毒毒素轻链抗体已成功克隆入含有跨膜肽片段载体(PET28a-TAT)中,由于大肠杆菌表达系统比较成熟,且条件易于掌控,选择大肠杆菌作为蛋白质表达菌,经过IPTG诱导表达,在上清中抗体蛋白的表达量要明显大于沉淀中的,所以重组蛋白主要还是以可溶性形式表达。重组蛋白纯化过程中,由于重组蛋白含有组氨酸标签,与Cu2+结合相对较强,采用高浓度的咪唑 (80 mmol/L 咪唑和200 mmol/L咪唑) 洗脱,利用Protein A 可以与 IgG 特异性结合的特点, 对抗体蛋白进一步纯化,得到高纯度抗体蛋白。测定的蛋白浓度分别为0.47 mg/mL和0.7 mg/mL,并对蛋白活性进行了初步检测,为后期的检测奠定了基础。B型肉毒毒素治疗性轻链抗体的制备工艺经过实验室的特异载体重组,降低纯化难度,结合抗体特异性,简化了纯化步骤,同时保证了较高的浓度和极高的纯度。这为肉毒毒素中毒抗体治疗法填补了空缺,将是肉毒毒素中毒治疗上的一个突破性的飞跃。
[1] Hill K K,Smith T J,Helma C H,etal.Genetic diversity among Botulinum Neurotoxin producing clostridial strains[J].Journal of bacteriology,2007,189(3): 818-832.
[2] Comella C L,Pullman S L.Botulinum toxins in neurological disease[J].Muscle Nerve, 2004, 29:628-644.
[3] Melling J, Hambleton P, Shone C C.Clostridium botulinum toxins: nature and preparation for clinical use[J].Eye,1988,2(Pt1):16-23.
[4] Umeda K,Seto Y,Kohda T,etal. Genetic characterization of Clostridium botulinum associa-ted with type B infant botulism in Japan[J].Journal of clinical microbiology,2009,47(9):2720-2728.
[5] Montecucco C,Schiavo G. Mechanism of action of tetanus and botulinum neurotoxin[J].Mol mi-crobial,1994,13(1):1-8.
[6] Blaustein,R.O.The N-terminal half of the heavy chain of botulinum type A neu-rotoxin forms channels in planar phospholipid bilayers[J].FEBS Lett,1987,226:115-120.
[7] Arunagiri G,Santhi S.Migraine: an ophthalmologist’s perspective[J]. Curr Opin Ophthalmol,2003,14:344-352.
[8] Schiavo G,Matteoli M,Montecucco C.Neurotoxins affectingneuroexocytosis[J].physiolRev,2000,80(2): 717.
[9] Simpson L.Peripheral actions of the botulinum toxins.In:Simpson L,ed.Botulinum neu-rotoxin and tetanus toxin[M].New York:Academic Press,1989.
[10]Bajjalieh,S M.Synaptic vesicle docking and fusion[J].Curr Opin Neurobiol,1999,9:321-328.
[11]谢忠平,崔萍芳,宋霞,等.利用 HCV 多表位复合抗原制备高效价抗体[J].中国生物制品学杂志,2005,18(4): 313-315.
[12]Ogasawara H, Takahashi K, Iitsuka K,etal.Contribution ofhemicellulase in Shochu koji to the resolution of barley in theShochu Mash[J]. J Brew Soc Japan,1991,86(4):304-307.
[13]于蕊,孙志伟,俞炜源,肉毒毒素中和抗体的研究进展[J]. 生物技术通讯,2008,19,(4):552-599.
(编辑:侯向辉)
Preparation and Study on the Activity of Anti B Botulinum Toxin in the Treatment of Cytoplasmic Antibody
JI Yu-gang1,2, ZHANG Guo-li2, LI Ze-hong1, YUE Yu-huan2, WU Guang-mou2,TIAN Yuan2, LIU Yu-ling2, LI Yu-jie1, ZHAO Xin1,2, FU Yu-he1,2, WANG Dong-dong2,ZHANG Pei-pei2, HOU Tian-quan2, XU Yan-ling2, MA Hong-yuan1,2
Cloning and expression of botulinum toxin type B light chain protein (BoNT/BL) as antigen, the whole human single chain antibody (ScFv) with high activity and high specificity was obtained from phage antibody library I+J Tomlinson, Cross membrane peptide (TAT) preparation of transmembrane single chain antibodies (TAT-ScFv) by binding to a small fragment of a biological membrane capable of carrying a foreign protein by PCR,Connection with carrier(pET-28a-PTD), Construction of anti B type botulinum toxin recombinant antibody protein containing transmembrane peptide(TAT), And the expression was induced inE.coli. The purification process was carried out, and the concentration and purity of the product, the affinity constant and the search of biological activity.The TAT-ScFv expression vector was successfully constructed, and the relative molecular weight of the fusion protein was 32.7 kDa, which was mainly expressed in soluble form, and the purity reached more than 95%. Intracellular neutralizing antibodies against type B botulinum toxin light chain TAT-ScFv affinity constants for 1.133 + 0.273×106L/mol. The mouse neuronal acetylcholine quantitative determination experiments show that intracellular antibody has better anti toxin activity,which will lay a solid foundation for the type B botulinum toxin in the treatment of intracellular antibody development and treatment of botulism.
transmembrane peptide(TAT);Escherichiacoli; expression; protein purification; activity assay; acetylcholine
吉林省科技发展计划资助(20130206012yy)
吉元刚,硕士研究生,从事生物技术应用于基因工程药物的研究。
张国利。E-mail:zhangguoli2001@126.com
2016-05-31
A
1002-1280 (2016) 07-0001-06
S852.43

