水杨苷对照品的制备工艺
房春林,吴学渊,杨海涵,李超,唐华侨
(1.成都农业科技职业学院,成都 611130;2.成都乾坤动物药业有限公司,成都 611130)
水杨苷对照品的制备工艺
房春林1,吴学渊2,杨海涵2,李超2,唐华侨2
(1.成都农业科技职业学院,成都 611130;2.成都乾坤动物药业有限公司,成都 611130)
从白柳皮中提取分离水杨苷,并通过纯化工艺,制备水杨苷对照品。采用大孔树脂分离、正丁醇萃取、重结晶方法从白柳皮中提取水杨苷,经熔点和比旋度测定、元素分析、红外光谱、液相色谱-质谱联用和核磁共振谱进行水杨苷的鉴别,并采用HPLC-UV进行水杨苷纯度测定。结果表明其含量为99.19%,纯度大于99%,符合中药标准品(供含量测定用)的要求。
白柳皮;水杨苷;提取;对照品
杨树花为杨柳科植物毛白杨 (PopulustomentosaCarr.)、加拿大杨(PopuluscanadensisMoench)或同属数种植物的干燥雄花序,收载于《中国兽药典》2010年版二部,具有清热解毒、化湿止泻的功效,主治湿热下痢、幼畜泄泻[1]。杨树花药材的质量控制仅进行简单的理化性质鉴别,未有相关活性成分的薄层及含量测定。研究表明,杨树花主要活性成分之一为水杨苷,具有显著抗炎作用,对仔猪腹泻引起的炎症反应具有抑制作用[2]。水杨苷在杨树花中的含量为0.16%~0.2%,为了提高杨树花药材质量标准,同时为了研制含杨树花药材的新兽药复方制剂,其质量控制需要对水杨苷进行含量测定,而目前我国尚未有法定的水杨苷对照品。为此,有必要对水杨苷对照品的提取工艺进行系统研究,从而为制备合格的水杨苷对照品提供依据。本研究从柳属植物白柳的皮中提取水杨苷,制备了符合中药对照品(供含量测定用)要求的水杨苷。
1 材料与方法
1.1 试剂与材料
1.1.1 试剂 甲醇、乙酸乙酯、95%乙醇、盐酸、氢氧化钠、丙酮、pH试纸(分析纯,天津博迪化工股份有限公司提供);氧化钙、甲醇、三氯甲烷、正丁醇(分析纯,成都科龙试剂有限公司提供);乙腈、甲醇(色谱纯,fisher公司);纯化水、注射用水(自制)。
1.1.2 材料 水杨苷对照品(欧洲药典EP,含量99.6%,Y0000669);硅胶 (100~200目、200~300目,青岛海洋化工有限公司);大孔树脂D-101(中蓝晨光化工研究院有限公司);薄层硅胶板GF254(墨克公司)。白柳皮(Salix alba L)4 kg,采收季节:春夏;产地:山东。
1.2 白柳皮中水杨苷的提取方法
1.2.1 白柳皮中水杨苷提取工艺 取白柳皮4 kg,剪碎至2~5 cm长度的小段,加15倍量水煎煮提取两次,每次1.5 h,合并两液,滤过,滤液静置过夜,取上层澄清提取液A(约95 L),备用。
1.2.2 水杨苷纯化工艺 大孔树脂的预处理:参照说明书进行。吸附和解吸附:将以上提取液A加入大孔吸附树脂中上样吸附(速率:12 L/h)24 h以上,用水洗至流出液变为浅黄色后,用20%乙醇洗树脂至TLC检测无水杨苷,收集20%乙醇洗脱液,减压回收乙醇至无醇味,得浓缩液B(约11 L),保存备用。
正丁醇萃取:取浓缩液B,加正丁醇萃取3次,每次7 L,合并萃取液,减压回收正丁醇,回收完毕后,样品中加少量甲醇,继续回收溶剂,得水杨苷样品粗品C(约142.6 g)。
正相硅胶法分离纯化水杨苷:取硅胶(200~300目)1.5 kg,加3 L三氯甲烷-甲醇=8∶1溶液混合均匀,装柱(7.5 cm×110 cm);取样品粗品C,加甲醇溶解,加硅胶200 g拌样(100~200目,比例为样品:硅胶=1∶2),旋转蒸发回收溶剂后,上样,依次采用三氯甲烷-甲醇比例依次为8∶1、5∶1、4∶1的溶液及纯甲醇梯度洗脱,分段收集各流份(每种比例洗脱液约25 L,每段收集5 L)。洗脱产品分别以TLC检测,合并含水杨苷且杂质干扰小的洗脱液,回收适量溶剂,待析出晶体后,用少量甲醇润洗,过滤,得水杨苷粗品D(9.5 g),备用。
水杨苷的重结晶:取水杨苷粗品D,加适量甲醇(约500 mL)热溶,室温冷却结晶,待析出晶体后,过滤,收集结晶,如此重复操作至滤液无色,收集结晶,至真空干燥箱中干燥,得水杨苷标准品(编号:SYG-5021)。
1.3 水杨苷的结构鉴定 主要通过对制备得到的水杨苷进行熔点测定、比旋度测定、元素分析、红外光谱、质谱、核磁共振谱鉴别(1H-NMR、13C-NMR)等研究,对其结构进行确证。
1.4 水杨苷的纯度检测 通过HPLC-UV测定水杨苷的纯度。
2 结果与分析
2.1 水杨苷对照品的提取 4 kg白柳皮经提取、分离纯化和重结晶,获得水杨苷3.725 g。
2.2 水杨苷熔点 精密称取制备得到的水杨苷1.0 g,放入自动熔点仪中进行熔点测定,设定起始温度为198 ℃,终止温度为202 ℃,升温速率为0.5 ℃/min,结果表明,测定的样品熔点为199.4~200.3 ℃,与文献[3-4]记载的水杨苷的熔点基本一致,也与欧洲药典对照品一致。
2.3 水杨苷比旋度 精密称取制备得到的水杨苷0.60 g,加95%乙醇配制浓度为0.6g/100mL的溶液,加入自动旋光仪中于20 ℃温度条件下进行比旋度测定,结果表明,测定的样品的比旋度为-47.333,与文献[3]记载水杨苷的比旋度(-45.6)基本一致。
2.4 水杨苷元素分析 精密称取制备得到的水杨苷100 mg,照《JYT017-1996元素分析仪方法通则》进行C、H元素的测定,测定结果见表1。

表1 水杨苷元素分析结果
元素分析结果表明,C、H元素与水杨苷的分子式基本一致。
2.5 水杨苷红外光谱鉴别 称取制备得到的水杨苷(编号:SYG-5021)23.4 mg,加入KBr适量,研匀,压片,进行红外光谱测试。
图谱解析:νmax:3473cm-1、3328cm-1(-OH),1606 cm-1、1495 cm-1(C6H5-),1035 cm-1(-O-),761 cm-1(苯环邻位取代),从IR图谱解析数据可判定该化合物为水杨苷。
2.6 水杨苷液相色谱-质谱联用鉴别 称取制备得到的水杨苷(编号:SYG-5021)21.3 mg,加甲醇25 mL,得浓度为0.848 mg/mL的溶液,取1 mL装入质谱管中,进行质谱检测,质谱图谱见图1。
液相色谱检测条件为:色谱柱:Waters X Bridge C18:50 mm×4.6 mm×3.5 um;流动相A:乙腈(0.05%三氟乙酸)B:水(0.05%三氟乙酸);梯度洗脱见表2;流速2.0 mL/min;柱温40 ℃。
质谱条件为:电离源:电喷雾离子源(ESI);检测方式:正、负离子检测模式;扫描范围:m/z100~1000;离子源温度:350 ℃;雾化压力:0.33 MPa;干燥气流速:9.0 L/min;毛细管电压:3.5 kV。
图谱解析:m/z:304[M+H2O]+,水杨苷分子量为286,故可初步判定该化合物为水杨苷。
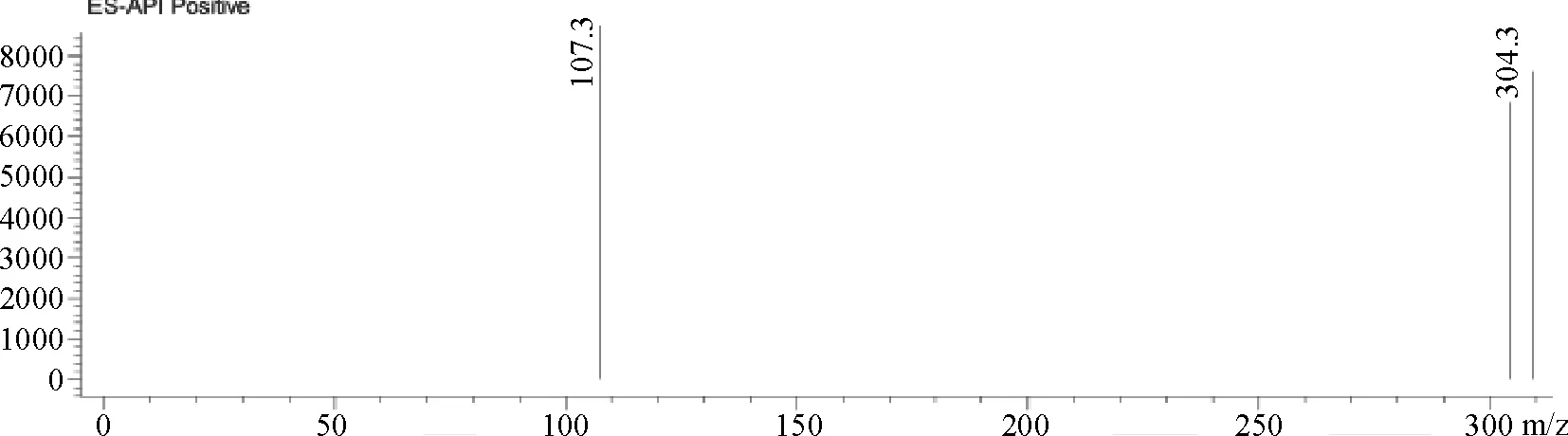
图1 水杨苷质谱图谱

时间/min乙腈/%水/%0~1.65→10095→01.6~3.01000
2.7 水杨苷核磁共振谱鉴别 精密称取制备得到的水杨苷(编号:SYG-5021)20.7 mg,放入核磁管中,于55 ℃条件下真空减压干燥6 h后,加入D2O试剂1支,进行核磁共振鉴别,包括1H-NMR、13C-NMR鉴别,对试验结果的图谱解析如下。
13C-NMR解析:(400MHz,D2O,δ,):129.7(C-1),154.5(C-2),115.3 (C-3),129.4(C-4),123.3(C-5),129.6(C-6),59.2(C-7),100.5 (C-1’), 72.9(C-2’),76.1(C-3’),69.4(C-4’),75.6(C-5’),60.5(C-6’)。

2.8 水杨苷纯度的HPLC-UV测定 色谱条件的选择:经紫外光谱扫描,水杨苷在225、269 nm处均有明显的紫外吸收,因此采用高效液相色谱连接紫外检测器的方法对水杨苷样品的纯度进行检测,通过前期对色谱条件筛选研究,确定液相色谱条件如下。色谱柱:(Agilent Zorbax SB C18 4.6×150 mm,5 μm);检测波长:225,269 nm;流速1.0 mL/min;柱温35 ℃;流动相:采用梯度洗脱的方式,比例变化见表3。经试验验证,在此色谱条件下,保留时间合理,35 min内可完成全部杂质分析。
供试品的制备:精密称取制备得到的水杨苷(编号:SYG-5021)16.64 mg,至50 mL容量瓶中,加水稀释至刻度,摇匀,精密量取2.5 mL至10 mL容量瓶中,加水稀释至刻度,摇匀,即得。

表3 流动相梯度洗脱表
纯度测定:将供试品溶液进样10 μL,按上述色谱条件测定,记录峰面积值和色谱图,采用峰面积归一化法计算样品纯度,结果表明,样品在225 nm和269 nm两种检测波长条件下,测定其纯度分别为99.27%和99.25%。色谱图图谱见图2。
2.9 水杨苷含量测定 据文献报道[8-9],对照品的含量定值方法有两种,即外标法和质量平衡法,因水杨苷为常见的化合物,欧洲药典(EP)收载有此化合物的标准物质,因此,水杨苷属于有可溯源标准物质,因此本研究采用外标法进行自制对照品的含量定值研究。
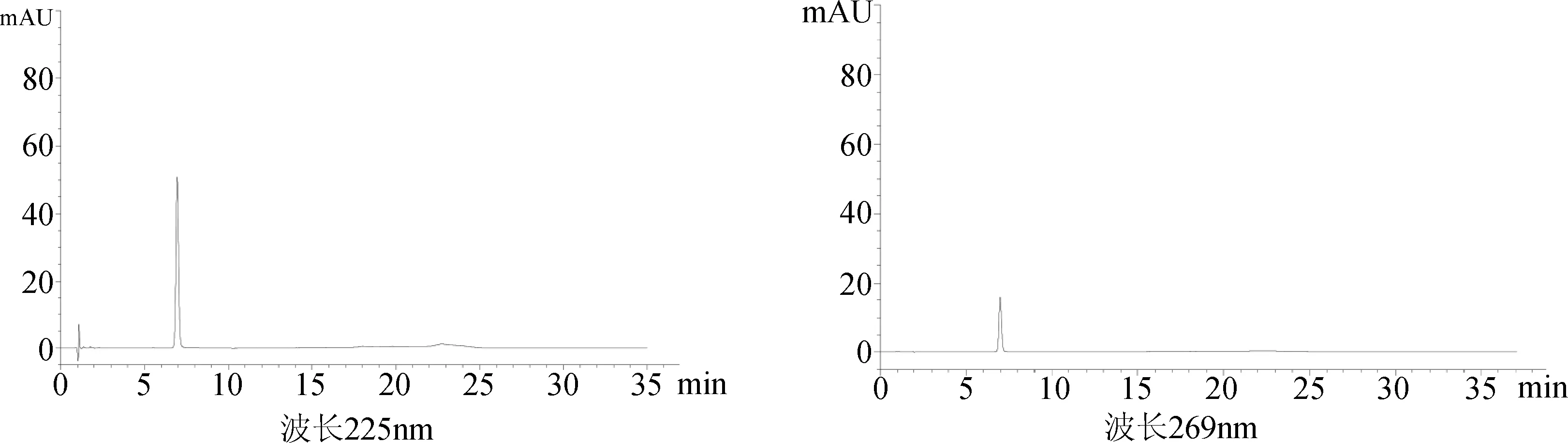
图2 水杨苷纯度测定的HPLC-UV图谱
色谱条件的选择:结合对水杨苷含量测定方法建立的研究基础,确定色谱条件如下:色谱柱(4.6×150 mm,5 μm);检测波长:269 nm;流动相:乙腈-水(6∶94);流速1.0 mL/min;柱温35 ℃ 对照品溶液的制备:精密称取水杨苷对照品(EP)适量,加水制成每1 mL中含水杨苷0.0797 mg的溶液,即得。
水杨苷供试品溶液的制备:精密称取制备得到
的水杨苷(自制,编号:SYG-5021)16.80 mg,共3份,至50 mL容量瓶中,加水稀释至刻度,摇匀,精密量取2.5 mL至10 mL容量瓶中,加水稀释至刻度,摇匀,即得。
自制水杨苷含量测定结果:分别将供试品溶液进样10 μL,按上述色谱条件测定,记录峰面积值和色谱图,采用外标法(EP对照品)计算自制样品的实际百分含量,结果见表4,图谱见图3。
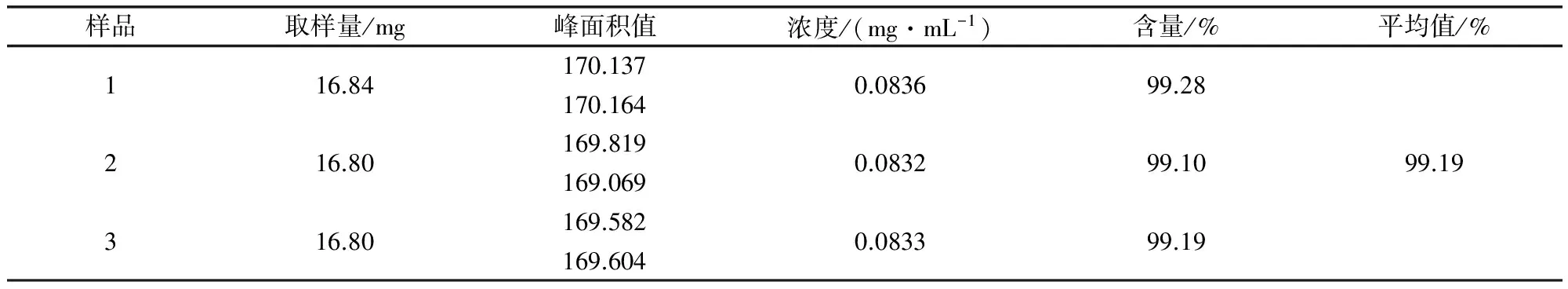
表4 水杨苷(自制)含量测定结果
图3 水杨苷(自制)含量测定HPLC图谱
3 讨论与小结
目前水杨苷在欧洲有法定的对照品销售,可供相关定性及定量研究,在我国仅有Sigma公司销售的作为一般研究的水杨苷化学类物质,尚无法定的水杨苷对照品。因此本研究制备工艺可为制备水杨苷对照品提供一种新的方法。
3.1 提取原材料的选择 水杨苷是兽用中药材杨树花的主要活性成分之一,具有显著的解热、镇痛及抗炎作用,但杨树花中水杨苷的含量较低,仅为0.16%~0.2%,选择从杨树花中提取水杨苷进行对照品的分离纯化难度较大,但可以从其他含量较高的植物中进行水杨苷的提取分离。段红等[10]研究表明,八角枫茎中水杨苷的含量约为0.229%,柳属植物中如白柳、紫柳的树皮中含量较高,赵永强[11]对3个产地的白柳皮进行了水杨苷的含量测定,其中山东产地含量高达2.28%,因此本研究选择山东产白柳皮作为提取并制备水杨苷对照品的原材料。
3.2 提取纯化工艺 关于水杨苷提取纯化工艺研究报道较少,蒲凌云等[12]研究了大孔树脂纯化白柳皮中水杨苷的最佳提取工艺,提取的水杨苷含量仅为75.23%;段红等[13]研究了采用大孔吸附树脂纯化八角枫中水杨苷工艺,其回收率大于78%,但未对水杨苷含量及纯度进行分析;本研究在采用大孔树脂D101初步分离水杨苷后,再经过正丁醇萃取、正向硅胶柱层析及重结晶等工艺,所提取纯化的水杨苷纯度高于99.25%,含量达99.19%,完全符合中兽药对照品要求。3.3 水杨苷含量测定方法及定值 水杨苷的含量测定方法在参考文献报道基础上建立[10,14],并对检测波长、流动相及流动相比例等进行了系统的实验,
最终确定检测波长为269 nm,流动相为乙腈-水(6∶94),在此条件下,样品具有更好的分离度,保留时间适宜。
关于水杨苷的定值研究,国内报道较少,本研究采用对提取纯化的水杨苷进行熔点测定、比旋度测定、元素分析、红外光谱、质谱、核磁共振谱鉴别等方法,对其结构进行了系统确证,表明所分离纯化的化学物质为水杨苷;同时,本研究采用紫外检测器对水杨苷纯度进行测定,确保纯度达到兽药对照品的要求。
[1] 中国兽药典委员会.中华人民共和国兽药典(2010版)二部[S].
[2] 梁延寿,张清芳.杨树花化学成分的研究[J].中药通报,1988,13(1):41-42.
[3] 闫雪.白柳皮中水杨苷的分离与纯化[D].无锡:江南大学, 2006:2-3.
[4] G.G.Zapesochnaya,V.A.Kurkin,V.B.Braslavskii,etal.Phenolic compounds ofSalixacutifoliaBark[J].Chemistry of National Compounds, 2002, 38 (4):316-318.
[5] 南瑶,王想想,周立东.加拿大杨树芽中的苷类成分[J].世界科学技术-中医药现代化,2010,12(6):945-947.
[6] 邹忠杰,杨俊山.泥胡菜化学成分研究[J].广东药学院学报,2007,23(5):492-493.
[7] 邓可众,熊英,高文远.半边莲的化学成分研究[J].中草药,2009,40(8):1198-1201.
[8] 张秀英,陆连寿,王在时.国际化学对照品的研制原则介绍[J].中国兽药杂志,2009,43(5):52-54.
[9] 张秀英,陆连寿,王在时.氰戊菊酯对照品的质量检测及赋值[J].中国兽药杂志 2011,45(1):22-24.
[10]段红,翟科峰,高贵珍.RP-HPLC测定八角枫药材中的水杨苷[J].光谱实验室,2012,29(2):1065-1068.
[11]赵永强,马亚琼,高瑞.UPLC法测定白柳皮中水杨苷的含量[J].内蒙古科技与经济,2015,342(20):85-86.
[12]蒲凌云,杨文江,田洪.大孔树脂分离纯化白柳皮中水杨苷的工艺研究[J]. 中国食品添加剂,2014,2:175-180.
[13]段红,翟科峰,高贵珍,等.大孔吸附树脂纯化八角枫根中水杨苷工艺[J]. 食品科学,2012,33(22):99-102.
[14]惠玉虎,王让成.RP-HPLC法测定白柳皮提取物种水杨苷的含量[J].中草药,2004, 35(5):524-525.
(编辑:侯向辉)
Preparation Process of Salicin Reference Substance
FANG Chun-lin1,WU Xue-yuan2,YANG Hai-han2,LI Chao2,TANG Hua-qiao2
(1.ChengduAgriculturalCollege,Chengdu611130,China;2.ChengduQianKunVeterinaryPharmaceuticalCoLtd,Chengdu611130,China)
The present study was performed to extract and separate the salicin from the bark of white willow to prepare the purified salicin reference substance. The salicin was extracted with the macroporous rein separation, N-butyl alcohol extraction and recrystallized method. The purified salicin was identified by testing the melting point and specific rotation, elemental analysis, infrared spectrum, liquid chromatography tandem mass spectrometry (LC-MS) and nuclear magnetic resonance (NMR) spectrum. The purity of salicin was measured by HPLC-UV. The results indicated that content of extracted salicin reference substance is about 99.19% and the purity is more than 99%, which meet the requirement of traditional Chinese medicine reference standards (for determination use).
white willow bark; salicin; extraction; reference substance
房春林,博士,副研究员,从事新兽药研发及动物疫病防治。E-mail:fangchunlin05@126.com
2016-05-18
A
1002-1280 (2016) 07-0025-05
S859.79

