大孔吸附树脂分离纯化贯叶连翘中的金丝桃素
薛晓丽,费洋,张心慧,宋海燕 ,张克勤*
(1. 长白山动植物资源利用与保护吉林省高校重点实验室;2.吉林农业科技学院中药学院;3. 吉林农业科技学院实验中心, 吉林 吉林 132101)
大孔吸附树脂分离纯化贯叶连翘中的金丝桃素
薛晓丽1,3,费洋2,张心慧1,3,宋海燕1,3,张克勤1,3*
(1. 长白山动植物资源利用与保护吉林省高校重点实验室;2.吉林农业科技学院中药学院;3. 吉林农业科技学院实验中心, 吉林 吉林 132101)
以贯叶连翘粗提浸膏为材料,考察六种大孔吸附树脂分离纯化金丝桃素的性能。采用静态、动态吸附方法筛选树脂,以中压分离方法确定分离纯化的条件。结果表明:HZ-801树脂以其高吸附率、高洗脱率成为优选的分离填料,其最佳分离纯化条件为:进样液质量浓度为0.1125 g/mL,进样速度为5.0 mL/min、洗脱速度为20 mL/min,0~95%乙醇溶液梯度洗脱,金丝桃素的纯度为79.11%。HZ-801可以较好分离纯化金丝桃素,纯化工艺具有较大实践性及参考价值。
大孔吸附树脂;分离纯化;金丝桃素;贯叶连翘
金丝桃素 ( hypericin)是二蒽酮类物质,是金丝桃属Euhypericum组和Campyloporus组植物中最具生物活性的成分,具有抑制中枢神经和镇静的作用[1-3]。近来研究表明,金丝桃素对于癌症的光化学治疗[4]、艾滋病[5-6]、抑郁症[7-8]、禽流感[9]、抗鸡球虫病[10-11]等的治疗具有明显的作用。但金丝桃素不稳定的特性,即氧、光、温度、pH均对其生物活性产生较大影响,故其提取率及分离纯化的技术受到制约[12],远远满足不了终端产品的需要。黄英等[13]采用S898吸附树脂分离纯化金丝桃素粗品中金丝桃素,其含量达到4.26%。王曙阳等[14]采用100~200目硅胶分离纯化贯叶连翘全草中金丝桃素,其含量为1.08%。王晓菊等[15]用D101大孔吸附树脂分离纯化金丝桃素粗提物,其含量为2.13%。王海燕等[16]采用HZ-816大孔吸附树脂将贯叶连翘提取物中金丝桃素的含量由0.33%提高至90%以上。由此可见,不同的树脂对金丝桃素的分离纯化效果差异显著。本研究以D101、AB-8、HZ-801、HZ-818、HZ-806、X-5等六种大孔吸附树脂为填料,分析金丝桃素的静态、动态吸附性能,并在中压分离系统中进行条件优化,为金丝桃素纯化的工业化发展提供理论数据。
1 材料与方法
1.1 材料 贯叶连翘粗提取物购于西安康培基生物科技有限公司。
1.2 仪器与试剂 紫外分光光度计(岛津 UV-2450)、恒温摇床(武汉中科 HQ45Z)、电子天平(梅特勒 AL204)、超纯水机(密理博-Q3)、高效液相色谱仪(岛津 LC-20AD)、中压分离系统(步琪C-660)、层析柱、金丝桃素标准品购于成都瑞芬思生物科技有限公司(生产批号:J-023-140913),纯度≥98%。D101、AB-8、HZ-801、HZ-818、HZ-806、X-5均购于天津光复精细化工研究所。石油醚(60~90℃)、乙醇、氢氧化钠、盐酸等均分析纯,购于天津永大化学试剂有限公司,去离子水、超纯水(实验室自制)。
1.3 方法
1.3.1 样品前处理 将贯叶连翘粗提取物过20目筛后保存于-18℃冰箱备用。使用前阴干至恒重,用石油醚在55℃脱脂3 次,干燥后,在80℃、甲醇体积分数90%、液固比75∶1条件下提取105 min,获得金丝桃素含量为3.71%提取液[17],将提取液在40℃下旋转蒸发除去大部分溶剂制成金丝桃素粗提浸膏。
1.3.2 大孔吸附树脂的预处理 将六种树脂用95%乙醇浸泡24 h充分溶胀除杂,用蒸馏水洗涤至水澄清;用5%盐酸浸泡4 h,用蒸馏水洗涤至中性;用5%氢氧化钠浸泡4 h,用蒸馏水洗涤至中性,储存水中,备用。六种树脂性质见表1。
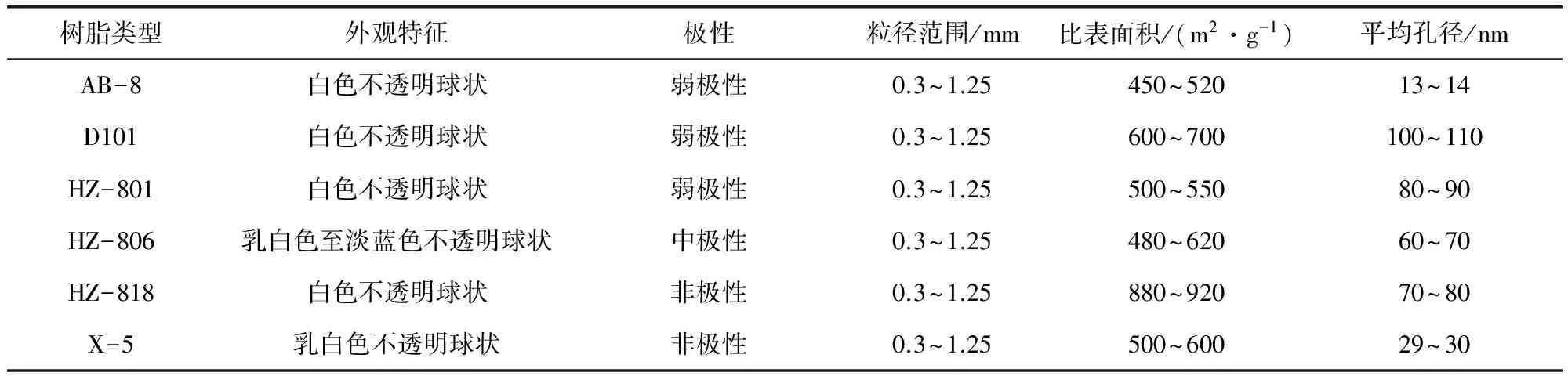
表1 六种树脂物理性能参数
1.3.3 金丝桃素含量的测定 精密称取金丝桃素对照品5.10 mg,加甲醇定容至25 mL的容量瓶中,摇匀,配成质量浓度0.204 mg/mL的标准母液,准确量取适量标准母液定容至10 mL容量瓶中,配成浓度为1.280~20.40 μg/mL的标准溶液。将标准溶液过0.22 μm滤膜后注入高效液相色谱仪(HPLC),绘制标准曲线,即:Y=49030.17X+224.7382,R=0.9999。其中Y为峰面积,X为金丝桃素质量浓度。
1.3.4 静态吸附量与解吸率考察 根据文献方法[18],精确称取六种预处理后用滤纸擦干的树脂各5.00 g,分别放入6个具塞锥形瓶中,各加入金丝桃素溶液(1.2 g浸膏溶于150 mL 70%乙醇溶液中)25 mL,放入恒温摇床,35 ℃,125 r/min振荡24 h,过滤,滤液过0.22 μm滤膜后注入HPLC检测金丝桃素的含量,计算每种树脂的静态吸附量。
Q静=(C0-C滤)×V/m….(1) 其中Q静为静态吸附量(μg/g);C0、C滤为吸附前、吸附后的金丝桃素质量浓度(μg/mL);V溶液体积(mL); m为树脂质量(g)
将上述吸附饱和的树脂用蒸馏水洗至无色后,加入70%乙醇100 mL置于恒温摇床上,35 ℃ 125 r/min振荡24 h,过滤,滤液过0.22 μm滤膜后注入HPLC检测金丝桃素的含量,计算每种树脂的静态解吸附率。
S静=(C2V2/ Q总)×100%….(2) 其中 S静为静态解吸附率%;C2为洗脱液中金丝桃素质量浓度(μg/mL);V2洗脱液体积(mL); Q总—为静态吸附总量(μg)
1.3.5 动态吸附量及解吸率考察 根据文献方法[18],将预处理后用滤纸擦干的三种树脂湿法装柱(∮2.5 cm×30 cm),用金丝桃素浸膏溶液(1.0 g金丝桃素浸膏溶于10 mL 70%乙醇溶液中)缓慢上样,另加1 cm树脂保护(在层析柱上端铺上两层圆形小滤纸片防止树脂被冲散),静置120 min后,将样品液以1 mL/min的速率流出,过0.22 μm滤膜后注入HPLC检测金丝桃素含量,按公式(1)计算每种树脂动态吸附量。
依次用30%、40%、50%、60%、70%、80%、95% 不同体积分数的乙醇溶液进行洗脱,流速控制在2 mL/min至洗脱液无色后,将各洗脱液过0.22 μm滤膜后分别注入HPLC检测金丝桃素含量,计算动态解吸附率。
S动=(∑ C×V/Q总)×100%….(3) 其中S动为动态解吸附率%,C为每个体积分数乙醇洗脱液中含有金丝桃素的质量浓度(μg/mL);V每个洗脱液体积(mL);Q总为动态吸附总量(μg)
1.3.6 纯化条件 将预处理后的HZ-801树脂装入中压层析柱中(∮2.5 cm×45 cm),利用中压分离系统,以70%乙醇溶液做为洗脱剂,分别取0.075、0.1125、0.15 g/mL金丝桃素粗提液以3.0、5.0、7.0 mL/min速度进样,以15.0、20.0、25.0 mL/min的速度洗脱来优化进样质量浓度、进样速度、洗脱速度等条件,按590 nm处吸光度值A收集流分,出现泄漏点时停止(泄漏点即A值为原液A值的十分之一时)。在确定好的进样浓度、进样速度、洗脱速度下,按照梯度洗脱方法设置洗脱液比例,从而确定最佳洗脱梯度。1.3.7 色谱条件 根据文献方法[19],Symmetry-C18 (4.6 mm×250 mm,5 μm)色谱柱;流动相为甲醇-6.0 mmol/L磷酸氢二钠(用磷酸调pH至6.5)(87.5∶12.5, v/v)。柱温:30℃;流速:1.0 mL/min;进样量20 μL;检测波长:590 nm。
2 结果与分析
2.1 静态吸附 用HPLC测得金丝桃素浸膏溶液中金丝桃素的浓度为19.2457 μg/mL,每份树脂中金丝桃素的质量为481.1425 μg。
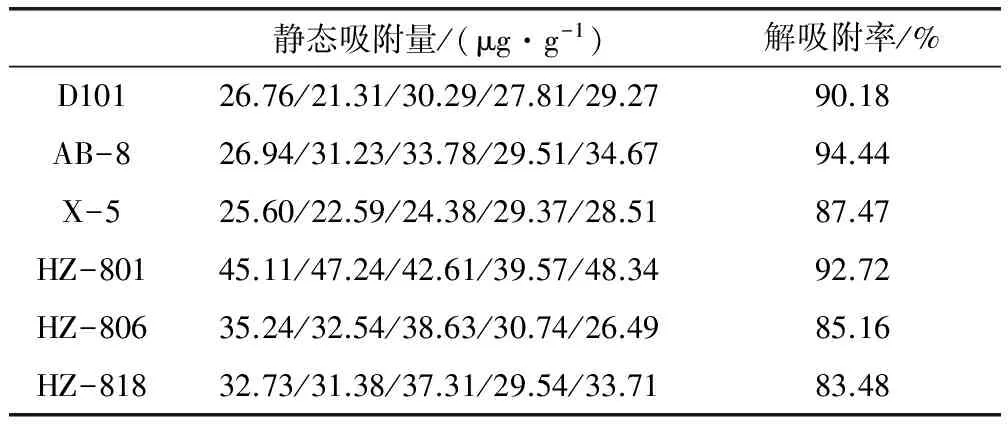
表2 静态吸附量及解吸附率(n=5)
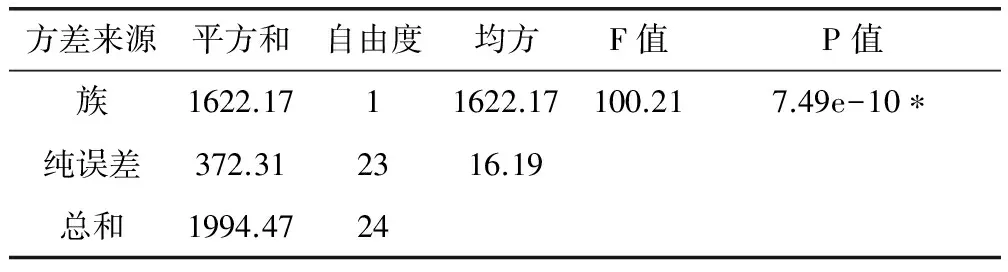
表3 静态吸附量的方差分析
*P<0.001,差异显著
表2的数据表明:HZ-801树脂对金丝桃素的吸附能力最高为45.11 μg/g,X-5树脂对金丝桃素的吸附能力最低为25.60 μg/g。大孔吸附树脂的吸附量与树脂的极性、空间结构(孔径、比表面积、孔容等)及被吸附物质的性质、分子大小、结构等有着重要的关系[13]。将弱极性D101、AB-8树脂归为第一族,HZ系列三种树脂归为第二族,X-5为第三族,用Matlab7.1软件进行方差分析,族分析结果见表3。P<0.001,差异显著。故选用HZ-801、HZ-806、HZ-818三种树脂进行动态吸附试验。
2.2 动态吸附 由图1可知:50%~95%体积分数的乙醇洗脱液中均含有金丝桃素,将金丝桃素峰面积代入1.3.3下的标准曲线后得到浓度并由此计算各洗脱液的解吸附率,三种树脂在不同体积分数乙醇洗脱液下的动态吸附量及解吸附率见表4。
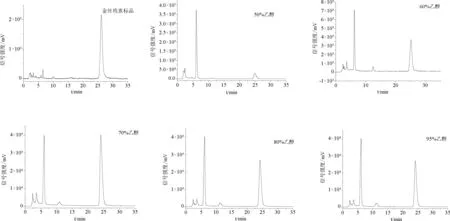
图1 金丝桃素标准品及不同体积分数乙醇洗脱液的高效液相色谱图
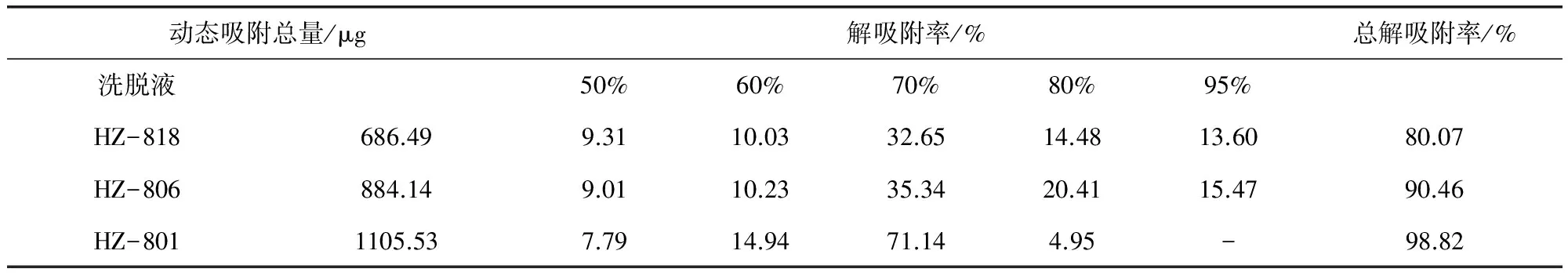
动态吸附总量/μg解吸附率/%总解吸附率/%洗脱液50%60%70%80%95%HZ-818686.499.3110.0332.6514.4813.6080.07HZ-806884.149.0110.2335.3420.4115.4790.46HZ-8011105.537.7914.9471.144.95-98.82
-为未检出金丝桃素
表4的数据表明:三种树脂对金丝桃素均有较好的动态吸附能力,其中HZ-801树脂吸附能力较强,其解吸附率也较高为98.82%。故确定HZ-801为分离金丝桃素最佳的树脂。同时,HZ-801树脂在95%体积分数的乙醇洗脱液中未检出金丝桃素,说明该树脂选择性好,为分离金丝桃素最佳填料并由此确定70%乙醇溶液为最佳洗脱剂。
2.3 分离纯化条件
2.3.1 进样液质量浓度优化 图2表明0.15 g/mL的进样液质量浓度过大致使金丝桃素在层析柱中来不及吸附就被洗脱液带出,进样8 min,3个BV就出现泄漏点;0.075 g/mL的进样液质量浓度过小致使金丝桃素洗脱困难,进样22 min,接近9个BV消耗440 mL 洗脱液后才出现泄漏点,浪费试剂;0.1125 g/mL的进样液浓度进样14 min ,6BV出现泄漏点,而且吸光度值比较均匀,故选用该浓度为最佳进样液质量浓度。
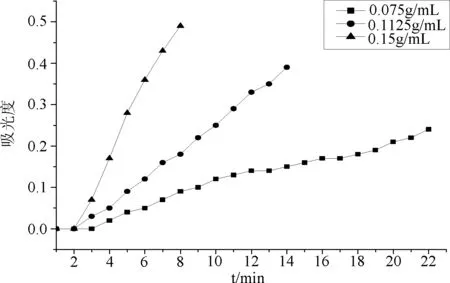
图2 进样液质量浓度对分离效果的影响
2.3.2 进样速度 如图3所示,3.0 mL/min的进样速度能使样品中金丝桃素很好的吸附在填料上,造成洗脱困难,22 min,9个BV出现泄漏点;7.0 mL/min的进样速度太快,使样品中金丝桃素没及时吸附在填料上,就被洗脱液带出,7 min,3个BV出现泄漏值;5.0 mL/min的进样速度能使样品中金丝桃素很好的吸附在填料上,12 min,5个BV出现泄漏值,洗脱也比较容易。故选5.0 mL/min的进样速度为最佳进样速度。

图3 进样速度对分离效果的影响
2.3.3 洗脱速度 图4可知,洗脱速度对分离有较大的影响,速度过快,金丝桃素从层析柱上过早下来,25 mL/min的洗脱速度使金丝桃素只在层析柱中保留9 min,4BV就出现泄漏点,15 mL/min的洗脱速度使洗脱液的解吸附能力减小,25 min,11个BV还没出现泄漏点。故选择20 mL/min洗脱速度为最佳洗脱速度。

图4 洗脱速度对分离效果的影响
2.3.4 梯度洗脱条件的优化 以HZ-801树脂为
填料,在进样液质量浓度0.1125 g/40 mL、进样速度5.0 mL/min、洗脱速度20 mL/min、70%体积分数乙醇为洗脱剂条件下,得到的分离产物经旋转蒸发浓缩后干燥得固体1.57 g,测得其金丝桃素的含量为53.22%,为了进一步提高纯度,将洗脱液乙醇与水设置成按照不同比例混合的梯度洗脱,见表5。将此条件下的70%体积分数乙醇洗脱液经过浓缩、真空干燥后得固体1.05 g,含量提高至79.11%。

表5 梯度洗脱程序
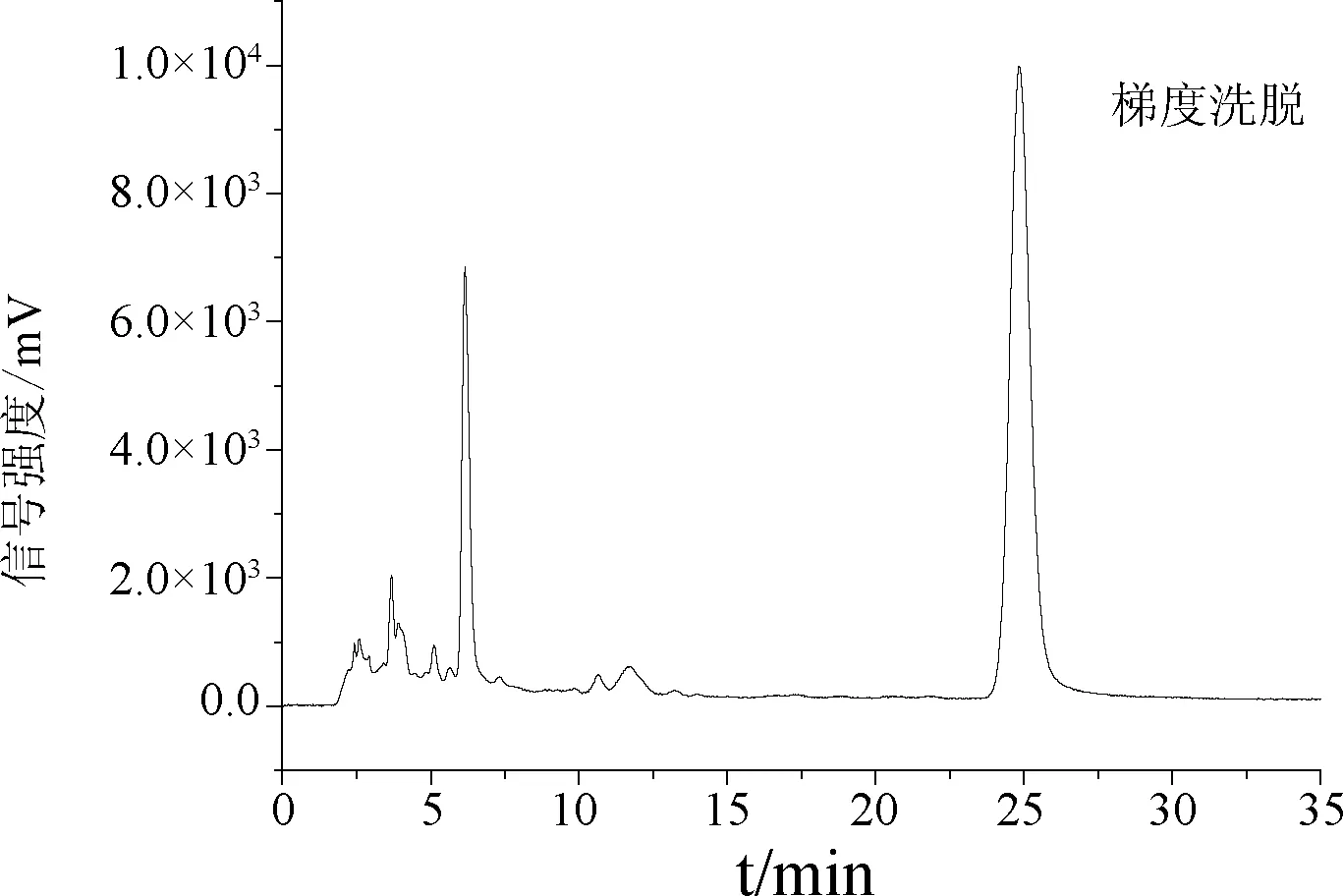
图5 梯度洗脱的高效液相色谱图
验证试验结果表明,三次纯化的结果分别是75.151%、78.314%、79.824%,RSD为2.38%,说明该方法准确有效,可以用来纯化金丝桃素,能够为金丝桃素的工业化实施提供理论数据。
3 讨论与小结
静态吸附的试验结果表明,HZ-801、HZ-806、HZ-818三种树脂均对金丝桃素有较好的吸附能力,方差分析表明HZ系列树脂与其他三种树脂之间存在着显著差异(P<0.001)。动态吸附的试验结果表明,HZ-801树脂的动态吸附总量为1105.53 μg,解吸附率为98.82%,为最佳填料,70%体积分数的乙醇溶液为最佳洗脱剂。在中压分离系统上确定出0.1125 g/mL进样液质量浓度、5.0 mL/min的进样速度及20 mL/min洗脱速度为最佳优化工艺,在此工艺下,用70%体积分数乙醇进行洗脱时金丝桃素的含量为53.22%,是原提取液含量3.71%的14倍[17],说明70%体积分数的乙醇洗脱液不仅将金丝桃素洗脱下来也带出了较多的杂质。将洗脱剂设置为梯度洗脱后,水、40%、95%体积分数的乙醇溶液分别能将更多极性较大或较小的杂质带出,纯化率提高了25.89%,达到79.11%。测定实际的纯化率为77.763%,RSD为2.38%,说明HZ-801大孔吸附树脂可以很好的分离金丝桃素,优化后的工艺能有效的纯化金丝桃素,其结果与王海燕研究结果一致[16],也符合康毅华等[20]用HZ-818大孔树脂较好富集山楂总黄酮的研究结果,说明HZ系列大孔吸附树脂主要由于范德华力或氢键的作用对多酚物质具有较好的吸附性。应在此基础上对金丝桃素的纯化进行小试、中试,为金丝桃素分离纯化的工业化发展提供技术支持。与以往文献报道一致的是梯度洗脱已经成为金丝桃素纯化较好的洗脱方法[15],通过梯度洗脱,将洗脱液按照不同比例混合使其极性发生变化可以起到较好的除杂、纯化作用。另有文献指出硅胶[14]、聚酰胺更有利于金丝桃素的纯化,有待进一步研究。
但需要注意的是本试验中金丝桃素的分离纯化均是在弱光条件下完成,今后课题组会进一步研究氧、pH值、光等对金丝桃素分离纯化的影响,并以此为突破口,期待金丝桃素的纯度能有更大的提高,进一步改进工艺便于工业化生产的进行。
[1] 梁巧丽,高宏成.金丝桃素的研究进展[J].中草药.1999,30(9):705-708.
[2] Miskovsky P. Hypericin-a new antiviral and antitumor photosensitizermechanism of action and interaction with biological macromolecules [J]. Carr Drug targets,2002,3(1): 55-48.
[3] Prince A M, Pascual D,Merudo D.Strategies for evaluation of enveloped virus inactivation in red cell concentrates using hypericin [J]. Photochem Photobiol,2000,71 (2):188- 195.
[4] 王晓利,刘金钏,张俊松,等.光源对金丝桃素光动力体外抗肿瘤作用的影响[J].华西药学杂志,2008,23(1):47-79.
[5] Harrer G,Schulz V. Clinical Investigation of the Antidepressant Effectiveness of Hypericum[J].J Geriatric Psychiatry and Neurology,1994, 7: 6.
[6] Vlietinck A J, De Bruyne, Apers S,etal. Plant - derived leading compounds for chemotherapy of human immunodefciency virus ( HIV) infection [J] . Planta M ed, 1998, 64( 2) :97.
[7] Hudson J B, Bazzocchi L, Towers G H N. Antiviral activity of Hypericin[J].Antiviral Res, 1991, 15: 101.
[8] Carpenter S ,Kraus G A. Photosensitization is required for inactivation of equine in fectious anemia virus by hypericin[J]. Photochem Photobiol, 1991, 53( 2) : 169-174.
[9] Park J, English D S, Wannemuehler Y,etal. The role of oxygen in the antiviral activity of hypericin and hypocrellin[J]. Photochem&Photobiol, 1998, 68( 4) : 593 -597.
[10]M firossay L, Mfirossay A, Kocisov E,etal. Hypericin-in
duced phototoxicity of human leukemic cell line HL-60 is potentiated by omeprazole, an in hibitor of H + K + -AT P ase and 5-(N, N-dimeh ty )-am iloride, an inhibitor of M+/H+exchanger [J] . Physiol Res, 1999, 48 ( 2) : 135 -141.
[11]张克勤,蒋丽,张俊杰,等.金丝桃素抗鸡球虫效果观察[J].湖北农业科学.2012,51(19):4316-4320.
[12]王晓菊,张立伟.金丝桃素的稳定性[J].光谱实验室,2005,22(4):797-800.
[13]黄英,张迪清,何照范.金丝桃素提取分离工艺的研究[J].食品研究与开发.2001,22(3):20-21.
[14]王曙阳,崔颖,梁剑平.金丝桃素提取、分离方法的研究[J].中兽医医药杂志.2007,38(6):67-69.
[15]王晓菊,张立伟.贯叶连翘中金丝桃素分离工艺的研究[J].山西大学学报(自然科学版).2005,28(1):75-77.
[16]王海燕,李宁,李晓露,等.高纯度金丝桃素生产工艺研究[J].河北化工.2007,30(5):39-40.
[17]薛晓丽,费洋,杨丽娟.响应面法优化金丝桃素提取工艺研究[J].江苏农业科学.2014,42(4):221-223.
[18]吴彩娥,方升佐,徐琳,等.青钱柳叶三萜大孔吸附树脂纯化工艺[J].农业机械学报.2010,41(9):143-148.
[19]张克勤,薛晓丽,孔令瑶,等.长柱金丝桃中金丝桃素的含量变化[J].中国药学杂志.2011,46(3):174-176.
[20]康毅华,王维龙,孟凡佳,等.大孔吸附树脂富集山楂总黄酮的工艺研究[J].黑龙江医药.2010,30(10):1311-1313.
(编辑:陈希)
Separation and Purification of Hypericin inHypericumperforatumL. by Macroporous Adsorption Resins
XUE Xiao-li1,3,FEI Yang2,ZHANG Xin-hui1,3,SONG Hai-yan1,3,ZHANG Ke-qin1,3*
(1.JilinProvinceKeyLaboratoriesinuniversitiesforUsingandProtectingofAnimalandPlantResourcesinChangBaimountain,JilinJilin, 132101,China; 2.TraditionalChinesemedicineCollegeofJilinAgriculturalScienceandTechnologyUnivercity,JilinJilin, 132101,China;3.ExperimentCenterofJilinAgriculturalScienceandTechnologyUnivercity,JilinJilin,132101,China)
To investigate the performance of hypericin in 6 macroporous adsorption resin by separating and purificatingHyperforinperforatumL. in crude extrects.The static adsorption and the dynamic adsorption are used in investigation of macroporous adsorption resin and the MV separation system is used in studying the condition of separation and Purification. The results showed that HZ-801 was the best separation filler for its high absorption rate and high elution rate. The optimum conditions for separation and purification: the concentration of sample extracts is 0.1125 g/ mL, the injection rate is 5.0 mL/min, the elution rate is 20 mL/min, ethanol gradient is 0%~95% and the purity of hypericin is 79.11%. Macroporous adsorption resin HZ-801 can be better separated and purified hypericin and the optimized process has better practical and reference value .
macroporous resins; purification; hypericin;HypericumperforatumL.
吉林省科技计划重点项目( 20140204055yy)
薛晓丽,副教授,从事天然产物中有效成分的分离与分析研究。
张克勤。E-mail:Keqinzhang@hotmail.com
2016-05-19
A
1002-1280 (2016) 07-0020-06
S853.74

