沙生针茅种子发芽试验
郭春秀,姚 拓,李发明,王理德,朱淑娟,刘淑娟,刘克彪
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.甘肃省治沙研究所/甘肃省荒漠化与风沙灾害防治国家重点实验室,甘肃 兰州 730070)
沙生针茅种子发芽试验
郭春秀1,姚 拓1,李发明2,王理德2,朱淑娟2,刘淑娟2,刘克彪2
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.甘肃省治沙研究所/甘肃省荒漠化与风沙灾害防治国家重点实验室,甘肃 兰州 730070)
采用不同方法处理沙生针茅(Stipaglareosa)种子,测定沙生针茅种子发芽率和种子出苗率,以探明影响沙生针茅种子萌发和播种出苗的制约因素。结果表明:60℃蒸馏水浸泡种子24 h,种子吸水率、发芽率、发芽势分别为26.3%,38.0%和32.0%;-20℃、20℃低温变温处理96 h,发芽率和发芽势分别为46%和48%;用80 mg/L GA3水溶液浸泡种子24 h,发芽率和发芽势分别为54%和48%;沙埋深度会影响沙生针茅种子发芽和出苗,沙埋0.5 cm沙生针茅的种子发芽率和幼苗出土率最高;埋深超过2 cm的深度,发芽率和出苗率降低;埋深6~8 cm,随着沙埋深度增加,出苗率显著减少;当埋深>8 cm的深度,沙生针茅出苗率为0。
沙生针茅;温水浸泡;不同温度处理;盐胁迫;发芽率
沙生针茅(Stipaglareosa)是荒漠区多年生密丛型禾本科(Gramineae)针茅属(Stipa)超旱生丛生禾草;其地上部分为基生叶丰富的下繁草,叶片为细线型;地下部分为须根较粗轫,具保水抗旱作用的“根套”或称“沙套”,有较强的保水能力和抗旱性[1]。植株生长早年或特别干旱的年份不抽茎结实[2]。沙生针茅对干旱气候具有很强的适应能力,具有耐高温、耐强光、耐干旱、耐盐碱、耐瘠薄、耐沙埋和抗风沙的特点,对保持当地生态稳定和生物多样性意义重大。由于长期生长在沙质、砂砾质棕钙土地带,沙生针茅在环境的适应方面形成了自身的特点。其萌发早,颖果无危害,各种牲畜均喜食,为荒漠草原地带优等饲用植物,特别是冬季枯草能完整的保存,有抓膘(早春) 和保膘(冬季) 作用,株丛低矮,最适于牧羊,但具灌丛的沙生针茅草地则适于牧驼。有关沙生针茅的研究刚刚起步,主要是研究种子萌发特性等方面[3]。鉴于此,通过分析沙生针茅种子适宜萌发条件,筛选其最佳萌发条件,提高种子萌发率;并开展育苗技术试验,为沙生针茅的驯化栽培以及深入研究和开发利用奠定基础。
1 材料和方法
1.1 材料来源
于2012年6月在甘肃省民勤连古城国家自然保护局沙地草地生态研究定位站附近自然分布的沙生针茅植株上,采集其成熟的颖果(简称种子)。试验站地理位置N 38°22′45″,E 103°16′ 48″,位于甘肃省民勤县东南腾格里沙漠南缘,海拔1 475 m。年平均气温为6.0~8.5 ℃,年平均降水量为110.0 mm,并且集中在7~9月。采收后的种子用特制牛皮纸种子袋贮藏于自然通风的室内备用。
1.2 试验方法
有些禾本科植物种子通过干藏就可以解除休眠,为了验证沙生针茅种子是否真真存在休眠现象,发芽试验于2013年6月开始。
1.2.1 种子大小和重量 采用精度为0.001的天平测定种子的千粒质量,3次重复,计算平均值。种子大小用游标卡尺测量20粒种子的长度和直径,计算平均值。
1.2.2 种子处理方法 (1)将种子置于烧杯分别用30℃、40℃、50℃、60℃、70℃的蒸馏水各500 mL浸泡种子,在室内常温(20℃)自然冷却,24 h后捞出种子,沥干水分;(2)低温处理,将种子置于冰柜和冰箱内-5℃、-10℃、-15℃、-20℃、-25℃环境中96 h;(3)赤霉素(GA3)处理,用酒精溶解GA3,电子天平配制20、40、60、80、100 mg/L浓度GA3水溶液200 mL,分别用不同浓度的GA3水溶液浸泡种子2 h;(4)沙埋处理,采用破除种子非深度生理休眠常规方法,对种子进行4周的低温(-5℃)沙藏以打破休眠[4]。3种方式处理均以未处理的种子直接发芽作为对照。
1.2.3 萌发试验 采用培养皿纸上发芽方法,试验前种子用5%高锰酸钾溶液消毒10 min,后用蒸馏水冲洗数遍,在培养皿中铺3层滤纸且用蒸馏水浸湿,然后将种子整齐摆放在滤纸上,每个培养皿50粒种子,每个处理3个重复。后将培养皿置于25℃黑暗条件下,湿度为60%的培养箱中进行发芽培养,每天定时观测记录发芽种子数,种子的萌发以胚根的出现为标志[5],连续3 d不再有种子萌发,结束发芽试验,并计算种子发芽率、发芽势和发芽指数。种子的萌发试验在3 mL蒸馏水的培养皿中培养,并在试验中补充因蒸发而丧失的水分。
发芽率GR(%)=(正常萌发种子数/供试种子总数)×1.00%
发芽势GP(%)=(在发芽前10 d内正常萌发的种子数/供试种子总数)×100%
1.3 数据处理
采用SPASS 19.0和Excel 2013进行数据统计分析。
在收入、支出、管理和分配等经济活动中,资产管理是非常重要的一部分,资产支出方面的管理工作分为两类,一种是经常性支出,另一种是资本性支出,其中行政事业单位的资产是由资本性支出形成的。资产在单位的使用过程中也会获得收益,比如对外进行投资获得收益、资产进行租赁时获得收益等。根据《开封市祥符区行政事业单位国有资产对外有偿使用管理暂行办法》的要求,行政事业单位资产租赁时间不超3年,最佳租赁时间1年,收入上缴财政专户,这些收益的获得也是依赖单位的资产,因此,将行政事业单位的资产管理和预算管理科学的进行结合已是当前经济形势下必须实行的管理模式。
2 结果与分析
2.1 种子大小和千粒质量
去芒的沙生针茅种子被坚硬的颖壳(内外稃)包裹,为褐色,呈长条形或长棒状,长8.4~10.7 mm,直径0.48~0.80 mm,芒脱落处截面呈圆形,近胚端有细尖倒钩;脱去内外稃的种子呈深褐色,长度是5.06~6.17 mm,直径0.47~0.75 mm;带稃的种子千粒质量为2.05 g,单粒种子平均质量为(2.0±0.05) mg。用电子解剖镜解剖并照相(图1)。

图1 用立体显微镜(YYL-830E)拍摄沙生针茅种子照片Fig.1 S.glareosa seed by stereo microscope (YYL-830E)注:左起,分别为带稃种子、去稃种子、沿腹沟纵切面、初萌发种子和萌发48 h的种子
2.2 不同处理对沙生针茅种子发芽的影响
2.2.1 热水浸泡处理 随着浸泡的水温升高,发芽率逐渐升高,当蒸馏水温达到60℃时,发芽率达到最大值,当浸泡种子的水温超过60℃时,种子发芽受到抑制,发芽率也降低。用不同温度蒸馏水浸泡种子后,在试验2~4 d后出现种子发芽高峰期,60℃蒸馏水浸泡的种子的发芽率、发芽势均最高,分别达到38%和32%,在试验的2、3、4 d,种子的发芽率分别是CK的4.5、5.5、3.5倍,发芽第10 d,种子的发芽率、发芽势分别是CK的4.75倍和4倍,用70℃蒸馏水浸泡的种子,发芽的第10 d,其发芽率是CK的4.5倍,发芽势是CK的3.25倍(图2,3)。
2.2.2 不同温度梯度对发芽率的影响 沙生针茅的种子萌发率和幼苗出土率在不同的温度环境表现出极显著差异(P<0.01)(图4)。从5℃到25℃随着温度的增加,沙生针茅的种子发芽率和幼苗出土率均显著增加,其中在25℃时,种子发芽率最高。从25℃到40℃随着温度的增加,沙生针茅的种子发芽率和幼苗出土率均呈现逐渐降低的趋势(图4,表1)。
2.2.3 不同低温处理对发芽率的影响 各低温处理的种子发芽率差异不显著,但比CK提高20%~30%,其中4℃层积20 d的种子发芽率最高,可达43%。4℃层积10 d的种子发芽势显著高于CK和其他处理。
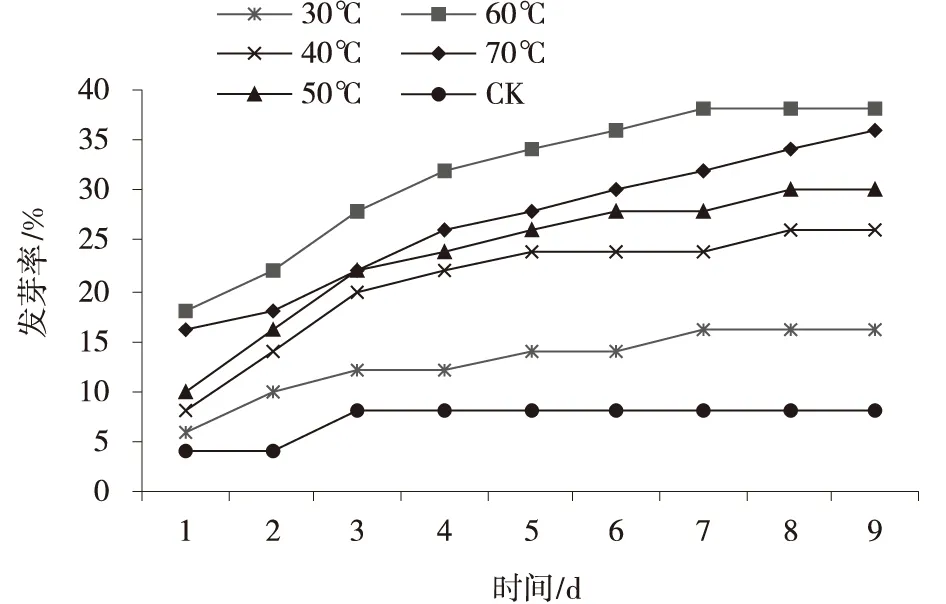
图2 不同温度蒸馏水浸泡沙生针茅种子发芽率Fig.2 Germination rate of S.glareosa seeds soaked in distilled water at different temperatures
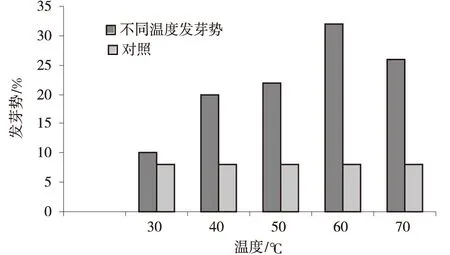
图3 不同温度蒸馏水浸泡沙生针茅种子发芽势Fig.3 Potential germination rate of S.glareosa seeds soaked in distilled water at different temperatures
模拟沙生针茅种子自然状态下越冬环境,用不同低温变温处理种子 (图4,5),种子发芽的高峰期在2~5 d,5 d后有缓慢增加的趋势;发芽第10 d,-20℃低温变温处理的种子,发芽率和发芽势均最高,达到48%和46%,发芽率是CK的6倍,发芽势是CK的3.5倍(图6)。
方差分析表明,不同低温变温处理的种子,种子发芽率存在极显著差异,随着温度的降低,种子经低温变温处理,其发芽率明显升高,在-20℃时,达到最大值,超过-20℃,种子发芽率降低。发芽势和发芽率的变化趋势相一致。
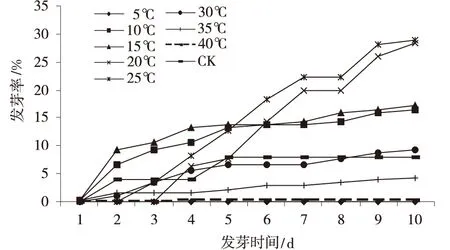
图4 不同温度梯度沙生针茅种子发芽率Fig.4 Germination rate of S.glareosa seeds at different temperature gradients
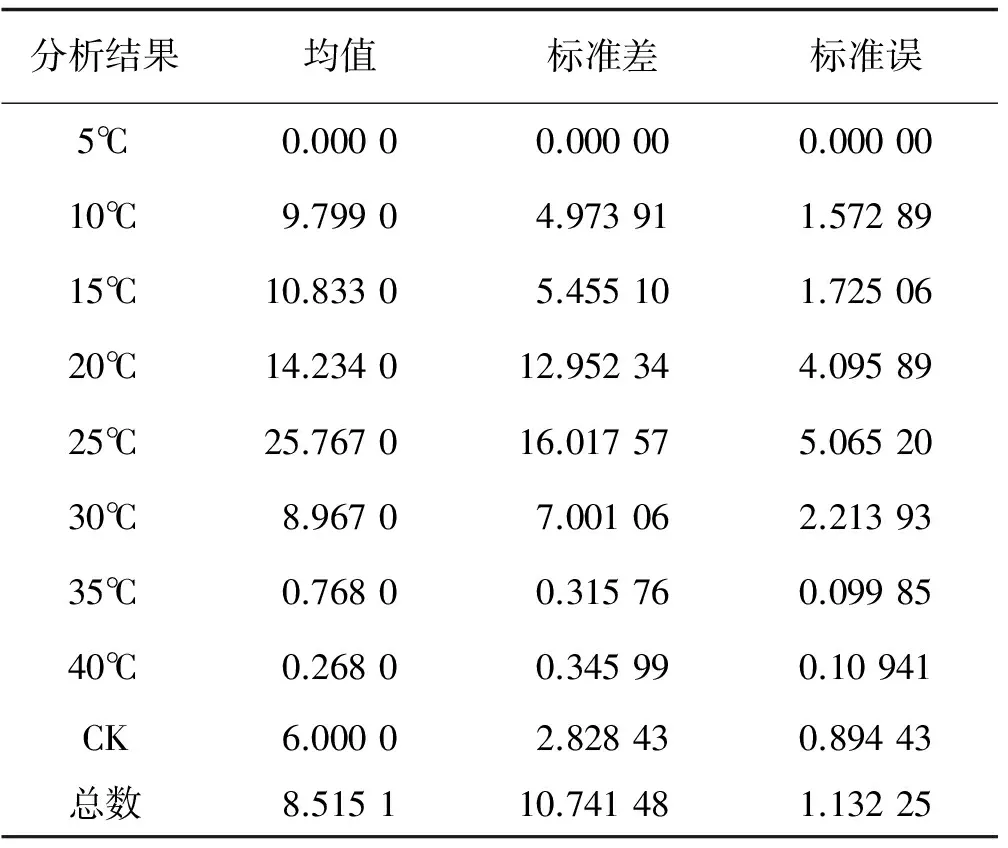
分析结果均值标准差标准误5℃0.00000.000000.0000010℃9.79904.973911.5728915℃10.83305.455101.7250620℃14.234012.952344.0958925℃25.767016.017575.0652030℃8.96707.001062.2139335℃0.76800.315760.0998540℃0.26800.345990.10941CK6.00002.828430.89443总数8.515110.741481.13225
注:不同温度下萌发率的显著差异(P=0.000<0.05)
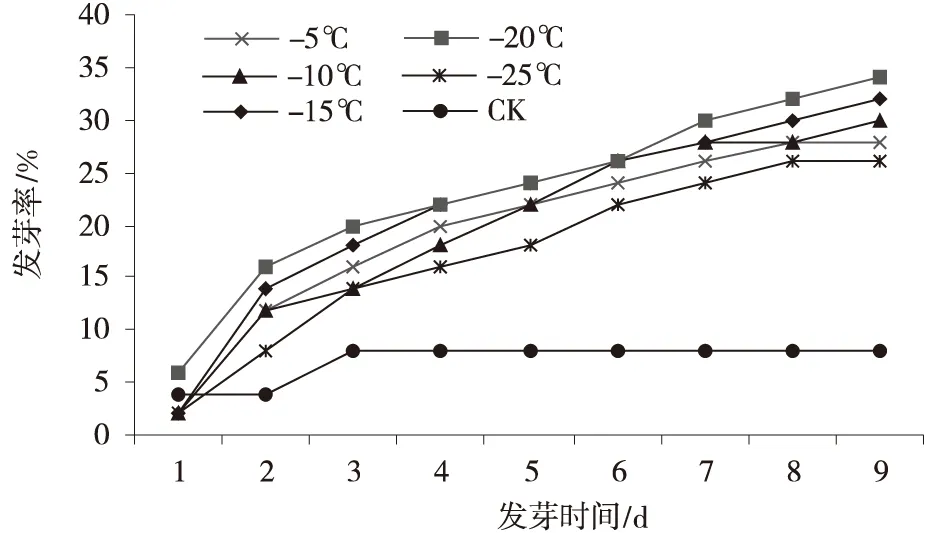
图5 不同低温处理种子发芽率Fig.5 Seed germination rate under different low treatments
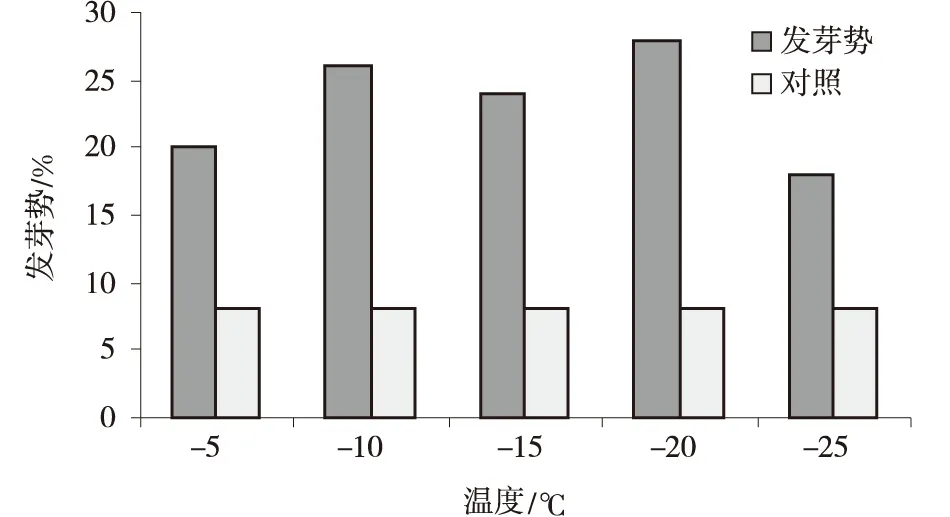
图6 不同低温处理种子发芽势Fig.6 Seed germination potential of Stipa glareosa under different low temperature treatments
2.2.4 不同沙埋深度对种子萌发率及幼苗出土率的影响 不同的沙埋深度,沙生针茅种子的萌发率和幼苗出土率均表现出极显著差异(P<0.01)(图6)。沙埋在0~2 cm,随着不同沙埋深度的增加,沙生针茅的种子萌发率和幼苗出土率均呈现显著增加趋势,其中沙埋0.5 cm的种子萌发率和幼苗出土率最高。在2~6 cm,随着沙埋深度的不断增加,种子萌发率和幼苗出土率均呈现显著降低趋势。6~8 cm的深度,随着沙埋深度的不断增加,幼苗出土率呈现显著减小趋势,不到20%(图6)。
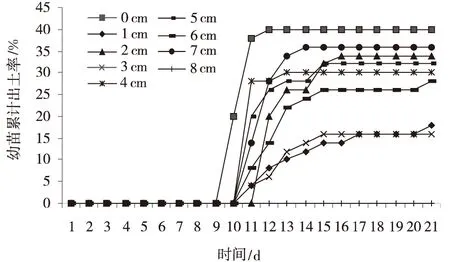
图7 不同沙埋深度的沙生针茅种子在21 d内的幼苗出土率Fig.7 Seedling emergence rate of seeds buried in different depths in 21 days注:8 cm的幼苗出土率为0
为了检测未萌发种子的生理状态,试验用种子活性来测试,结果表明,大部分种子都处于休眠状态。在沙层的表面,由于种子胚暴露在空气中,而且强烈的蒸发又会造成种子水分缺乏而导致30%~40%的种子进入休眠状态。在沙层的下面,大部分种子由于被沙埋,而进入休眠状态。当埋深2~6 cm时,种子休眠程度随着沙埋深度的增加而呈现显著增加趋势(P<0.01)。在埋深6~8 cm,种子的休眠率保持在60%,其中,有一部分种子由于没有萌发已经死亡。研究表明,沙生针茅种子在沙层的表面的死亡率达到最高,为42.8%;埋深1~2 cm处的种子死亡率达到最低,为15%;埋深4~12 cm的种子死亡率为30%~35%。
不同沙埋深度对幼苗首次出土所需的时间影响显著 (P<0.01)。埋深为0.5 cm时,幼苗首次出土所需的时间最少,大约是8 d。沙层表面的种子,幼苗首次出土所需的时间显著大于1~2 cm沙埋时幼苗出土所需的时间。在2~6 cm,沙埋越深,幼苗出土所需的时间越长。
2.2.5 激素处理对种子萌发的影响 用GA3处理种子,种子发芽的高峰期集中于2~8 d,发芽率越高,发芽高峰期越延后。随着GA3浓度的增大,发芽率也逐步升高,当GA3浓度达到80 mg/L时,发芽率达到最高峰,而后随着GA3浓度的增加,发芽率呈现逐渐降低趋势。在发芽的第10 d,用GA380 mg/L处理的种子,其发芽率是CK的6.75倍,发芽势是CK的6倍,发芽势和发芽率的变化趋势相一致(图8,图9)。
方差分析表明,用不同浓度GA3溶液处理的种子,其发芽率和发芽势都存在显著差异。
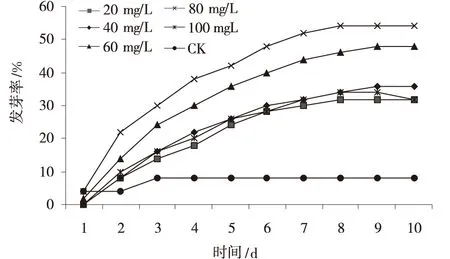
图8 不同GA3浓度处理沙生针茅种子发芽率Fig.8 Seed germination rate of seeds treated in different GA3 concentrations
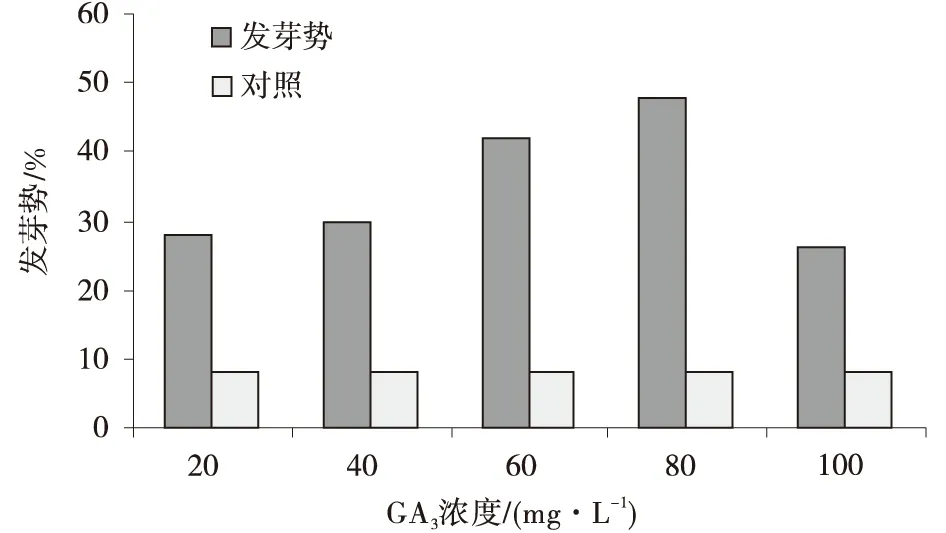
图9 不同GA3浓度处理沙生针茅种子发芽率Fig.9 Germination potential of Stipa glareosa seed treated in different GA3 concentrations
3 讨论
GA3溶液不但可以提高种子内淀粉酶活性,而且可以加快种子代谢活动,从而提高种子萌发能力[6-7]。因此,研究中,随着GA3浓度的增加,沙生针茅种子发芽率达到80%时,之前或之后均有降低趋势。说明抑制沙生针茅萌发的原因可能不是种子内部生理状态所致。
低温层积使种子置身于湿冷环境中,可以软化种皮,增加种子的通气透水性,并可以进一步促进种子的萌发[8]。经低温、GA3溶液浸种处理均能显著提高种子发芽率。其中80 mg/L GA3溶液浸种的沙生针茅种子萌发效果最好,发芽率达到54%,其次是4℃低温处理20 d的种子萌发效果较好,种子萌发率达到46%(图8)。
沙埋种子的萌发率受诸多因素的影响。在自然状态下,春秋季结实的种子,随着冬季降雪,土壤的冻溶交替,种子被大自然低温变温处理,会促进少部分种子在春季的萌发,这和野外调查未发现夏秋季有沙生针茅幼苗出土生长相一致。对于沙蒿属(Artemisia)的光敏感种子来说,穿透沙层的光照强度、土壤湿度、土壤温度和盐分等综合因素调节着种子在不同沙层深度的萌发[9-11]。在民勤干旱荒漠区流动覆沙地上,种子被传播以后,除了部分被昆虫和鸟类等动物摄食外,还有一些种子会沿着植物的枯枝落叶或者其他沉积物而积累在沙层的表面,随着沙层的运动它们会被埋于不同的深度[12]。研究表明,沙层深度影响沙生针茅种子萌发。在0~8 cm,随着沙层埋深的增加,种子萌发率就越低(图6)。根据野外观察,流动沙地的表层由于太阳光照射造成的高温而使沙层表面迅速变干,所以很难在沙层表面发现大量萌发的种子。在阴雨连绵的天气中,沙层表面也会偶尔出现种子的高萌发率,但是在沙层表面萌发的种子,其幼根却很难扎入沙层。这表明种子需要浅层的沙埋处理,这样有助于增加种子与周围土壤和沙子的的接触以提高相对湿度,对提高种子萌发和幼苗成功定居提供可能性[13]。
沙埋深度对幼苗出土有很大的影响,在0~6 cm的深度,种子沙埋越深,则出苗率就越低;在8 cm的深度,幼苗萌发出土率为0。而且,在沙层表面还有部分幼苗不能萌发出土。例如,在沙埋6 cm以下的种子,沙层表面种子萌发率和幼苗出土率不到20%。究其原因是由于这些种子没有足够的能量破土长出地表。之后,它们会在地表下死亡并且腐烂。有时种子的质量和大小可能影响幼苗在沙层的不同深度出土[14]。种子被沙埋越深,越多的种子进入强迫休眠状态。在8 cm深处,沙生针茅种子萌发率和出苗率均为0(图6)。通过对6种一年生沙丘植物萌发的观察结果表明,即种子随着沙埋深度的增加,强迫休眠的程度也增加[15]。究其原因可能是土壤O2浓度含量较低和CO2浓度过高以及光照强度不足和土壤通气情况不良等能够导致强迫休眠的发生[16]。沙生针茅种子在沙埋8 cm深处是否部分或全部处于强迫休眠状态,尚需继续研究。
研究结果表明,在土壤较深且深度不良的通气状态是导致沙生针茅种子进入强迫休眠的主要原因之一。对沙生针茅来说,土壤中处于休眠状态的种子会形成长期的种子库,种子库的形成有利于物种的长期生存,具有生态学方面的优势[17],并且在合适的土壤深度,种子暴露在土壤表层具有萌发和长出幼苗的潜能。研究表明,几种沙丘植物也具有这种现象如:新疆大赖草(Leymusracemosus)、蒿属的几种植物在种子萌发试验中也被观察到[18]。土壤种子库中,在同一时间只有部分种子萌发和幼苗出现的现象,是由于沙层移动的调节机制导致的,这与野外调查研究的结果一致。
在早期,沙生针茅的幼苗只发育出一条根。沙生针茅种子萌发出的幼苗可能由于无后续的降水,或者由于沙蚀的作用将幼苗的根暴露出地表,而使整个幼苗受到干燥脱水的影响。干燥前幼根的湿润程度和干燥时间的长短对沙生针茅幼苗的生长恢复有影响。干燥时间越长,重新水合后,幼苗的恢复率就越低,在忍耐干燥后,幼苗的恢复生长率就越低[19]。但是,在达到耐干燥脱水的“极限点”之前,干燥的幼苗在遇到下次雨水后具有重新恢复生长的能力。因此,沙生针茅幼苗的存活率可能由于其耐干燥脱水能力而提高。沙生针茅幼苗的耐干燥脱水能力具有重要的生态学意义。在民勤荒漠区沙生针茅的自然生境的流动沙地上,降水的时间和降水量是不可预测的[20]。
4 结论
促进沙生针茅种子萌发的因素主要有:60℃蒸馏水浸泡种子24 h,种子吸水率、发芽率、发芽势分别达到26.3%,38%和32%,发芽率和发芽势显著提高;低温和GA3浸种处理能显著提高种子发芽率。其中80 mg/L GA3溶液浸种的萌发效果最好,发芽率达54%,其次是4℃低温处理20 d萌发效果好,萌发率达46%。沙埋深度影响沙生针茅种子发芽和出苗,沙埋0.5 cm处沙生针茅的种子发芽率和幼苗出土率最高,埋深超过2 cm,发芽率和出苗率降低。试验结果表明,沙生针茅发芽3基温即最低温度是10℃、最适温度是25℃、最高温度是35℃(图4)。
[1] 王瑾,王垄.植物根系沙套的生态功能及其形成影响[J].草原与草坪,2009,133(2):88-92.
[2] 刘媖心.中国沙漠植物志第一卷[M].北京:科学出版社,1985:110-113.
[3] 李发明,刘淑娟,张莹花,等.光照和沙埋对沙生针茅种子萌发和幼苗出土的影响[J].中国农学通报,2013,29(31):47-52.
[4] 何学青,胡小文,王彦荣,等.羊草种子休眠机制及破除方法研究[J].西北植物学报,2010,30(1):120-125.
[5] 邰建辉,王彦荣,陈谷.无芒隐子草种子萌发、出苗和幼苗生长对土壤水分的响应[J].草业学报,2008,17(3):105-110.
[6] 马红媛,两正伟,黄立华,等.4种外源激素处理对羊草种子萌发和幼苗生长的影响[J].干旱地区农业研究,2008,26(2):69-73.
[7] 陈玉燕,李立芹.3种生长调节剂对黑麦草种子萌发的影响[J].种子,2011,30(7):91-93.
[8] 翟辉,周军,刁春武.不同温度、时间层积处理对北美娥掌楸种子萌发的影响[J].林业科技开发,2005,19(5):17-19.
[9] Huang Z Y,Gutterman Y,Hu Z H,etal.Seed germination in Artemisia sphaerocephala Ⅱ.The influence of environmental factors[J].Acta Phytoecologica Sinica,2001,25(2):239-246.
[10] Huang Z Y,Gutterman Y.Artemisia monosperma achene germination in sand:effects of sand depth,sand/water content,cyanobacterial sand crust and temperature[J].Journal of Arid Environments,1998,38(1):27-43.
[11] Huang Z Y,Gutterman Y.Comparison of germination strategies of Artemisia ordosica with its two congeners from deserts of China and IsraeI[J].Acta Botanica Sinica,2000,42(1):71-80.
[12] Maun M A.Adaptation of plants to burial in coastal sand dunes[J].Canadian Journal of Botany,2011,76(5):713-738.
[13] 黄振英,董鸣,张淑敏.沙鞭(禾本科)种子在沙丘上的萌发策略及幼苗的耐干燥特性[J].生态学报,2005,25(2):298-303.
[14] Zhang J,Maun M A.Effect of partial removal of endosperm on seedling sizes of Panicum virgatum and Agropyron psammophilum[J].Oikos,1989,56:250-255.
[15] Pemadasa M A,Lovell P H.Factors controlling germination of some dune annuals[J].Journal of Ecology,1975,63:41-59.
[16] Harper J L.Population Biology of Plants[M].London:Academic Press,1977.
[17] 朱雅娟,董鸣,黄振英.沙埋和种子大小对固沙禾草沙鞭的种子萌发与幼苗出土的影响[J].植物生态学报,2005,29(5):730-739.
[18] Baskin J M,Baskin C C.Effect of wetting and drying cycles on the germination of seeds of Cyperus inflexus.Ecology,1982,63:248-252.
[19] Gutterman Y.Survival Strategies of Annual Desert Plants.Adaptations of Desert Organisms[M].Berlin:Springer-Verlag,2002.
[20] Zhang X.Principles and optimal models for development of Maowusu Sandy Grassland[J].Acta Phytoecologica Sinica,1994,18:1-16.
Test of seed germination of Stipa glareosa
GUO Chun-xiu1,YAO Tuo1,LI Fa-ming2,WANG Li-de2,ZHU Shu-juan2, LIU Shu-juan2,LIU Ke-biao2
(1.CollegeofPrataculturalScience,GansuAgriculturalUniversity,Lanzhou730070,China; 2.KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,Lanzhou730070,China; 3.GansuDesertControlResesrchInstitiute/StateKeyLaboratoryBreedingBaseofDesertificationandAeolianSandDisasterCombating,Lanzhou730070,China)
The seed germination rate and seedling emergence rate ofStipaglareosaunder the treatments of light exposing,water soaking,alternating temperature,soaking with gibberellic acid solution (GA3) and sand burial were tested.The results showed that the water absorption rate,germination rate and germination potential rate of the seeds soaked with 60℃ distilled water for 24 hours were 26.32%,38% and 32% respectively.The seed germination rate reached 46% under -20℃/20℃ alternating temperature treatment for 96 hours.The seed germination rate was 54% under soaking treatment with 80 mg/L GA3solution for 24 hours.The rates of seed germination and seedling emergence depended on sand burial depth and reached the highest when burial depth was 0.5 cm.The seed germination and seedling emergence rates decreased when the burial depth exceeded 2 cm,and significantly decreased while the burial depth ranged from 6 to 8 cm,and decreased to 0 while the depth was over 8 cm.
Stipaglareosa;warm water soaking;different temperature processing;salt stress;seed germination rate
2015-09-23;
2016-04-19
国家地区基金项目(31560128;31160264; 31160116)资助
郭春秀(1979-),女,甘肃民勤县人,助理研究员,博士研究生。主要从事荒漠生态及草地生物多样性研究。 E-mail:guochunxiu0414@163.com 姚拓为通讯作者。
S 543
A
1009-5500(2016)05-0087-07

