低温胁迫对紫花苜蓿生理指标的影响
马周文,秘一先,鲁学思,廖斌太,郭志强,师尚礼
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
低温胁迫对紫花苜蓿生理指标的影响
马周文1,秘一先2,鲁学思2,廖斌太2,郭志强2,师尚礼1
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
以俄罗斯杂花苜蓿和3个紫花苜蓿抗寒品系为试验对象,通过0℃,4℃低温胁迫处理,以22℃(室温)为对照,测定3个紫花苜蓿抗寒品系茎、叶的可溶性糖(SS)、游离脯氨酸(FP)、丙二醛(MDA)、可溶性蛋白(SP)的含量和超氧化物歧化酶(SOD)、过氧化氢梅(CAT)、抗坏血酸地氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)的活性。以明确低温胁迫对紫花苜蓿的生理影响,及各项生理指标变化有效作用阈值与紫花苜蓿抗寒耐受能力的相关程度,筛选出了对紫花苜蓿抗寒性指示作用较敏感的生理指标及其有效作用阈值。结果表明:温度阈值上限SS为0℃,FP为4℃,SP为0℃,MDA为4℃,SOD、CAT、APX及GPX活性低温处理下的变化差异不显著,表明这些生理指标在低温胁迫时反应不敏感。
紫花苜蓿;抗寒性;阈值
紫花苜蓿(Medicagosativa)为豆科苜蓿属多年生草本,是全世界栽培历史悠久、面积最大、经济价值高的牧草,素有“牧草之王”的美称,其适应性广、产量高、适口性好,可消化粗蛋白质含量、维生素含量和动物必须氨基酸含量高,在我国畜牧业产业发展及生态环境治理和沙化、退化、盐渍化治理等方面具有重要作用[1-2]。由于低温引起的冻害使紫花苜蓿生产蒙受巨大的经济损失,因此,紫花苜蓿抗寒性弱的问题已经成为苜蓿产业发展的主要制约因素。有研究报道,紫花苜蓿在冬季最低气温超过-20℃的地区越冬困难,易发生冻害[3]。在我国北方地区,冬季气温偏低,紫花苜蓿易发生冻害甚至死亡,因而抗寒能力差已成为影响我国北方苜蓿生产的关键问题。
国内外对紫花苜蓿在低温胁迫条件下的抗寒性机理及其应用方面的研究日益受到重视,已有研究表明,牧草的耐寒性受多个基因控制,而基因表达受温度、光周期和土壤微环境等环境因素的影响[4]。近年来,紫花苜蓿抗寒性的研究多集中在对低温胁迫下各生理指标变化来确定其抗寒能力,也有将相关生理指标综合起来评定植物抗寒性强弱的研究[5-7]。在4 ℃低温条件下,苜蓿通过维持较高水平的SOD、POD 活性和提高脯氨酸绝对含量等保护机制来适应低温胁迫,减轻低温伤害[6]。
为了更加精确地通过抗寒性生理指标的有效作用值来评价抗寒性,试验通过确定各项生理指标变化有效作用阈值与紫花苜蓿抗寒耐受能力的相关程度,筛选出对紫花苜蓿抗寒性指示作用较敏感的生理指标及其有效作用阈值。
1 材料和方法
1.1 试验地概况
试验于2014年5月21日在甘肃农业大学草业生态系统教育部重点实验室进行。
1.2 试验设计
1.2.1 试验材料 试验材料共4份,其中俄罗斯杂花苜蓿(Medicagovaria)为对照(CK),抗寒1号品系(M.sativa.cv.AlgidusⅠ)(简写为K1)、抗寒2号品系(M.sativa.cv.AlgidusⅡ)(简写为K2)、抗寒3号品系(M.sativa.cv.AlgidusⅢ)(简写为K3),均由甘肃农业大学草业学院提供。
1.2.2 试验设计 2014年5月21日,使用育苗盆(口径10 cm,深度9 cm)对供试材料沙培种植,设置3个温度处理:22℃(对照,室温)、4℃、0℃,每处理3次重复。即2014年6月28日19∶00置于15℃培养箱中进行预冷处理5 h,之后分别在0℃、4℃下进行低温胁迫处理,对照组室温为22℃,并于19日9∶00开始采集茎、叶鲜样,所采样品均用液氮速冻后于-80℃冰箱中保存,用以测定生理指标。
1.3 各指标的测定
可溶性糖(SS)含量的测定采用蒽酮法参照文献[8];游离脯氨酸(FP)含量的测定采用茚三酮法;丙二醛(MDA)含量的测定采用硫代巴比妥酸法参照文献[9];可溶性蛋白(SP)含量的测定采用考马斯亮蓝(G-250)法和酶系统(SOD、POD、CAT、GPX)活性的测定参考文献[10]的方法。
2 结果与分析
2.1 低温胁迫对紫花苜蓿FP含量的影响
低温胁迫下,供试紫花苜蓿叶的FP含量均高于茎。K2和K3叶FP含量均随温度降低而增加,K1和CK叶FP含量均随温度降低呈先增加后降低的趋势。22℃处理下,除K2茎FP含量为0.002 4 μg/g,显著高于K1(P<0.05)之外,其他紫花苜蓿品系叶中FP含量差异不显著;在4℃处理下,各紫花苜蓿叶和茎中FP含量较22℃处理均有所增加,叶中以俄罗斯杂花苜蓿(CK)FP含量最高(0.0047 μg/g),显著高于K2和K3(P<0.05);在0℃处理下,各紫花苜蓿品系茎、叶FP含量变化均有差异,K1叶FP含量为0.002 0 μg/g,显著低于其他紫花苜蓿(图1)。
2.2 低温胁迫对紫花苜蓿SP含量的影响
低温胁迫下,各紫花苜蓿叶SP含量均高于茎。除K3外,其他紫花苜蓿叶SP含量均随温度降低而上升,K2和CK茎SP含量均随温度降低呈先降低后上升的趋势,K1 叶和茎的SP含量在各处理间差异不显著。22℃处理下,SP含量在各紫花苜蓿叶和茎中变化不显著;在4℃处理下,各紫花苜蓿的SP含量较22℃处均有所增加,以K3叶SP含量最高,为4.919 mg/g,显著高于K2(P<0.05),但K2和K3茎中SP含量显著低于CK;在0℃处理下,K2和CK叶SP含量较高,分别为6.179和5.682 mg/g,但各紫花苜蓿品系间差异不显著,但K2 和CK叶SP含量显著高于K1和K3(图2)。

图1 低温胁迫下紫花苜蓿FP含量 Fig.1 Effect of low-temperature stress on FP in Alfalfa
2.3 低温胁迫对紫花苜蓿SS含量的影响
随着温度的不断降低,各紫花苜蓿叶SS含量均呈先下降后上升的趋势,茎的SS含量普遍呈上升的趋势。在22℃处理下,各紫花苜蓿叶SS含量变化不显著,K3茎SS含量显著低于其他紫花苜蓿(P<0.05);在4℃处理下,各紫花苜蓿叶SS含量均低于在22℃和在0℃处理,K3和CK叶SS含量显著低于K1和K2(P<0.05),K3茎SS含量最高,但各紫花苜蓿品系茎SS差异不显著;在0℃处理下,紫花苜蓿叶SS含量为:K2>K3>CK >K1(P<0.05),茎SS含量以K2最高(图3)。

图2 低温胁迫下紫花苜蓿SP含量Fig.2 Effect of low-temperature stress on SP in Alfalfa
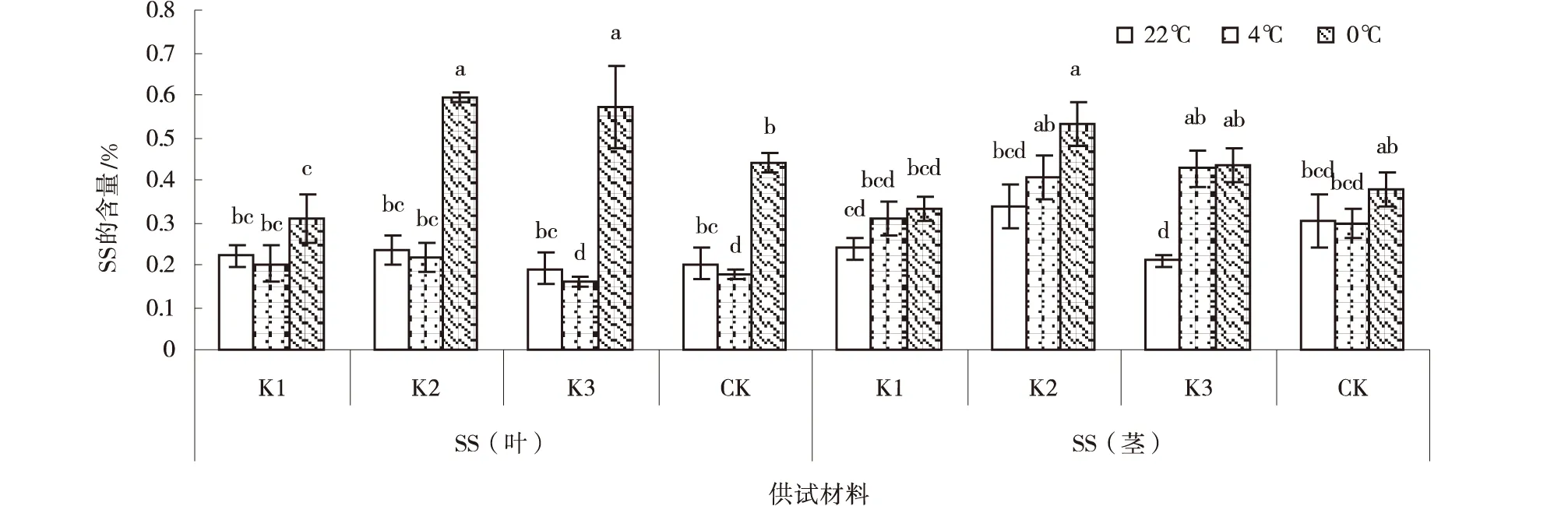
图3 低温胁迫下紫花苜蓿SS含量Fig.3 Effect of low-temperature stress on SS in Alfalfa
2.4 低温胁迫对紫花苜蓿MDA含量的影响
随着温度不断降低,K1叶MDA含量呈先上升后下降的趋势,K2和K3呈先下降后上升的趋势,CK呈持续上升的趋势;除K3外,各紫花苜蓿茎MDA含量呈现先下降后上升的趋势。在22℃处理下,MDA含量在各紫花苜蓿间差异不显著,以CK叶和K3茎最低,分别为0.155 1和0.199 0 μmol/L;在4℃处理下,以K2叶和茎中MDA含量均最低,但紫花苜蓿品系间差异不显著;在0℃处理下,K3叶MDA含量为0.302 2 μmol/L,低于其他紫花苜蓿品系,K3茎MDA含量为0.180 9 μmol/L,显著低于CK(P<0.05)(图4)。

图4 低温胁迫下紫花苜蓿MDA含量Fig.4 Effect of low-temperature stress on MDA in Alfalfa
2.5 低温胁迫对紫花苜蓿SOD含量的影响
低温胁迫下紫花苜蓿叶的SOD活性高于茎。各紫花苜蓿叶的SOD活性随温度不断降低呈现先下降后上升的趋势,处理间差异不显著,但除0℃处理的CK叶SOD活性显著高于22℃处理之外。K1和K2茎SOD活性随温度降低而降低,K3反之。其中,在22℃处理下,以CK的SOD活性最高,为393.9 μ/g,高于其他紫花苜蓿品系,紫花苜蓿品系叶和茎SOD活性变化差异不显著;在4℃处理下,各紫花苜蓿品系叶和茎SOD活性变化差异不显著;0℃处理较其他处理,SOD活性下降,以K1叶和CK茎SOD活性最低,分别为362.4和292.4 μ/g。
2.6 低温胁迫对紫花苜蓿CAT含量的影响
低温胁迫下,紫花苜蓿叶的CAT活性高于茎。CK叶及K2茎CAT活性随温度降低而降低,K2和K3叶CAT活性随温度降低呈现先下降后上升的趋势,K1叶与CK变化趋势相似,即为先增加后降低的趋势。在22℃处理下,各紫花苜蓿品系的叶和茎CAT 活性变化差异不显著;在4℃处理下,K1叶CAT活性为34.29 μ/g/min,显著高于其他紫花苜蓿品系。但各紫花苜蓿品系茎CAT活性变化差异不显著;0℃处理下,各紫花苜蓿品系的CAT活性普遍低于22℃处理,但叶和茎CAT 活性变化差异不显著(图6)。
2.7 低温胁迫对紫花苜蓿APX含量的的影响
低温胁迫下,紫花苜蓿叶的CAT活性低于茎。K1和K3叶及茎的APX活性均随温度降低呈先增加后降低的趋势,CK叶和K2茎APX活性随温度降低而升高。各紫花苜蓿品系的APX活性在处理间差异均不显著。其中,在22℃处理下,以CK叶中APX活性最高,为1.560 μ/g;在4℃处理下,以K1茎APX活性最高,达4.105 μ/g;在0℃处理下,以K2茎的APX活性最高,达5.907 μ/g(图7)。
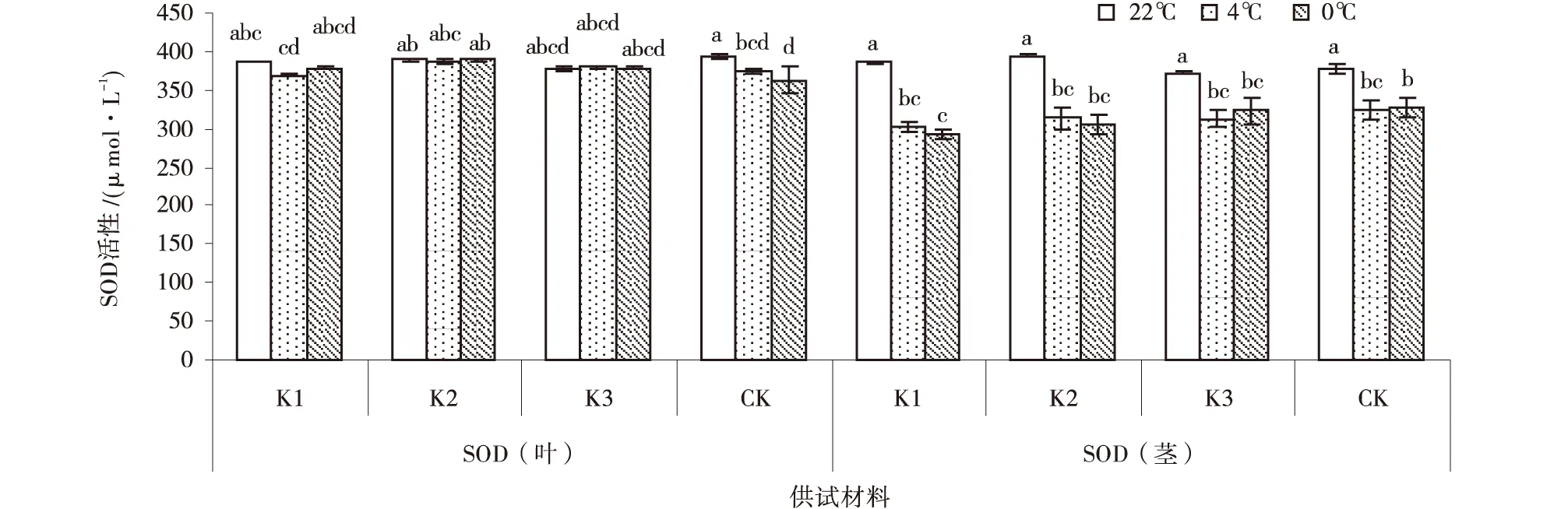
图5 低温胁迫下紫花苜蓿SOD含量Fig.5 Effect of low-temperature stress on SOD in Alfalfa

图6 低温胁迫下紫花苜蓿CAT含量Fig.6 Effect of low-temperature stress on CAT in Alfalfa
2.8 低温胁迫对紫花苜蓿GPX含量的影响
低温胁迫下,紫花苜蓿叶的GPX活性高于茎。K1,K3和CK叶GPX活性均随温度降低呈先降低后上升的趋势,K3和CK茎GPX活性随温度降低而降低。供试紫花苜蓿品系茎GPX活性在各处理间差异不显著。在22℃处理下,各紫花苜蓿品系间叶和茎GPX活性差异不显著,以K1叶中GPX活性最高,为2.383 μ/(g·min);各紫花苜蓿叶的GPX活性在4℃处理时均低于22℃和0℃处理,以K2叶和茎GPX活性最高,分别为0.7917 μ/(g·min)和0.862 0 μ/(g·min);在0℃处理下,以K1叶和K2茎GPX活性最高,分别为2.054 μ/(g·min)和0.860 3 μ/(g·min)。

图7 低温胁迫下紫花苜蓿APX含量Fig.7 Effect of low-temperature stress on APX in Alfalfa

图8 低温胁迫下紫花苜蓿GPX含量Fig.8 Effect of low-temperature stress on GPX in Alfalfa
2.9 紫花苜蓿生理指标响应低温胁迫的阈值
低温胁迫对紫花苜蓿的渗透调节物质含量影响较大。综合分析可知,随温度的不断降低,紫花苜蓿的FP、MDA含量在4℃处理下含量增加幅度高于其他温度处理,故4℃为FP、MDA耐受低温胁迫的上限值;SS、SP含量在0℃处理下增加幅度高于其他温度处理,故0℃为SS、SP耐受低温胁迫的上限值(表1)。试验中SOD活性、CAT活性及GPX活性随温度降低而降低,但低温胁迫各处理间差异不显著,表明SOD活性、APX活性及GPX活性指标不能作为紫花苜蓿耐低温的指示指标。根据各材料的叶、茎增幅平均数得出:SS、SP、FP叶比茎对低温胁迫更敏感,MDA、SOD、APX、GPX、CAT茎比叶对低温胁迫更敏感。
3 讨论
抗寒性是指植物体长期处在低温寒冷环境中通过自身的自然选择和遗传变异而产生的抗寒能力。苜蓿对低温胁迫的响应及生理生化适应性都是十分复杂的过程。主要表现在其体内一些可溶性物质的增加,保护原生质体,使其不致在遇冷时凝固。同时,总脂肪含量、磷脂不饱和脂肪酸的含量也随之增加,以保护酶的活性。此外,苜蓿体内超常积累活性氧自由基,引起膜脂过氧化导致冷伤害。植物体内SOD,CAT和POD等保护酶系统具有清除活性氧自由基的功能,以减轻活性氧对植物的伤害[11-14]。由于试验设置的温度梯度有限,所以只确定出紫花苜蓿对低温耐受的敏感指标的阈值上限。
表1 紫花苜蓿不同组织生理指标响应低温胁迫的增幅
Table 1 Increase of physiological indexes to response to low-temperature stress in different tissues of alfalfa

生理指标叶22~4℃/%4~0℃/%平均值/%茎22-4℃/%4~0℃/%平均值/%SSK1-9.0954.3731.7328.687.5218.1K2-4.35170.3587.3519.8331.1225.475K3-17.03263.72140.375102.841.4952.165CK-11.58149.180.34-0.9826.8813.93FPK194.08-44.5169.295216.2513.625K242.4354.6248.525-3.83-33.2218.525K339.5214.7527.1352.96-6.064.51CK123.03-20.4271.72519.06-64.7141.885SPK1643.05-17.66330.3552.35-4.623.485K2131.8799.6115.735-87.61270.98679.29K3208.33-37.19122.76-86.741.2443.99CK2124.1180.041102.075-36.14131.7483.94MDAK1175-11.3693.18112.5111.76112.13K26.6720.8313.7590131.58110.79K3-1011.1110.55525-2826.5CK40128.5784.2853239.3935.695SODK1-4.672.773.72-21.81-3.2612.535K2-0.910.710.81-20.41-2.7511.58K30.48-0.190.335-16.23.439.815CK-4.82-3.324.07-14.081.217.645CATK1119.55-66.1992.87-13.0473.5443.29K2-42.2615.3928.825-36.05-31.8633.955K3-43.7855.149.44-79.39203.4141.395CK-31.26-7.5619.4141.19-35.7838.485APXK139.47-18.829.135235.92-63.58149.75K2-8.9280.7544.835139.21336.92238.065K320.47-21.7921.1321.68-22.9122.295CK4.1722.8213.495-5.415.645.525GPXK1-72.27210.8141.535334.03-30.52182.275K2-43.4-15.7829.59115.38-0.257.79K3-8.11101.5154.81-50.35-39.3544.85CK-69.02100.9284.97-1.07-49.3825.225
3.1 低温胁迫对紫花苜蓿渗透调节物质的含量
植物体内与抗逆关系密切的渗透调节物质主要有游离脯氨酸、可溶性蛋白和可溶性糖[15]。在低温胁迫下,导致细胞内外平衡失调,渗透调节物质可以提高细胞液浓度,维持渗透压等,提供生命活动所需要的养分,还可以产生新的功能蛋白、酶和生长激素来抵抗逆境胁迫,相互协同调节内环境,提高植物抗寒性[16]。陶雅等[17]对3个紫花苜蓿品种游离脯氨酸含量动态变化分析表明,随着温度的降低或升高,苜蓿根部游离脯氨酸的含量上升或者下降,证明脯氨酸含量与苜蓿抗寒具有相关性。试验表明,紫花苜蓿叶中脯氨酸含量随着低温处理时间呈先升高后降低的趋势,且不同抗寒性品种间出现脯氨酸含量最大值的温度不同。此外,脯氨酸与抗寒性之间的关系与所测定器官也有关。在相同低温胁迫下,CK叶FP含量增加幅度高,证明CK对细胞膜透性调节能力较强,对渗透胁迫的抵御能力相对较强,其抗寒性相对较强。可溶性蛋白代谢是反映植物抗寒性的一个重要指标,它可以提高细胞持水力,保护原生质膜结构,提高细胞液浓度,从而降低冰点,提高植物抗寒性[16]。研究发现可溶性蛋白含量随温度降低而增加,在0℃处理下,SP含量增加幅度高于其他处理,故0℃可作为SP耐受低温胁迫的上限值。相同低温胁迫下,K2和CK叶和茎SP增加幅度高,证明这两种紫花苜蓿对细胞膜透性调节能力较强,对低温胁迫的抵御能力相对较强,其抗寒性相对较强。
简令成等[18]研究报道,可溶性糖是植物抗寒初期主要依靠的渗透调节物质,当抗寒力进一步提高时,可溶性蛋白等其他物质才起作用。同时,可溶性糖是光合作用和呼吸作用等生命活动的能源物质,它可以增加细胞的保水能力,调节细胞水势,降低细胞质冰点,提高植物抗寒能力。研究证明[19-20],植物受到低温胁迫会增加可溶性糖总量含量。试验表明,可溶性糖含量随温度降低而上升,其在0℃处理下增加幅高于22℃处理和4℃处理,且相同低温胁迫下,K2和K3叶的SS含量增加幅度高于其他材料,证明K2和K3对细胞膜透性调节能力较强,对渗透胁迫的抵御能力相对较强,其抗寒性相对较强。
3.2 低温胁迫对紫花苜蓿抗氧化酶活性的影响
植物在低温胁迫环境下,细胞膜系统受到损害,活性氧产生和清除的平衡受到破坏,自由基含量过多会影响细胞组分正常生命活动,保护酶系统积极响应清除过多的自由基;但是随着胁迫加重,超过保护酶系统清除能力,植物就会受伤害而死[21]。正常情况下,细胞内的活性氧与防御系统之间保持着平衡[22]。
超氧化物歧化酶和过氧化物酶共同作用,将有毒的自由基活性氧还原成水和氧分子,过氧化氢酶对线粒体和膜脂过氧化产生的活性氧有清除作用。这3 种保护性酶与植物抗寒性密切相关,已被研究所证明[23]。抗氧化酶是一个基本且重要的抗寒指标,梁大伟等[24]研究了自然降温对红花玉兰抗寒生理指标的影响,结果表明,随着温度的降低CAT,POD和SOD 3 种酶活性逐渐增大,以利于清除体内有害物质,减轻低温的伤害。张婷等[25]研究了低温胁迫对核桃枝条的影响,对包括SOD 和POD 及CAT在内的多个指标进行了测定,结合相对电导率的变化,得出抗氧化酶可以作为抗寒性评价关键指标的结论。研究表明,抗氧化酶(SOD、CAT、APX、GPX)活性在处理间差异不显著,说明抗氧化酶系统响应低温胁迫时,反应不敏感。
4 结论
试验研究表明,紫花苜蓿不同部位的各生理指标响应低温胁迫的能力存在差异。紫花苜蓿叶生理指标较茎反应更敏感。
根据各生理指标的变化趋势,确定出紫花苜蓿对低温耐受的敏感指标的阈值上限,分别是SS为0℃,FP 4℃,SP为0℃,MDA为4℃。SOD、CAT、APX及GPX活性对低温胁迫反应不敏感。
[1] 洪绂曾.苜蓿科学[M].北京:中国农业出版社,2009.
[2] Wilman D,Foulkes G R,Givens D I.The rate and extent of cell-wall degradation invitro for 40 silages varying in composition and digestibility[J].Animal Feed Science and Technology,1996,63:111-122.
[3] 韩瑞宏,卢欣石,余建斌,等.苜蓿抗寒性研究进展[J].中国草地,2005,27(2):60-64.
[4] 王英哲.低温胁迫下紫花苜蓿对外源SA和ABA的生理响应[D].长春:吉林农业大学,2012.
[5] 陶雅,孙启忠.不同紫花苜蓿材料可溶性糖、全氮、丙二醛含量动态变化及其与抗寒性关系研究[J].中国农业科技导报,2008,10(1):56-60.
[6] 冯昌军,罗新义,沙伟,等.低温胁迫对苜蓿材料幼苗SOD、POD活性和脯氨酸含量的影响[J].草业科学,2005,22(6):29-32
[7] 王运涛,于林清,萨仁.苜蓿抗寒性研究进展[J].草原与草坪,2012,32(3):91-96
[8] 邹琦.植物生理生化实验指导[M].北京:中国农业出版社,2000:7.
[9] 李玲.植物生理学模块实验指导[M].北京:科学出版社,2009.
[10] 贺佳圆.9个野生早熟禾种质材料抗寒性研究[D].兰州:甘肃农业大学,2012.
[11] 王微.低温胁迫下紫花苜蓿几个抗寒生理指标的变化规律[D].哈尔滨:东北师范大学,2009.
[12] 任健,毛凯.四川野生假俭草的抗寒性比较[J].草原与草坪,2002(2):44-45.
[13] 乔洁,刘元和,姚永华,等.4种豆科牧草抗寒性能比较研究[J].草原与草坪,2010,30(1):68-73.
[14] 王瑞云,任有蛇,岳文斌,等.低温胁迫对苜蓿幼苗存活及生理生化指标的影响[J].激光生物学报,2006,15(4):343-348.
[15] 王会良,何华平,龚林忠,等.植物抗寒性研究进展[J].湖北农业科学,2011,50(6):1091-1094.
[16] 李春燕,陈思思,徐雯,等.苗期低温胁迫对扬麦16 叶抗氧化酶和渗透调节物质的影响[J].作物学报,2011,37 (12):2293-2298.
[17] 陶雅,玉柱,孙启忠,等.紫花苜蓿的抗寒生理适应性研究[J].草业科学,2009,26(9):1-155.
[18] 简令成.40 年“植物抗寒机理的细胞生物学研究”的一个简单总结[J].植物学通报,1999,16(专辑1):15-29.
[19] 德英,赵来喜,穆怀彬.30 份老芒麦种质材料抗寒性研究[J].草业科学,2011,28(1):90-93.
[20] 吉春荣,邹陈,陈丛敏,等.低温胁迫下巴旦杏的形态生理变化及抗寒性研究[J].中国沙漠,2012,32(4):955-962.
[21] 逯明回,宋慧,李晓明,等.冷害过程中黄瓜叶SOD,CAT 和POD 活性变化[J].西北植物学报,2005,25(3):1570-1573.
[22] Prasad T K.Mechanisms of chilling-induced oxidative stress injury and tolerance in developing maize seedlings:changes in antioxidant system,oxidation of proteins and lipids,and protease activities[J].Plant Journal,1996,10(6):1017-1026.
[23] 何兵,陈其兵,潘远智,等.几个一品红品种低温胁迫的生理特性研究[J].四川农业大学学报,2004,22(4):332-334,360.
[24] 梁大伟,马履一,贾忠奎,等.自然降温对红花玉兰抗寒生理指标的影响[J].林业科技开发,2010,24(2):23-26.
[25] 张婷,车凤斌,潘俨,等.低温胁迫对核桃枝条几个抗寒生理指标的影响[J].新疆农业科学,2011,48(8):1428-1433.
The effective physiological response and index thresholds of Medicago sativa to low temperature
MA Zhou-wen1,BI Yi-xian2,LU Xue-si2,LIAO Bin-tai2,GUO Zhi-qiang2,SHI Shang-li1
(CollegeofGrassalandlScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
UsedMedicagosativasubsp.varia and three varieties of alfalfa (Medicagosativa) as the samples,we measured the SOD,CAT,APX and GPX activities in leaf and stem of these alfalfa under low temperature stress in order to select the available and sensitive index,and physiological threshold of SS,FP,SP,and MDA against the stress.The results showed that the upper temperature threshold of SS,FP,SP,MDA was 0℃,4℃,0℃ and 4℃,respectively.There was no significant difference in SOD,CAT,APX and GPX activities between 0℃and 4℃,indicating that those physiological indexes were not sensitive to low temperature stress.
Medicagosativa;hardiness;threshold value
2015-06-23;
2016-07-06
农业部“牧草种质资源保护(NB2130135)”项目资助
马周文(1991-),男,甘肃定西人,在读本科。 E-mail:2534988508@qq.com 师尚礼为通讯作者。
S 541
A
1009-5500(2016)06-0060-08

