孤立性纤维瘤的影像诊断分析
中南大学湘雅医学院附属肿瘤医院放射科 (湖南 长沙 410205)
彭 实
孤立性纤维瘤的影像诊断分析
中南大学湘雅医学院附属肿瘤医院放射科 (湖南 长沙 410205)
彭 实
目的总结不同部位起源的孤立性纤维瘤的影像特点,提高对该疾病的影像学认识。方法回顾性分析18例(17例CT平扫加增强、1例MRI平扫加增强)全身不同部位起源并经手术病理及免疫组化证实为孤立性纤维瘤患者的资料,分析上述CT 及MRI图像及肿块的影像表现。结果18例患者中,5例起源于胸膜,2例起源于腹膜后,其余起源于脑实质、腮腺、咽旁间隙、颈肩部肌间隙、肺、肝、前纵膈、空肠、肾、盆腔、子宫圆韧带均1例;肿块均单发,呈边界清分叶状的实性肿块,且不均匀强化,最大径线为13cm,除1例恶变伴双肺多发转移外,其余均为良性。结论孤立性纤维瘤可发生于胸膜及其以外的多个部位或器官,巨大边界清楚呈分叶状的不均匀密度/信号肿块,且明显不均匀强化时,应注意孤立性纤维瘤的可能。
孤立性纤维瘤;体层摄影术;X线计算机;磁共振成像
孤立性纤维瘤(solitary fibrous tumor, SFT)是一种成纤维细胞起源的间叶源性肿瘤,最初于1931年首次报道发生于胸膜[1]。文献已报道其可发生在全身其他部位,但均为个案报道,其影像学表现缺乏特异性,因此术前影像学误诊率较高,本文回顾分析18例全身多个不同部位起源的孤立性纤维瘤的临床及影像资料,旨在提高对该疾病的影像学认识,以减少术前的误诊率。
1 材料与方法
1.1 临床资料收集我院行CT或MRI检查并经手术经病理证实为SFT的患者18例,主诉包括头痛、胸痛或腹痛等。年龄10~64岁,平均42.6岁,男6例,女12例。其中17例行CT检查,1例行MRI检查,所有患者均行肿瘤根治性切除术。
1.2 影像检查MRI扫描:采用GE 360 1.5T MR扫描仪,采用体部相控阵表面线圈。扫描序列包括平扫横断位SE T1WI及横断位压脂T2WI序列、冠状位T2 flair序列。T1WI序列:TR 550~600ms,TE 21~24ms;T2WI序列:TR 3500~3900ms,TE 83~85ms。FOV 280mm×280mm,矩阵512×512,扫描13~20层,层厚3.0mm,层间隔0.3mm,采集2次。增强扫描对比剂为Gd-DTPA,经肘前静脉以1mL/s流率注射,剂量为0.1mmoL/kg,采用SE T1WI序列行横断位及冠状位3DVibe动态增强扫描。
CT扫描:采用Philip Brilliance 16、Siemens Emotion 6及Siemens SOMATOM Definition AS 64排螺旋CT机容积扫描。管电压120kV,管电流200mAs,层厚5mm,层间距5mm,螺距1。行平扫、增强扫描动脉期、静脉期扫描,其中增强扫描对比剂采用碘普罗胺(300mg I/mL),以2mL/s流率注射80~100mL。采用MPR行图像后处理。
1.3 图像分析由两位经验丰富的影像诊断医师(15年及10 年)阅片分析。阅片内容包括评估肿块的位置、大小、形状、密度/信号、强化以及最终诊断。意见不一致时共同商量取得一致意见。
1.4 病理由同一位病理科医师负责将手术标本固定、包埋、制片,苏木精-伊红染色(HE),所有标本均行免疫组织化学测试,项目包括:Vimentin、CD34、CD117、Bcl-2、CK、S-100、Actin及DES等。
2 结 果
5例位于胸腔及1位于盆腔的病变于术前影像学检查考虑可疑SFT,其余12例SFT于术前影像学检查均未做准确诊断。全部患者均于影像学检查后1-2周内行根治性肿瘤切除手术,手术大体标本经病理及免疫组化证实为孤立性纤维瘤,见表1。
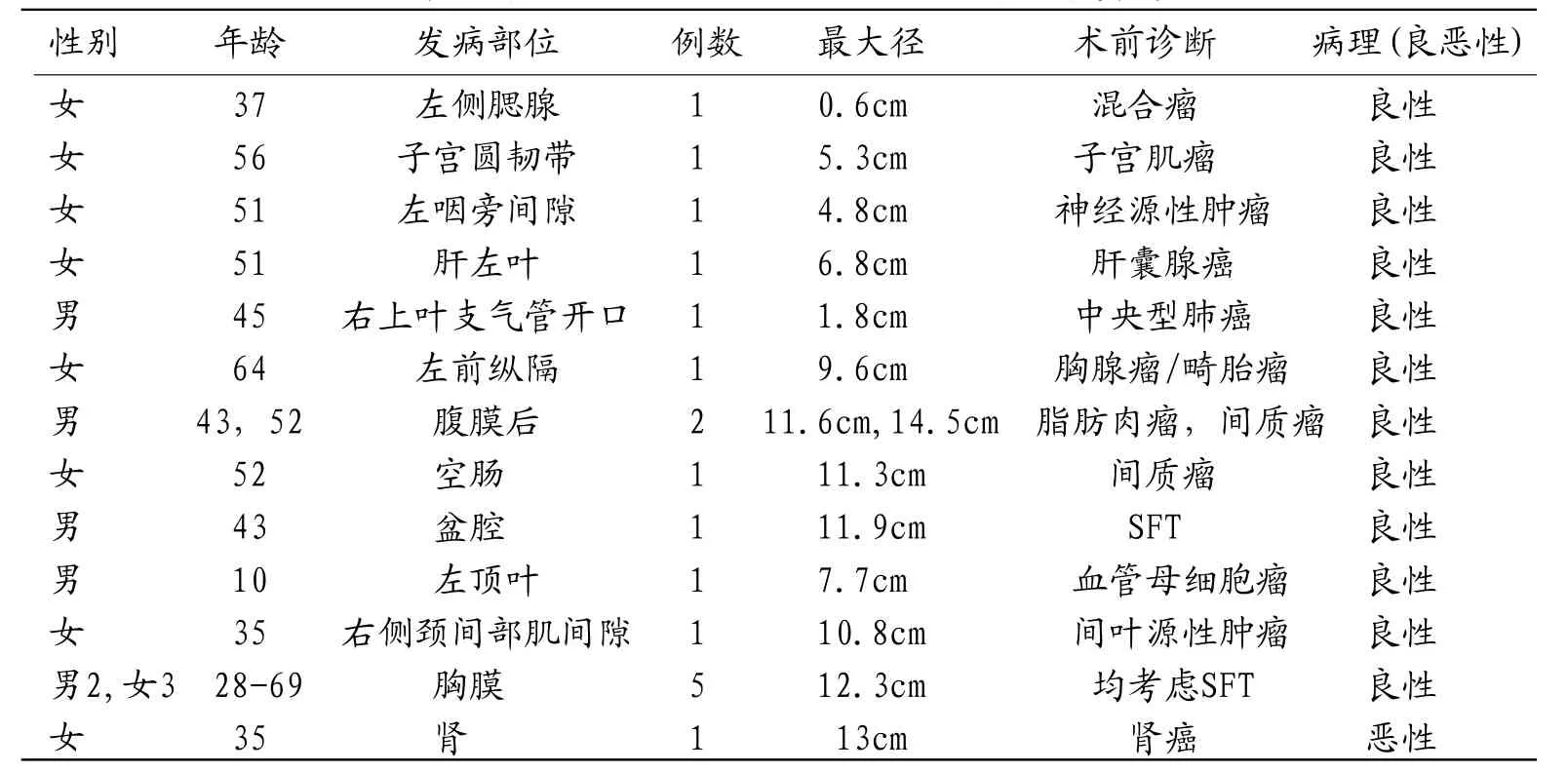
表1 本组18例病理证实为SFT的患者基本资料
3 讨 论
尽管文献报道SFT好发于胸 膜[2],但它可发生于全身各解剖部位如肝脏、肺部、胸腺、纵隔、心包、腹膜后、膀胱、前列腺以及头颈部如甲状腺、腮腺、眼球、鼻腔、口腔、副鼻窦甚至皮下组织及皮肤[3-6]。本组病例除5例起源于胸膜外,其余均为发生于胸膜外的少见部位,如表1所示。
本病的发病年龄与发病部位无明显相关性,统计显示其发病高峰年龄为20~70岁,50~60岁居多[7],而儿童及青少年较少[8],无性别倾向。在本组18例患者中,除1例为10岁,其余均为中老年患者,此与文献报道相符,但本组病例中男女比例为1:2,可能与例数较少有关。肿块一般呈无痛性缓慢生长,因此患者常无明显症状致发现时体积较大,文献报道发生在腹部及胸膜的肿块通常较四肢、躯干以及头颈部的肿块大,但预后无明显差异性[2]。肿块较大时可产生相应的压迫症状[8],另有报道偶有SFT患者可发生低血糖,是由于部分SFT会分泌类胰岛素样生长因子[9-11]所致,本组病例中则无此类表现。
肿块的影像学表现与其病理组织学成份密切相关。因SFT在组织学上常表现为CD34表达阳性的梭形细胞在胶原基质中并行或呈网格状排列,并混杂多发细小的薄壁血管[12]。因此肿块的密度或信号常与三者即梭形细胞、胶原及小血管的组成比例及分布有关。
当肿块内胶原成分较多而细胞成分较少时,肿块内含胶原成分较多的区域于MRI T2WI信号通常较低,而细胞成分多胶原成分少的区域则表现为高信号,此为一较具特征性的表现,因此有学者将此种现象较形象的以“阴阳图”描述出来,如图1所示[13]。此外,当胶原成分较多时CT增强扫描动脉期常强化不明显,但可缓慢持续性强化,而在本组病例中均未行CT延迟扫描,分析其可能为误诊率较高的原因之一。而当肿块内血管成分较多时,病变内血供常较丰富,有时还可于肿块内部观察到明显的供血血管,表现为明显不均匀强化,如图2所示,肿块明显不均匀强化,表现与血管源性肿瘤的强化程度类似,见图1-4。
尽管大多数SFT组织学为良性,但其生长行为是不可预测的。当肿块巨大(大于10cm),其内信号明显不均匀及不均匀强化时,尤其是与周边器官分界不清时,需注意肿瘤恶变的可能[14]。在本组病例中,除发生于腮腺及右上肺肿块最大径小于3cm的2例外,其余肿块最大径均超过5cm,且1例起源于右肾的巨大肿块最大径达13cm(图5-7所示),术前影像学检查考虑为肾癌伴双肺多发转移,术后病理及免疫组化考虑为恶性SFT。单纯从形态影像学上有时无法预测或鉴别SFT肿瘤的良恶性,因此需长期随访。病理免疫组化可有助于区分良恶性,有研究报道,恶性SFT中CD34表达可倾向于阴性,且其中p53及S100过表达[12,15],而良性者则通常显示CD34、Bcl-2及vimentin阳性,细胞角蛋白(CK)、S100及actin阴性。而本组1例恶性SFT免疫组化则显示:CD34、vimentin及Bcl-2均阳性,而CK,Actin及S100均阴性,此与文献报道不甚相符,见图5-7。
由于对其影像学缺乏认识,因此术前SFT与其他间叶源性肿瘤如硬纤维瘤、恶性纤维组织细胞瘤、间质瘤等鉴别较为困难,但治疗方式均以手术切除为主,不同点在于SFT常倾向与良性,通常预后较好,因此对临床有一定的提示作用。本研究的缺点之一在于病例的影像学检查未行延迟增强扫描,笔者分析其为导致误诊率较高的原因之一。因此笔者认为当遇到单发的实性分叶状肿块,边界清楚,密度及强化不均匀,怀疑SFT时,建议加做CT延迟增强扫描观察其有无出现延迟强化或加做MRI检查观察T2WI信号,可协助诊断。
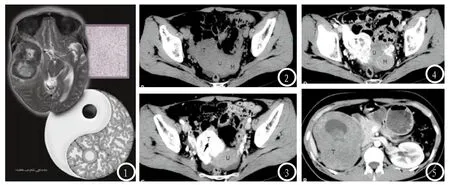
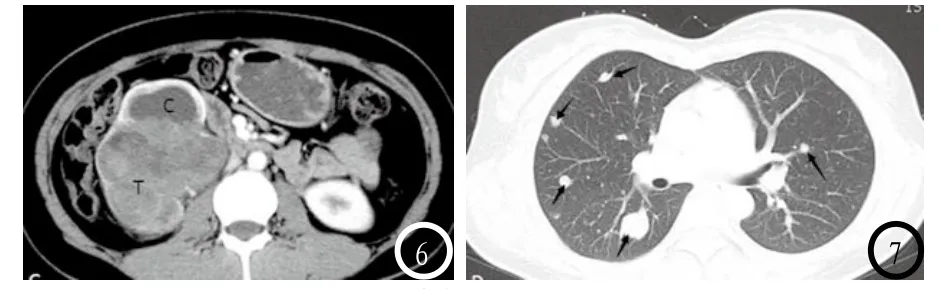
图1 SFT阴阳图:左上角为高低混杂信号的颅内脑外肿瘤,右上角为对应的镜下病理图(×40,HE染色)提示致密的梭形细胞分布于条状的胶原束周围。右下角为阴阳图,其中低信号代表了细胞稀疏区,而高信号则代表细胞密集区。图2-4 女性,56岁。下腹部坠胀痛2年余,加重9天来诊。我院盆腔CT提示子宫左后壁及右侧附件区软组织肿块,T、U、M分别代表右侧附件区肿块、子宫体及左后壁肿块。其中T明显不均匀强化,U与M强化程度相仿。M考虑为子宫肌瘤,T血供丰富,性质待定。术后病理证实T为右侧子宫圆韧带来源肿瘤,结合免疫组化结果(CD34+,vimentin+,Bcl-2+, SMA-,CK-,Actin-,CD117-,S100-,DES-,Ki-67 1%)考虑为孤立性纤维性肿瘤。图5-7 35岁女性,宫内早孕检查发现右肾巨大肿块。图5-7分别为右肾CT增强扫描肾实质期、CT平扫肺窗。右肾区巨大肿块伴明显不均匀强化(T),其中C图中C代表积液扩张的肾盏。患者行右肾根治性全切术,术后免疫组化:CD34+,CD99+,vimentin+,Bcl-2+,SMA-,CK-,Actin-,S100-,HMB45-,DES,ki67>5%,结合病理及免疫组化结果考虑右肾恶性孤立性纤维瘤。
[1] Briselli M, Mark EJ, Dickersin GR. Solitary fibrous tumors of the pleura: eight new cases and review of 360 cases in the literature[J].Cancer, 1981,47:2678-2689.
[2]兰文杰,郝崴.孤立性纤维瘤CT表现[J].中国CT和MRI杂志,2015,2(2):95-96.
[3] Goto Y, Sakurada T, Suzuki I, Nanjo H, Masuda H. A localized fibrous tumor(mesothelioma) in the mediastinum:report of a case[J].Surg Today, 1997,27:871-873.
[4]彭小芳,汪秀玲,张秀莉.孤立性纤维瘤的临床、病理及影像学表现[J].中国CT和MRI杂志,2013,11(2):60-62.
[5]曹杰,彭秀斌.左侧腰部孤立性纤维瘤伴陈旧性血肿1例[J].罕少疾病杂志,2012,19(2):58-59.
[6]Sigel JE, Goldblum JR. Solitary fibrous tumor of the skin[J]. Am J Dermatopathol,2001,23:275-278.
[7]谢再汉,黄丽嫦,舒予静,等.胸膜外孤立性纤维瘤的CT诊断[J].中国CT 和MRI杂志,2015,(1):15-17.
[8]Fletcher CD, Bridge JA, Lee JC. Extrapleural solitary fibrous tumour. In: Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F, eds[J]. WHO Classification of Tumours of Soft Tissue and Bone. 4th ed. Lyon, France: IARC; 2013:80-82.
[9]Steigen SE, Schaeffer DF, West RB, Nielsen TO. Expression of insulin-like growth factor 2 in mesenchymal neoplasms[J].Mod Pathol ,2009,22:914-921.
[10]Fukasawa Y, Takada A, Tateno M, et al. Solitary fibrous tumor of the pleura causing recurrent hypoglycemia by secretion of insulin-like growth factor II[J]. PatholInt, 1998,48:47-52.
[11]Strom EH, Skjorten F, Aarseth LB, Haug E. Solitary fibrous tumor of the pleura.An immunohistochemical, electron microscopic and tissue culture study of a tumor producing insulin-like growth factor I in a patient with hypoglycemia[J]. Pathol Res Pract,1991,187:109-113;discussion 114-116.
[12]Ide F, Obara K, Mishima K,Saito I, Kusama K.Ultrastructural spectrum of solitary fibrous tumor:a unique perivascular tumor with alternative lines of differentiation[J]. Virchows Arch,2005,446:646-652.
[13].Frazier AA. The Yin and Yang of solitary fibrous tumor[J]. Radiographics,2014, 34:294.
[14]Garcia-Bennett J, Olive CS, Rivas A, Dominguez-Oronoz R, Huguet P. Soft tissue solitary fibrous tumor. Imaging findings in a series of nine cases[J]. Skeletal Radiol, 2012,41:1427-1433.
[15]Tian TT, Wu JT, Hu XH, et al. Imaging findings of solitary fibrous tumor in the abdomen and pelvis[J].Abdom Imaging, 2014,39:1323-1329.
(本文编辑: 黎永滨)
Imaging Diagnosis and Analysis for Solitary Fibrous Tumor
PENG Shi. Department of Radiology, The Affiliated Tumor Hospital of Xiangya Medical School Central South University, Changsha 410083, Hunan Province, China
ObjectiveTo summarize and analyze the imaging findings of solitary fibrous tumor in different anatomic locations and further to improve the imaging understanding for this disease.MethodsA total of 18 cases (17 underwent enhanced and non-enhanced CT scan,1 with enhanced and non-enhanced MR scan) with solitary fibrous tumor confirmed by pathology and immunohistochemistry technique were retrospectively analyzed ,which included the clinical material and imaging findings. Those tumors were originated from different anatomic locations.Results5 out of 18 solitary tumors originated from pleura,2 from kidney, the remaining 11 were originated from brain, parotid, parapharyngeal space, intermuscular space in neck and shoulder, lung, liver, anterior mediastinum, jejunum, retroperitoneal space, pelvis, round ligament of uterus respectively, which manifest as well-defined lobular solid mass with obvious heterogeneous enhancement. In those tumors, the largest maximum diameter was 13cm.All tumor were confirmed to be benign except one was malignant combined with multiple lung metastasis.ConclusionSolitary fibrous tumor can occur in different anatomic locations besides the pleura. When a tumor presenting as large lobular well-defined solitary tumor with heterogeneous attenuation/intensity especially show obvious enhancement, solitary fibrous tumor should be considered.
Solitary Fibrous Tumor; Computed Tomography; X-Ray; Magnetic Resonance Imaging
R734;R814.42
A
10.3969/j.issn.1672-5131.2016.08.006
彭 实
2016-06-22

