靶向ELAM-1的磁共振分子探针的构建与表征*
广西医科大学附属肿瘤医院放射科(广西 南宁 530021)
刘树英 古冬连 赖少侣 黄 秒 康 巍 金观桥 苏丹柯
靶向ELAM-1的磁共振分子探针的构建与表征*
广西医科大学附属肿瘤医院放射科(广西 南宁 530021)
刘树英 古冬连 赖少侣 黄 秒 康 巍 金观桥 苏丹柯
目的探讨用超顺磁性氧化铁(USPIO)螯合唾液酸化酶X(sLeX)形成靶向内皮细胞粘附分子-1(ELAM-1)的特异性磁共振成像的分子探针的制备方法,并研究其物理化学特性。方法利用物理沉积方法合成USPIO纳米颗粒,通过疏水作用,合成较好水溶性的PEG-USPIO,其表面?COOH充分活化,常温下与sLeX充分孵育,超滤离心和去离子水洗涤,形成磁共振分子探针USPIO-PEG-sLeX,测定其表征。结果透射电镜测定PEG-SPIO平均粒径为(10±2.6)nm,分散性较好,大小适宜;动态光散射测定偶联前后其平均水动力尺寸分别为(34.06±9.95) nm,(53.35±16.99)nm;偶联前后的PEG化磁性纳米颗粒的Zeta电位分别为(11.6±3.96)mV,(-12.6±5.33)mV。结论化学交联法可成功制备磁共振分子探针USPIO-PEG-sLeX,该分子探针具有良好表征,有望满足体内、外实验特异性结合ELAM-1的要求。
磁共振分子成像;超顺磁性氧化铁;内皮细胞粘附分子-1
近年来,随着纳米颗粒制备技术的不断发展,特别是新一代超顺磁性氧化铁纳米颗粒和超小型的氧化铁颗粒(USPIO)出现,大大地促进磁共振分子影像学的发展[1-2]。然而,单一的USPIO缺乏靶向性,其成像技术并不能够为一些复杂的病情作出明确的诊断,这使得制备出靶向造影剂成为必要[3-4]。内皮细胞粘附分子-1(ELAM-1),也称E选择素(E-selectin),是选择素家族中的一员[5-6]。当内皮细胞受到IL-1,TNF-α,LPS等刺激活化后即在细胞表面表达ELAM-1。ELAM-1的配体为细胞膜上的糖蛋白或糖脂,含有唾液酸化酶X(sLeX)。ELAM-1和其配体sLeX在肿瘤发生转移发挥了重要作用,其异常表达对判断肿瘤预后以及个体化综合治疗方案的制定具有重要参考价值,可见特异性结合ELAM-1的靶向磁共振造影剂具有良好的临床应用前景。本文将油酸包裹的PEG-USPIO纳米颗粒偶联sLeX合成分子探针USPIO-PEG-sLeX,旨在制备出能够在体内外实验中能够与ELAM-1特异性地结合,并检测其表达部位及数量的磁共振分子探针。
1 材料与方法
1.1 试剂与仪器乙酰丙酮铁、油酸、油胺、EDC固体粉末、NHS固体粉末、二苄基醚、MES粉末、硼砂溶液和硼酸溶液购自上海阿拉丁试剂有限公司,乙醇、正己烷和氯仿购自国药集团化学试剂有限公司,DSPE-PEG2000固体粉末上海艾韦特医药科技有限公司,sLeX购自英国Carbosynth公司。超声仪(VCX750),离心机(Centrifuge5430R),透射电子显微镜(日本JEM-200CX),粒径分析仪(美国Brookhaven-Zetaplus)。
1.2 USPIO-PEG-sLeX的制备
1.2.1 油酸包裹的PEG-USPIO纳米颗粒的制备:先取2mmol乙酰丙酮铁、10mmol 1,2-十六醇、20ml二苄基醚、6mmol油酸和6mmol油胺进行加热反应,停止加热并冷却到室温后,向反应液中加入40ml乙醇,将混合物离心处理(6000r/min),得到黑色的沉淀物。重复乙醇沉淀/非极性溶剂分散的过程2~3次,得到平均尺寸为6nm四氧化三铁纳米颗粒。将上述方法合成的84mg四氧化三铁纳米晶体分散在 4ml正己烷溶液中,再加入2mmol乙酰丙酮铁、10mmol 1,2-十六醇、20ml二苄基醚、6mmol油酸和6mmol油胺重复进行如上反应,最终得到平均粒径为10nm的四氧化三铁纳米颗粒。称取50mg DSPE-PEG2000固体粉末溶解于5ml三氯甲烷中,移取5ml的上述油酸包覆的四氧化三铁纳米晶体(浓度为1mg Fe/ml,分散在氯仿中),将两者混合装于50ml的圆底烧瓶,在70℃(与脂质体的相变温度相当)下用超声仪充分超声10分钟后加入5ml去离子水。两者混合后将圆底烧瓶置于旋转蒸发仪上,水浴70℃,抽至真空后旋转蒸发。通过疏水作用,在颗粒表面修饰的油酸烷基链上包覆了单层具有较好水溶性的DSPE-PEG2000磷脂分子。样品经220nm滤膜过滤后再超滤离心,去除底部沉淀物,取上层黑色透明的水相纳米结构的溶液。
1.2.2 PEG-USPIO偶联sLeX分子的制备:首先,需配制反应体系中需要的缓冲溶液。称取213mg的MES粉末,溶解后用去离子水定容到50mL容量瓶中,调pH 至5.5,备用。分别移取3ml硼砂溶液(0.05mol/L)和7ml硼酸溶液(0.2mol/L),两者混合后用去离子水定容到100ml,调pH 至8.3,备用。接着,移取5ml已制备的Fe3O4-PEG样品(其中DSPE-PEG2000-COOH的原始投料量约为50mg)分散于20ml浓度为0.02mol/L的MES缓冲溶液中,依次向其中加入180mg EDC固体粉末和200mgNHS固体粉末,充分溶解后于摇床上振荡25分钟(150r/ min),以确保磁性纳米晶表面的-COOH充分活化。活化结束后,超滤离心,用去离子水洗涤3次,以去除多余的EDC和NHS。将上述样品分散于20ml 0.02mol/L 的BB缓冲溶液中,加入2mg sLeX分子(先分散于0.02mol/L的BB缓冲液中),于摇床上常温孵育2小时(150r/min)。最后超滤离心,用去离子水洗涤3次,得到黑色透明状的sLeX偶联的磁性纳米晶(UPSIO-PEG-sLeX)的溶液,经220nm滤膜过滤后保存于4℃冰箱。
1.3 USPIO-PEG-sLeX表征的测定
1.3.1 透射电子显微镜(TEM):分析USPIO-PEG-sLeX的形态和粒径:再经过进一步的处理后将用超纯水(PH6.0)稀释为1mg/ ml 的USPIO-PEG-sLeX溶液,用一次性吸液管分别取一小滴于的蜡板中,先用2%磷钨酸(PTA)对乳酸作负染处理,用移液枪吸取样品滴在铜网上,盖好培养皿,待铜网自然干燥后,用放入80kv透射电子显微镜下,观察USPIO-PEG-sLeX微粒的形态和粒径,随机选取50个纳米微粒,测量其平均粒径,重复三次,取其平均值。
1.3.2 动态光散射(DLS)分析偶联前后USPIO-PEG-sLeX的平均水动力尺寸:在室温下,偶联前后的USPIO-PEG-sLeX乳液用超纯水稀释后放入2ml Eppendorf管中,放置于超声波清洗器中,均匀振荡反应5min;开启粒径分析仪,待机器预热30min后,用移液枪吸取1.5ml的偶联前后的USPIO-PEG-sLeX溶液于透明的塑料杯中,放入Zeta粒径分析仪,采用动态光散射分别测量偶联前的PEG化磁性纳米颗粒及偶联后的sLeX偶联磁性纳米颗粒复合物的水动力尺寸,重复三次,取其平均值。
1.3.3 粒径分析仪检测偶联前后USPIO-PEG-sLeX的Zeta电位:在室温下,将USPIO-PEG-sLeX乳液用超纯水(PH6.0)稀释后,装于1.5ml的Eppendorf管中,开启Zeta粒径分析仪,待机器预热30min后进行测量,用移液枪吸取1ml的纳米微粒溶液于透明的塑料杯中,放入Zeta粒径分析仪测定偶联前、后纳米颗粒的Zeta电位,重复三次,取其平均值。
2 结 果
USPIO-PEG-sLeX溶液颜色呈淡黄色,澄清,没有明显的沉淀,分散性较好。TEM显示USPIOPEG-sLeX靶向磁性纳米颗粒呈细颗粒状外观,大小均匀,散在分布,磷钨酸染色后的PEG化磁性纳米颗粒的磁核尺寸约为(10±2.6) nm(图1)。
DLS测得偶联前的PEG化磁性纳米颗粒其平均水动力尺寸为(34.06±9.95)nm(图2),偶联后的sLeX偶联磁性纳米颗粒复合物的平均水动力尺寸为(53.35±16.99)nm(图3)。从图中可看出纳米颗粒及复合物的尺寸分布范围较窄,粒径分布较均一。
偶联前的PEG化磁性纳米颗粒的氨基末端显正电,Zeta激光粒度仪测得偶联前的PEG化磁性纳米颗粒的Zeta电位分别为(11.6±3.96)mV(图4)。偶联后的PEG化磁性纳米颗粒的sLeX通过羧基与纳米颗粒表面氨基结合,磷脂PEG的磷酸根基团显负电,测得Zeta电位(-12.6±5.33)mV(图5)。
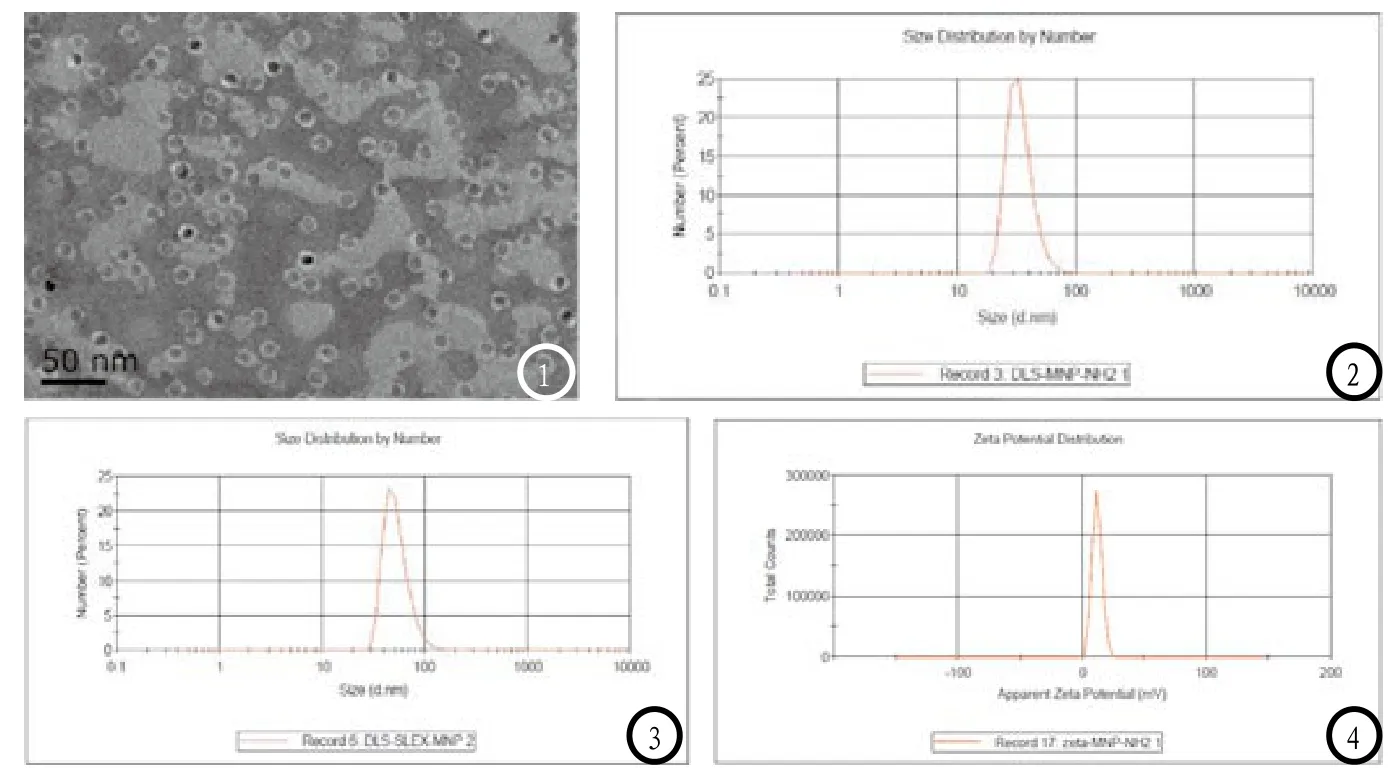
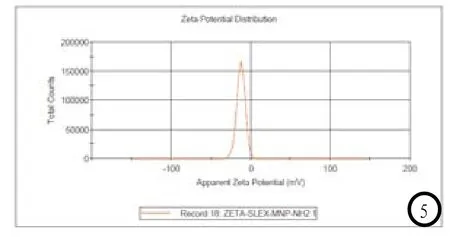
图1 USPIO-PEG-sLeXTEM电镜图(2%的磷钨酸负染)。图2-3 DLS测得偶联前(图2)后(图3)PEG化磁性纳米颗粒其平均水动力尺寸。图4-5 Zeta 电位测得偶联前(图4)后(图5)PEG化磁性纳米颗粒其电位。
3 讨 论
ELAM-1分子量为115ku,由589个氨基酸残基构成,也主要集中于毛细血管后微静脉,内皮细胞受刺激后,可维持24h然后从胞膜上脱落进入血液,成为可溶性ELAM-1[7]。ELAM-1在正常组织血管内皮细胞表面的表达,发现ELAM-1仅在甲状腺、淋巴结、扁桃体血管中表达,大多数人体组织未见表达。ELAM-1的配体为细胞膜上的糖蛋白或糖脂,含有sialyl-Lewisx及其同分异构体sialyl-Lewisa。ELAM-1及其配体参与了肿瘤细胞与血管内皮细胞的粘附,应用生物治疗方法有选择性地阻断ELAM-1等粘附分子与肿瘤细胞之间相互作用,达到阻止或预防肿瘤转移[8-9]。本文合成分子探针USPIO-PEG-sLeX,将可能成功地用于监测和评价针对肿瘤转移的靶向治疗的可能。
本实验采用PEG表面修饰的Fe3O4作为磁共振造影剂,并利用其表面羧基与具有靶向识别肿瘤表面分子表达的sLeX进行耦联,制备出具有肿瘤靶向性的磁共振分子探针。USPIO-PEG-sLeX纳米颗粒的表征结果表明,经PEG修饰的Fe3O4粒子呈球形,大小均匀,分散性较好,平均粒径10nm左右。相比于配体交换的表面修饰方法对于颗粒形貌及性质具有破坏和削弱作用[10],本文通过疏水相互作用在油相纳米颗粒表面进行PEG化修饰的方法更具优势。以两亲性DSPE-PEG2000为表面活性剂,制备得到Fe3O4-PEG纳米颗粒,透射电镜表征结果显示PEG化修饰后的纳米颗粒保持了原有的形貌和尺寸,而且PEG化后的氧化铁纳米颗粒具有较低的类酶活性,能够体内实验时有效躲避小鼠巨噬细胞的吞噬。同时,PEG包裹在Fe3O4的表面产生配位作用,它可降低磁性纳米粒子的表面自由能和疏水作用力,且形成一定的空间位阻,从而减少了Fe3O4纳米粒子的团聚,实现体内长循环的优势。
聚合物的水动力学尺寸指的是聚合物水溶液中包裹着聚合物分子的水化分子层的尺寸,聚合物浓度增加到一定程度,聚合物链将发生明显的缠结作用,导致聚合物的分子尺寸会增大[11-12]。本文结果显示,DLS测得偶联前后PEG化磁性纳米颗粒其平均水动力尺寸为(34.06±9.95) nm和(53.35±16.99)nm,而且纳米颗粒及复合物的尺寸分布范围较窄,粒径分布较均一。USPIOPEG-sLeX乳液中纳米粒子以一定尺寸分布的聚集体的形式存在其中,磁性纳米粒子的聚集和表面生物分子吸附主要通过对水动力尺寸的改变来影响其特征频率,磁偶极相互作用和范德瓦尔兹力导致USPIO-PEG-sLeX聚集的原因。本文通过PEG表面修饰,在表面引入更多的电荷和有机分子阻挡层可以改善这种聚集。同时,USPIO-PEG-sLeX窄的粒子尺寸分布能够降低磁化率谱的宽度,从而可进一步增加磁共振分子成像检测其灵敏度,因此,USPIO-PEG-sLeX属于磁敏感探针。
Zeta电位的重要意义反映了偶联前后USPIO-PEG-sLeX的稳定性。Zeta电位是对颗粒之间相互排斥或吸引力的强度的度量,分子或分散粒子越小,Zeta电位(正或负)越高,体系越稳定,即溶解或分散可以抵抗聚集。反之,Zeta电位(正或负)越低,越倾向于凝结或凝聚,即吸引力超过了排斥力,分散被破坏而发生凝结或凝聚[13-14]。本文结果显示,电位偶联前后的PEG化磁性纳米颗粒的Zeta电位分别为(11.6±3.96) mV,(-12.6±5.33)mV,提示了USPIO-PEG-sLeX的稳定性一般。
总之,油酸包裹的PEG-Fe3O4纳米颗粒与ELAM-1的特异性配体sLeX偶联形成复合物(USPIO-PEG-sLeX),该分子探针具有良好表征,有望满足体内、外实验特异性结合ELAM-1的要求,对监测ELAM-1在肿瘤的表达以及预测肿瘤发生转移的风险等方面应用具有广阔应用前景。
[1]金征宇,薛华丹.医学分子影像学的现状与展望[J].中国医学科学院学报,2009,31(2):121-123.
[2]Sheng Y, Liao LD, Thakor NV, et al. Nanoparticles for molecular imaging[J].J Biomed Nanotechnol 2014,10(10):2641-2676.
[3]陈峰,王文献,廖建伟等.125I粒子CT靶向治疗实体肿瘤[J].中国CT和MRI杂志,2013,11(5):104-106.
[4]张艳林,杨梅,陈麦林等.CT动态增强扫描定量参数与非小细胞肺癌患者靶向治疗效果的相关性研究[J].中国CT和MRI杂志,2013,11(6):48-51.
[5]金观桥,张涛,刘树英,等.ELAM-1在鼻咽癌组织中表达及其与临床特征关系的研究[J].广西医科大学学报,2015,32(03):372-375.
[6]Jubeli E, Moine L, Vergnaud-Gauduchon J, et al. E-selectin as a target for drug delivery and molecular imaging[J]. J Control Release 2012, 158(2):194-206.
[7]周萍,成玉霞,张贵慧,等.E-选择素及其配体SLeX介导大肠癌早期黏附的观察[J].中华肿瘤防治杂志,2010,17(16):1273-1276,1279.
[8]Yasmin-Karim S, King MR, Messing EM, et al. E-selectin ligand-1 controls circulating prostate cancer cell rolling/adhesion and metastasis[J].Oncotarget 2014, 5(23):12097-12110
[9]张涛,廖芝玲,金观桥,等.鼻咽癌患者 E-选择素的表达变化及意义[J].山东医药,2015,(09):18-20
[10]Leung K.Sialy Lewisx mimetic conjugated to pegylated ultrasmall superparamagnetic iron oxide nanoparticles[J]. Molecular Imaging and Contrast Agent Database. 2009,(5)2004-2013
[11]庄克虎,王春雨,张宇,等.聚集和表面分子吸附对磁性纳米粒子交流磁化率的影响[J].东南大学学报(医学版),2010,29(3):248-253.
[12]Mbeh DA, Javanbakht T, Tabet L, et al. Protein Corona Formation on Magnetite Nanoparticles: Effects of Culture Medium Composition, and Its Consequences on Superparamagnetic Nanoparticle Cytotoxicity[J].J Biomed Nanotechnol 2015,11(5):828-840.
[13]Shahnaz G, Kremser C, Reinisch A, et al. Efficient MRI labeling of endothelial progenitor cells: design of thiolated surface stabilized superparamagnetic iron oxide nanoparticles[J]. Eur J Pharm Biopharm 2013, 85(3 Pt A):346-355.
[14]Cuny L, Herrling MP, Guthausen G, et al. Magnetic resonance imaging reveals detailed spatial and temporal distribution of iron-based nanoparticles transported through water-saturated porous media[J].J Contam Hydrol 2015, 182:51-62.
(本文编辑: 张嘉瑜)
Construction and Characterization of MR Molecular Probe Targeted Endothelial Cell Adhesion Molecule-1*
LIU Shu-ying, GU Dong-lian, LAI Shao-lv,et al., Department of Radiology,Affiliated Tumor Hospital of Guangxi Medical University,Nanning 530021,Guangxi Province,China
ObjectiveTo investigate the methods of preparing a specific molecular probe for magnetic resonance imaging targeting endothelial cell adhesion molecule-1 (ELAM-1) with ultrasmall superparamagnetic particles of iron oxide(USPIO) chelating sialyl-Lewis X (sLeX), and research its physicochemical properties.MethodsUsing physical deposition method to synthesis USPIO nanoparticles. By hydrophobic interactions, preferable water-soluble PEG-SPIO was synthesized and the surface -COOH was sufficiently activated,then incubated with sufficient sLeXat room temperature, purified by centrifugal ultrafiltration and washed with deionized water. The magnetic resonance molecular probe USPIO-PEG-sLeXwas prepared and characterize it.ResultsTEM results revealed that the PEG-SPIO had a size of (10±2.6)nm with good dispersibility and suitable size. DLS study showed that before and after coupling,the hydrodynamic mean diameter were (34.06±9.95)nm and (53.35±16.99) nm, respectively. Zeta potential study showed that before and after coupling the potential of PEG conjugated magnetic nanoparticles potential were (11.6±3.96) mV and (-12.6±5.33) mV,respectively.ConclusionThe method of chemical conjugation can be successfully prepared MRI molecular probe USPIO-PEG-sLeX, which has a well-characterized molecular probe, and it is expected to meet vivo experiments specifically binds to ELAM-1 requirements.
Magnetic Resonance Molecular Imaging; Ultrasmall Superparamagnetic Particles of Iron Oxide; Endothelial Cell Adhesion Molecule-1
R445.2
A
国家自然科学基金资助项目(NO.81260334和81460452)
10.3969/j.issn.1672-5131.2016.08.043
苏丹柯
2016-06-28

