皮下预制膀胱脱细胞基质-丝素蛋白双层支架修复大鼠膀胱的实验研究
王 琼 肖冬冬 赵阳 周 哲 周 娟 王 忠 张 明 卢慕峻
皮下预制膀胱脱细胞基质-丝素蛋白双层支架修复大鼠膀胱的实验研究
王 琼 肖冬冬 赵阳 周 哲 周 娟 王 忠 张 明 卢慕峻
目的观察膀胱脱细胞基质-丝素蛋白(Bladder acellular matrix graft-silk fibroin,BAMG-SF)双层支架经皮下预制处理后,修复大鼠膀胱扩大术后膀胱缺损的效果。方法取BAMG-SF置于大鼠皮下,分别经1 d、3 d、7 d和14 d后,行组织学染色,评价其体内情况;实验分4组:单纯BAMG-SF组,BAMG-SF皮下预制3 d组、预制7 d组、预制自体组织组(BAMG-SF皮下预制7 d后去除BAMG-SF,保留周围结缔组织),分别修复大鼠膀胱扩大术模型,术后4周行HE、Masson及相关免疫组化染色,评价其修复情况。结果皮下预制7 d,即有大量细胞长入;皮下预制14 d,材料可被自身组织包裹;皮下预制3 d组的血管及肌肉修复程度均优于其他组,自体组织组未见结石形成。结论BAMG-SF双层支架材料可用于膀胱缺损修复,皮下预制3 d组织修复效果最好,而自体组织组可以避免结石形成。
膀胱脱细胞基质丝素蛋白皮下预处理膀胱扩大术模型
由肿瘤、结核等原因引起的膀胱大面积缺损一直是临床的难题。胃肠道替代膀胱是目前最常用的方法,该方法不仅造成供区的创伤,也存在着诸多并发症。近年来,随着组织工程技术的发展,大量人工合成材料已用于修复大面积膀胱缺损[1-4]。通过物理交联方法可将来源于膀胱的膀胱黏膜下脱细胞基质(Bladder acellular matrix graft,BAMG)和来源于蚕茧缫丝丝素蛋白(Silk fibroin,SF)复合为膀胱脱细胞基质-丝素蛋白(Bladder acellular matrix graftsilk fibroin,BAMG-SF)双层支架,其中BAMG为去除细胞、抗原等成分的膀胱组织,其表面光滑,结构相对致密,有利于尿路上皮贴附,且能有效阻止尿液渗透至腹腔;而SF结构疏松,孔隙性大,且具有良好的柔韧性、缓释性等,有利于周围细胞的长入[5]。BAMG-SF作为一种新的支架,已被证明可以用于大面积膀胱缺损修复[6],但其修复过程中存在形成过多膀胱结石等问题仍无法得到解决。将生物材料腹腔内预制后可以明显增加膀胱修复过程中血管和肌肉的修复,但材料腹腔预制过程复杂,且花费时间长,是其明显的缺陷[1]。
本实验中,我们将BAMG-SF先行皮下预制,皮下预制不同时间后取出,进行组织学分析,观察材料体内预处理后的情况;对比单纯BAMG-SF支架、皮下预处理不同时间的BAMG-SF、BAMG-SF预制取出后的周围自体组织修复大面积膀胱缺损的差异,以期得到膀胱修复更有效的实验条件,以及减少结石形成的方法。
1 材料与方法
1.1 材料
BAMG取自3月龄猪膀胱,新鲜膀胱用PBS冲洗3遍,去除膀胱周围脂肪及结缔组织,机械方法去除膀胱黏膜层肌层及浆膜层,仅留下黏膜下层;PBS清洗3遍,十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)室温下震荡洗涤2 d,0.2%TritonX-100室温下震荡脱细胞处理7 d后,75%乙醇内储存备用;SF由上海交通大学材料科学与工程学院由蚕茧中提取,将蚕茧裁剪为1 cm×1 cm大小后置于90℃、0.5%碳酸钠溶液中1 h去除丝胶,60℃饱和溴化锂溶液中直至丝素完全溶解,透析袋中透析3 d后得到丝素溶液。
1.2 方法
1.2.1 BAMG-SF双层支架的制备及扫描电镜观察
将脱细胞处理后的BAMG经双蒸水冲洗10余遍后,铺在六孔板底部,将配好的丝素蛋白溶液(2% w/v)滴在BAMG上,厚度约3 mm,物理加热法交联,-20℃冻干后得到BAMG-SF双层支架。将双层支架裁剪成10 mm×10 mm大小,环氧乙烷消毒后备用。BAMG-SF喷金处理后,扫描电镜观察。
1.2.2 实验动物及分组
16只4周龄SD雄性大鼠(上海交通大学附属第九人民医院实验动物中心提供),其中4只用于皮下预制,观察不同预处理时间后BAMG-SF的包裹情况,余12只平均分为4组:单纯BAMG-SF组,皮下预制3 d组,皮下预制7 d组,皮下预置7 d后去除BAMF-SF的自体组织组。
1.2.3 皮下预处理
大鼠腹腔麻醉,俯卧位,备皮消毒后,背部1 cm长切口,血管钳分离皮肤与皮下组织,将消毒好的BAMF-SF的SF面朝上置于大鼠皮下,5-0聚丙烯线缝合切口。皮下预制1 d、3 d、7 d及14 d后,取出BAMG-SF及周围组织行组织学检察。
1.2.4 材料的选择与预处理
单纯BAMG-SF组:环氧乙烷消毒后备用即可;皮下预制3 d组:BAMG-SF皮下预制3 d后,麻醉大鼠,切开背部皮肤,完整游离并取出BAMG-SF及其周围组织,剪刀去除SF面多余的脂肪及结缔组织,保留最近SF面的一层光滑的胶原纤维,4℃生理盐水充分清洗后备用,常规5-0聚丙烯线缝合皮肤及皮下组织;皮下预制7 d组:按照上述方法皮下预制BAMG-SF 7 d;预制自体组织组:按照上述方法得到皮下预制7 d的被胶原纤维完全包裹的BAMG-SF后,轻轻切开,暴露出组织内的BAMGSF,去除BAMG-SF及SF面胶原纤维,仅保留BAMG面单层胶原纤维,充分清洗后备用。
1.2.5 鼠膀胱扩大术模型
麻醉大鼠,仰卧位,备皮消毒,切开下腹部皮肤,切口约1 cm,钝性分离皮下组织及腹直肌,暴露膀胱,沿膀胱体部切去约40%~60%膀胱,正方形BAMG-SF以BAMG面朝膀胱内腔(皮下3 d及7 d组亦BAMG面朝内,自体组织组以胶原纤维较光滑面朝内),5-0聚丙烯线将正方形材料四角与膀胱四角缝合固定以标记修复区域,8-0可吸收线连续缝合材料与膀胱间缺口,由尿道向膀胱内注射生理盐水,明确无渗漏现象后关闭腹腔,常规缝合。
1.2.6 组织学及免疫学观察
将皮下预制1 d、3 d、7 d及14 d的BAMG-SF及其周围组织取出后,多聚甲醛固定过夜,浸蜡,包埋后石蜡切片,HE及Masson染色评价材料细胞长入及包裹情况。将4组修复后膀胱于4周后取出,HE及Masson染色评价大体修复情况,CD34、α-SMA及SM22免疫组化染色评价血管修复及肌肉修复情况,每只膀胱切片选取6个视野,Image-Pro Plus6.0对每张照片进行分析,每张照片阳性面积占总面积的比例即为阳性面积百分比,计算平均值,组内及组间统计学差异分析。
1.2.7 结石成分分析
将修复4周后形成的膀胱结石送至上海交通大学医学院附属仁济医院,应用LIIR型红外光谱自动分析系统,依据谱图中的峰位、峰强和峰形对结石进行成分鉴定。用蒸馏水将结石标本冲洗干净,室温干燥后称取重量,然后将结石粉碎成粒径适宜的粉末,取适量粉末与光谱纯KBR粉末按照1∶50的比例混合后研磨成粉状,红外光谱压片法将粉末压成1 mm的透明薄片,以分析仪进行扫描分析。
1.2.8 统计学分析
SPSS l7.0软件行统计学分析。数据以(x±s)表示。实验组与对照组血管和肌肉修复的比较,采用t检验及方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 BAMG-SF大体观及电镜下观
制备的BAMG-SF双层支架外观呈白色,SF面为疏松样多孔隙结构,BAMG面为致密样层状结构。扫描电镜观察示SF孔径为150 μm左右(图1)。

图1 BAMG-SF支架材料大体观及扫描电镜观察Fig.1Gross and SEM observation of BAMG-SF
2.2 皮下预制后组织学观察
BAMG-SF皮下预制1 d时仅SF面有部分细胞长入,支架内部未见明显细胞长入,BAMG面光滑(图2A、E);皮下预制3 d时不仅有大量细胞长入SF层,而且有一层蓝色胶原纤维包裹SF面,支架内部有细胞长入,但量较少,BAMG面光滑(图2B、F);皮下预制7 d时大量细胞长入SF面及支架内部,SF面及BAMG面均被一层蓝色胶原纤维包裹,且材料较前有所收缩(图2C、G);皮下预制14 d时大量细胞长入支架内部,SF面及BAMG面被自身组织包裹,此组织既有蓝色胶原纤维成分,又有红色其他组织成分,此时材料较前明显出现收缩(图2D、H)。
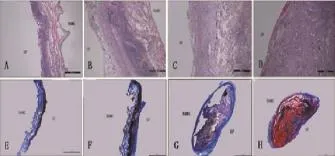
图2 皮下预制不同时间后组织学观察Fig.2Histological observation of different time pretreated BAMG-SF
2.3 膀胱扩大术及术后大体观
各组修复4周后取材,除自体组织组外,其他组均有不同程度的结石形成,尤以7 d组为著(图3)。

图3 自体组织组膀胱扩大术及术后大体观Fig.3Bladder augmentation model of autologous group and gross observation 4 weeks after surgery
2.4 结石成分分析
通过红外线光谱分析,3组结石成分均为六水磷酸铵镁,属于感染性结石,说明结石的形成与炎症反应有密切联系(图4)。
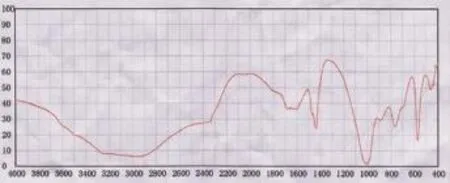
图4 红外光谱结石成分分析Fig.4Component analysis of calculus using infra-red spectrum
2.5 组织学及免疫学观察
各组修复4周后,尿路上皮均有不同程度的修复。Masson染色发现,皮下7 d组修复区域仅蓝色胶原纤维修复,而其他组尤其是修复边缘区域还有一定程度的红色肌肉样组织成分再生(图5)。
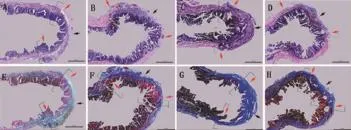
A-D:HE染色;E-H:Masson染色;A、E:单纯BAMG-SF组;B、F:皮下预制3 d组;C、G:皮下预制7 d组;D、H:自体组织组(AH标尺:2 mm;红箭头:修复边缘区域;黑箭头:修复中心区域)A-D:HE staining;E-H:Masson staining;A,E:simple BAMG-SF group(control group);B,F:3 days group;C,G:7 days group;D, H:autologous group(bar of A-H:2 mm;red arrow:marginal area of reconstruction;black arrow:centre area of reconstruction)

图6 血管及平滑肌再生的免疫组化评价Fig.6Immunohistochemical evaluations of blood vessel and smooth muscle regeneration
CD34免疫组化发现3 d组的血管修复明显优于其他各组(P<0.01),而其他各组间无统计学差异(P>0.05)。SM22免疫组化(肌样细胞)和α-SMA免疫组化(肌样细胞及肌成纤维细胞)发现,在修复中心区域,各组间SM22的表达无明显差异(P>0.05),而α-SMA的表达单纯支架组与皮下7 d组明显高于另两组(P<0.01);单纯支架组和皮下7 d组,与皮下3 d组和自体组织组之间无显著差异(P>0.05);在修复边缘区域,各组间α-SMA的表达没有统计学差异(P>0.05),而SM22的表达皮下3 d组明显高于其他3组(P<0.01),自体组织组与单纯支架组之间无明显差异(P>0.05),但高于皮下7 d组(P<0.01)。同组之间不同区域阳性表达比较发现,仅皮下3 d组和皮下7 d组的边缘区域与中心区域SM22表达有明显差异(P<0.01);各组同组之间不同区域内的α-SMA的表达均没有统计学差异(P>0.05)(图6)。
3 讨论
在组织工程研究中,膀胱修复一直以来是一大难题。多种人工材料及生物材料包括壳聚糖、膀胱黏膜下基质,小肠黏膜下基质等的应用改善了膀胱修复的效果[7-9]。如何在最短的时间内达到最好的修复效果,以及如何减少因机体对材料的排异而引起的结石形成,是组织工程膀胱修复实验中需要不断探索的问题。
BAMG-SF是一种新的复合支架,我们的前期实验已证明其具有膀胱修复的可行性[6]。该材料的BAMG面结构致密,具有很高的防水性,能够促进尿路上皮的快速长入[4],SF面为多孔隙样结构,有益于周围细胞长入,促进组织修复[8]。我们已证明BAMG体内预制7 d后其包裹物为肌成纤维细胞(Myofibrolast)[1],肌成纤维细胞是含有肌动蛋白、肌球蛋白等肌肉蛋白的成纤维样细胞,具有分泌细胞外基质及收缩的功能,参与伤口的收缩及纤维化,其α-SMA染色阳性[10-11],SM22α是一种新型的细胞分化标记物,编码一种22 KDa的收缩调节蛋白,作为一种肌动蛋白相关蛋白参与细胞骨架的形成和血管重塑[12-13],尚无证据表明其表达于肌成纤维细胞[14]。因此,本实验中,我们通过形态学观察及两种免疫染色将肌样细胞与肌成纤维细胞区分,镜下观呈层状排列的为肌成纤维细胞,而片状排列的为肌样细胞,α-SMA染色阳性的为肌层纤维细胞或较不成熟的肌样细胞,SM22α染色阳性的提示为较为成熟的肌样细胞。另外,由于肌成纤维细胞细胞的收缩性,研究发现长期膀胱修补后出现材料收缩的现象[1,6]。
本实验中,我们探究了修复相同时间下不同预制条件的膀胱修复效果,发现除自体组外,其他组均有结石形成,且为感染性结石。感染性结石形成的必要条件是解脲酶微生物对尿素的分解,此过程产生的氨和二氧化碳,升高了尿液pH值,而不断形成结石和结晶,细菌本身就成为结石的核[15]。BAMG-SF作为生物可降解材料,不可避免地会引起炎症反应,早期为嗜酸性粒细胞浸润,后期为巨噬细胞浸润,巨噬细胞不断溶解、吞噬材料而逐渐将材料降解[6],但自体组织则有效地规避了异物炎症反应。因此,我们认为结石的形成与炎症反应存在一定的关系,与文献报道相似[2,16],而BAMG-SF的存在是引起原位炎症反应的重要原因[17-18],可能由于炎症细胞浸润改变了尿液环境,促进了结石形成,但仍需进一步验证。
在组织修复方面,我们发现各组均有较为理想的尿路上皮的修复,但在血管及肌肉修复方面存在一定的差异。在血管修复方面,3 d组血管的密度及直径明显要高于其他各组,而其他各组间无明显差异,说明皮下预制3 d更有益于血管修复。在肌肉修复方面,同组之间,BAMG-SF组与自体组织组的边缘区与中心区的修复无统计学差异,可以认为其中心区和边缘区肌层修复存在同步性,而3 d组边缘区的SM22α修复要好于中心区域,说明其边缘区肌层的修复要先于中心区,而7 d组边缘区的SM22修复程度明显要低于中心区,说明其中心区肌层修复要先于边缘区,所有组内边缘区和中心区α-SMA表达均无明显差异,说明肌层纤维细胞的长入不存在差别;组间比较发现,在边缘区3 d组肌层SM22修复明显高于其他各组,以7 d组最差;α-SMA染色发现各组肌成纤维细胞长入并无统计学差异,在中心区各组间肌层SM22修复没有统计学差异,而α-SMA染色发现,BAMG-SF组与7 d组的肌成纤维细胞长入要高于另两组,3 d组与自体组之间不存在统计学差异,也就是说BAMG-SF及7 d组在远期修复过程中可能会出现较为显著的修复区域收缩现象。我们认为,3 d组的肌层修复在中心区阳性表达率上与其他组无明显差异,但从形态学上已经出现片状肌样结构,在边缘区无论在形态学上抑或阳性表达率上,其修复效果均明显优于其他组;另外,肌成纤维细胞的浸润在d天组和自体组明显少于另两组,或将有利于远期膀胱修复,减少修复区域的收缩,仍需进一步实验证明。
本实验结果表明,在修复4周时,BAMG-SF双层支架材料可用于膀胱修复,皮下预制3 d组血管及肌肉修复效果最好,且能在一定程度上减少肌成纤维细胞浸润,而预制自体组织组可能通过减少炎症反应而避免结石形成。
[1]Zhe Z,Jun D,Yang Z,et al.Bladder acellular matrix grafts seeded with adipose-derived stem cells and incubated intraperitoneally promote the regeneration of bladder smooth muscle and nerve in a rat model of bladder augmentation[J].Stem Cells Dev,2016,25 (5):405-414.
[2]Bury MI,Fuller NJ,Meisner JW,et al.The promotion of functional urinary bladder regeneration using anti-inflammatory nanofibers [J].Biomaterials,2014,35(34):9311-9321.
[3]Chung YG,Algarrahi K,Franck D,et al.The use of bi-layer silk fibroin scaffolds and small intestinal submucosa matrices to support bladder tissue regeneration in a rat model of spinal cord injury [J].Biomaterials,2014,35(26):7452-7459.
[4]Hou X,Shi C,Chen W,et al.Transplantation of human adiposederived mesenchymal stem cells on a bladder acellular matrix for bladder regeneration in a canine model[J].Biomed Mater,2016, 11(3):031001.
[5]赵阳,吴稼晟,周哲,等.人脂肪来源干细胞与膀胱脱细胞基质-丝素蛋白双层支架的生物相容性研究[J].组织工程与重建外科,2014,10(6):309-313.
[6]Zhao Y,He Y,Zhou Z,et al.Time-dependent bladder tissue regeneration using bilayer bladder acellular matrix graft-silk fibroin scaffolds in a rat bladder augmentation model[J].Acta Biomater,2015,23:91-102.
[7]Horst M,Madduri S,Milleret V,et al.A bilayered hybrid microfibrous PLGA--acellular matrix scaffold for hollow organ tissue engineering[J].Biomaterials,2013,34(5):1537-1545.
[8]Mauney JR,Cannon GM,Lovett ML,et al.Evaluation of gel spun silk-based biomaterials in a murine model of bladder augmentation [J].Biomaterials,2011,32(3):808-818.
[9]Zhu M,Wang K,Mei J,et al.Fabrication of highly interconnected porous silk fibroin scaffolds for potential use as vascular grafts [J].Acta Biomater,2014,10(5):2014-2023.
[10]Bochaton-Piallat ML,Gabbiani G,Hinz B.The myofibroblast in wound healing and fibrosis:answered and unanswered questions [J].F1000Res,2016:5.
[11]Darby IA,Zakuan N,Billet F,et al.The myofibroblast,a key cell in normal and pathological tissue repair[J].Cell Mol Life Sci, 2016,73(6):1145-1157.
[12]史建红,温进坤,韩梅.SM22α在细胞骨架组构及血管重塑中的作用[J].生理科学进展,2006,37(3):211-215.
[13]程云会,韩梅,温进坤.SM22α:血管平滑肌细胞分化的分子标志[J].细胞生物学杂志,2004,26(3):281-284.
[14]Tomasek JJ,Gabbiani G,Hinz B,et al.Myofibroblasts and mechano-regulation of connective tissue remodelling[J].Nat Rev Mol Cell Biol,2002,3(5):349-363.
[15]傅点,薛松.感染性结石的成因及治疗现状[J].东南国防医药, 2012,14(5):446-448.
[16]Zhang Y,Frimberger D,Cheng EY,et al.Challenges in a larger bladder replacement with cell-seeded and unseeded small intestinal submucosa grafts in a subtotal cystectomy model[J]. BJU Int,2006,98(5):1100-1105.
[17]Kwon TG,Yoo JJ,Atala A.Local and systemic effects of a tissue engineered neobladder in a canine cystoplasty model[J].J Urol, 2008,179(5):2035-2041.
[18]Jayo MJ,Jain D,Ludlow JW,et al.Long-term durability,tissue regeneration and neo-organ growth during skeletal maturation with a neo-bladder augmentation construct[J].Regen Med,2008, 3(5):671-682.
A Study on the Repair of Bladder by Pro-Producing Bladder Acellular Matrix Graft-Silk Fibroin in Rats
WANG Qiong1,XIAO Dongdong1,ZHAO Yang1,ZHOU Zhe1,ZHOU Juan1,WANG Zhong1,ZHANG Ming1,LU Mujun2.1 Department of Urology,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;2 Department of Urology and Andrology,Shanghai Renji Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200001,China.Corresponding author:LU Mujun(E-mail:lumujun@163.com);ZHANG Ming(E-mail:zhangm4911@163.com).
ObjectiveTo observe the role of subcutaneous pretreated bladder acellular matrix graft-silk fibroin(BAMG-SF) for bladder reconstruction in a rat bladder augmentation model.MethodsAfter BAMG-SF was implanted subcutaneously for 1 day,3 days,7 days and 14 days in 4 four-week-old female Sprague Dawley rat,the scaffold and tissues around it were harvested for histology evaluation.Set 4 groups(n=3):simple BAMG-SF(control group),BAMG-SF 3 days subcutaneous precondition(3 days group),BAMG-SF 7 days subcutaneous precondition(7 days group)and the autologous tissue around BAMG-SF 7 days subcutaneous precondition(autologous group).All groups were used to reconstruct bladder in a rat bladder augmentation model,the bladder was harvested for histology and immunology evaluation 4 weeks later.ResultsAfter BAMG-SF implanted subcutaneously for 7 days,a large number of cells were observed in BAMG-SF.After BAMG-SF implanted subcutaneously for 14 days,BAMG-SF was covered by autologous tissue.The reconstruction of vascular and muscle in 3 days group were better than other groups,only the autologous group had no stone found.ConclusionBAMGSF can be used for bladder repair,3-day group has the best effect on bladder reconstruction and autologous group can avoid stone formation effectively.
Bladder acellular matrix graft;Silk fibroin;Subcutaneous pretreatment;Bladder augmentation model
Q813.1+3
A
1673-0364(2016)06-0335-05
2016年8月30日;
2016年10月24日)
10.3969/j.issn.1673-0364.2016.06.002
国家自然科学基金项目(81370860);上海交通大学“多学科交叉项目培育(医工)”(YG2015QN02)。
200011上海市上海交通大学医学院附属第九人民医院泌尿外科(王琼,肖冬冬,赵阳,周哲,周娟,王忠,张明);200001上海市上海交通大学医学院附属仁济医院泌尿外科(卢慕峻)。
卢慕峻(E-mail:lumujun@163.com),张明(E-mail:zhangm4911@163.com)。
注:王琼,肖冬冬为共同第一作者。

