钙化与非钙化乳腺导管原位癌的影像表现及病理特点
吴 朋,郭宏兵,李 勇,许克宁
[作者单位] 075000 河北 张家口,张家口市河北北方学院附属第一医院影像科(吴朋、郭宏兵、李勇);075000 河北 张家口,解放军251医院影像科(许克宁)
钙化与非钙化乳腺导管原位癌的影像表现及病理特点
吴朋,郭宏兵,李勇,许克宁

[作者单位]075000 河北 张家口,张家口市河北北方学院附属第一医院影像科(吴朋、郭宏兵、李勇);075000 河北 张家口,解放军251医院影像科(许克宁)
[摘要]目的比较钙化与非钙化乳腺导管原位癌(ductal carcinoma in situ,DCIS)的乳腺X线摄影、超声、MRI表现及病理特点。方法收集本院2009年4月—2013年12月212例共计217处DCIS。依据乳腺X线摄影有无钙化将患者分为钙化与非钙化DCIS两组,由乳腺X线摄影、超声、MRI各两位医师共同阅片,详细记录肿瘤形态、大小、密度/回声/信号、边缘、边界、钙化形态及周围组织结构等。病理组织学结果通过本院病理科报告获得。结果乳腺X线摄影检出非钙化DCIS假阴性为49.3%,乳腺X线摄影检出钙化DCIS为100%,其中68.5%钙化灶为单纯钙化。所有非钙化DCIS在超声上呈肿块状为100%,超声显示钙化DCIS为61.6%。MRI检出非钙化与钙化分别为65.0%、51.7%,非钙化与钙化者MRI特点无统计学差异(P>0.05)。病理组织学显示高级别、坏死、孕酮受体阳性、HER-2在钙化DCIS比非钙化DCIS更为常见(分别为P=0.017、P<0.001,P=0.027,P<0.001)。乳腺X线摄影、超声、MRI表现测量钙化与非钙化DCIS直径大小与病理测定直径大小的ICC值分别为:0.625,0.705;0.801,0.552;0.760,0.767。结论钙化与非钙化DCIS在乳腺X线摄影、超声、MRI呈不同表现,乳腺X线摄影对钙化DCIS敏感性较高,超声对非钙化敏感性较高,MRI对检出钙化与非钙化DCIS均有较高敏感性。
[关键词]癌,导管,乳腺;乳腺X线摄影;超声;磁共振成像;病理组织学
乳腺导管原位癌(ductal carcinoma in situ,DCIS)为乳腺导管恶性上皮原位增生性肿瘤,未突破基底膜,无侵犯间质,是乳腺癌早期病变[1],约33%为多中心性[2],10%侵犯双侧乳腺[3]。据资料统计[4],DCIS占所有乳腺癌类型的0.8~5%,其发病率呈逐年上升及年轻化趋势,大约5%有临床症状[5]。虽然乳腺X线摄影能很好诊断钙化DCIS,但6%~23%非钙化DCIS不能被乳房X线摄影所发现[6]。超声对显示非钙化DCIS有较高敏感性,但对钙化乳腺导管原位癌显示欠佳。近年来磁共振成像能够良好显示DCIS,但对钙化灶显示不良。因此,本文比较乳腺X线摄影、超声、核磁共振对钙化与非钙化DCIS影像表现和及病理特点,提高对DCIS的术前诊断。
1材料与方法
1.1临床资料收集本院2009年4月—2013年12月之间212例经病理证实DCIS患者,其中5例为双侧DCIS。均为女性,年龄30~76岁,平均50岁。主要临床表现:可触及肿块189例、乳头溢液56例、局部疼痛16例。212例行完整乳腺X线摄影和超声检查,78例行MRI检查。
1.2方法
1.2.1乳腺X线检查:应用Senographe DS乳腺X线成像系统(美国GE Healthcare)采集乳腺图像数据,所有患者术前常规投照头尾位及侧斜位两个标准平面,对于钙化DCIS加用射点压像和放大像。根据乳腺X线摄影检查结果将其分为6类:①阴性;②单纯钙化;③肿块伴钙化;④单纯肿块;⑤局灶非对称性致密伴钙化;⑥其它(病灶结构紊乱及病灶不对称)。由两位放射专家详细记录肿块形态、大小、边缘、密度及伴随钙化灶,同时亦要评估钙化的形态及肿块实质部分密度(脂肪型、散在分布型、不均匀型、致密型)。
1.2.2超声检查:采用Philips iU22彩色超声诊断仪(荷兰飞利浦公司),探头频率5~12 MHz,50 mm线阵式换能器。依据超声乳腺成像报告及数据分析系统,详细观察肿瘤形态、大小、边缘、内部回声情况。本院乳腺超声为双侧全乳腺检查,先右侧后左侧。在仰卧位进行乳腺轴位、矢状位检查,后检查乳腺内侧,在旋后斜位,患者上肢提向头部检查乳腺外侧。测量肿瘤水平经线、垂直经线和最大厚度三径线,用钟表位记录肿瘤的位置及肿瘤到乳头的距离。为避免发生阅片偏倚,由两位超声专家在不知道乳腺X线摄影结果下进行评判。超声结果分为3类:①阴性;②肿块;③单纯钙化。详细记录肿块形态(圆形、椭圆形、不规则形)、方向(平行于皮肤;或否)、边缘(局限性或非局限性)、病变边界(回声中断或声晕)、内部回声(高、等、低回声;复合性囊肿、高等混杂回声)、后方回声(无、增强、影阴)、导管变化、钙化存在形式(无、肿块内、肿块边缘)及肿瘤大小。
1.2.3MRI检查:应用3.0T超导型磁共振扫描仪(Signa公司,EXCITE HDX型号),采用8通道双侧乳腺相阵线圈采集信号。患者俯卧位,双侧乳腺自然下垂,先平扫后行动态增强扫描。所有患者均行快速自旋回波横断面T1WI(TR 580 ms,TE 12 ms),FOV=200 mm×200 mm,层厚3.0 mm,层间距0.5 mm;快速自旋回波横断面T2WI(TR 2500 ms,TE 110 ms)、FOV=200 mm×200 mm,层厚3.0 mm,层间距0.5 mm;脂肪抑制横断面T2WI(TR 5000 ms,TE 45 ms)、FOV=200 mm×200 mm,层厚3.0 mm,层间距0.5 mm,各横轴位MR扫描定位于相同层面。DWI(spin echo-echo plane image,SE-EPI)序列参数:TR=5150 ms,TE=75 ms,b=1000 s/mm,FOV=220 mm×220mm,层厚5.0 mm,层间距1.5 mm,矩阵160×160。于肘静脉以注射速率0.2 ml/s注入10 g钆喷酸注射液,注药后进行矢状位(TR6.4 ms,TE3.0 ms、TI7.0 ms FOV=200 mm×200 mm,层厚3.0 mm,层间距0 mm,NEX 1)及轴位(TR 5.2 ms,TE 2.5 ms、TI 10.0 ms FOV=200 mm×200 mm,层厚3.0 mm,层间距0 mm,NEX 1)动态增强扫描。所有MRI图像信息均传至GE AW4.4工作站进行分析,在原始横断面图像的基础上,同时结合各种图像后期处理技术方法,包括容积重建、多平面重建、曲面重建、最大密度投影重建等。由我科室2名高年资MRI医师共同阅片评估,详细记录MRI显示肿瘤部位、形态、大小、信号、强化程度;单发或多发、周围结构受累情况及锁骨上和腋窝淋巴结转移情况。在轴位、矢状位及重建冠状位测量肿瘤三径线(水平径线、垂直径线及厚度)。测量肿瘤动态增强时间信号曲线特点,如流入型、平台型、流出型。
1.2.4组织病理学检查:病理组织学结果通过本院病理科报告获取,在大体病理记录肿瘤直径大小,经取材进行镜下观察肿瘤组织。详细记录肿瘤核分级、肿瘤坏死及免疫组化情况(雌二醇受体、孕酮受体、HER-2、HER-1、p53、CK 5/6)。根据肿瘤核异型性分为3级,其中肿瘤核分裂3级视为高级别、肿瘤核分裂1级或2级为低级别。免疫组化显示HER-2为3+视为阳性,HER-2为0或1+视为阴性,2+则需荧光原位染色进一步分析。雌二醇受体、孕酮受体免疫组化大于10%核浓染为阳性结果。
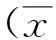
2结果
2.1一般情况212例中非钙化67例、钙化145例。其中非钙化DCIS为71处(32.7%),钙化DCIS为146处(67.3%)。非钙化DCIS组年龄(49.5±0.5)岁,钙化DCIS组年龄(51.2±0.3)岁,两者无统计学意义(P=0.069)。
2.2乳腺X线摄影结果乳腺X线摄影显示非钙化组肿瘤直径为(1.6±1.2)cm,钙化组直径为(2.8±1.4) cm,两者比较差异有统计学意义(P<0.001)。乳腺X线摄影检出DCIS敏感性为83.9%(182/217),检出非钙化DCIS为50.7%(36/71),钙化DCIS为100%(146/146);非钙化DCIS假阴性率为49.3%(35/71),肿块检出率29.6%(21/71),病灶不对称为15.5%(11/71),结构扭曲为5.6%(4/71)。在35例假阴性DCIS中20例表现致密型乳腺。所有乳腺X线摄影假阴性DCIS在超声上显示为肿块回声。在146处钙化乳腺X线摄影中,单纯钙化为68.5%(100/146),局灶非对称性致密伴钙化18.5%(27/146),肿块伴钙化为13.0%(19/146),见图1。根据观察到钙化形态,分为:良性钙化0例,不定型钙化14.3%(21/146),粗大钙化37.0%(54/146),细微多星形钙化41.1%(60/146),细微线性钙化7.5%(11/146)。根据钙化分布分为:散在分布钙化0例,局限性钙化为13.0%(19/146),簇样钙化38.4%(56/146),阶段性钙化38.4%(56/146),线样钙化10.3%(15/146)。乳腺X线摄影共发现肿块40例,其中钙化DCIS 19例,非钙化DCIS 21例。不规则形52.5%(21/40),椭圆形35.0%(14/40),分叶形12.5%(5/40),其中14例(73.7%)钙化DCIS为不规则肿块,14例(66.7%)非钙化DCIS为椭圆形或分叶形。钙化与非钙化DCIS肿块形态差别具有统计学意义(P=0.030)。21例(52.5%)DCIS肿块边缘不清:局限性形12例,光滑形4例,针状形3例,微小叶形2例。33例肿块呈等密度(82.5%),7例呈高密度(17.5%)。钙化与非钙化DCIS肿块边缘及密度差别无统计学意义(P=0.117、0.574),见表1。
图1 钙化乳腺导管原位癌X线显示局限不对称钙化1例的影像图图A、B为右乳腺头尾位及侧斜位乳腺X线摄影,显示局限性不对称钙化;C为超声显示单纯性肿块(箭头);D为MRI显示呈不均匀性肿块影,E为动脉增强呈平台型
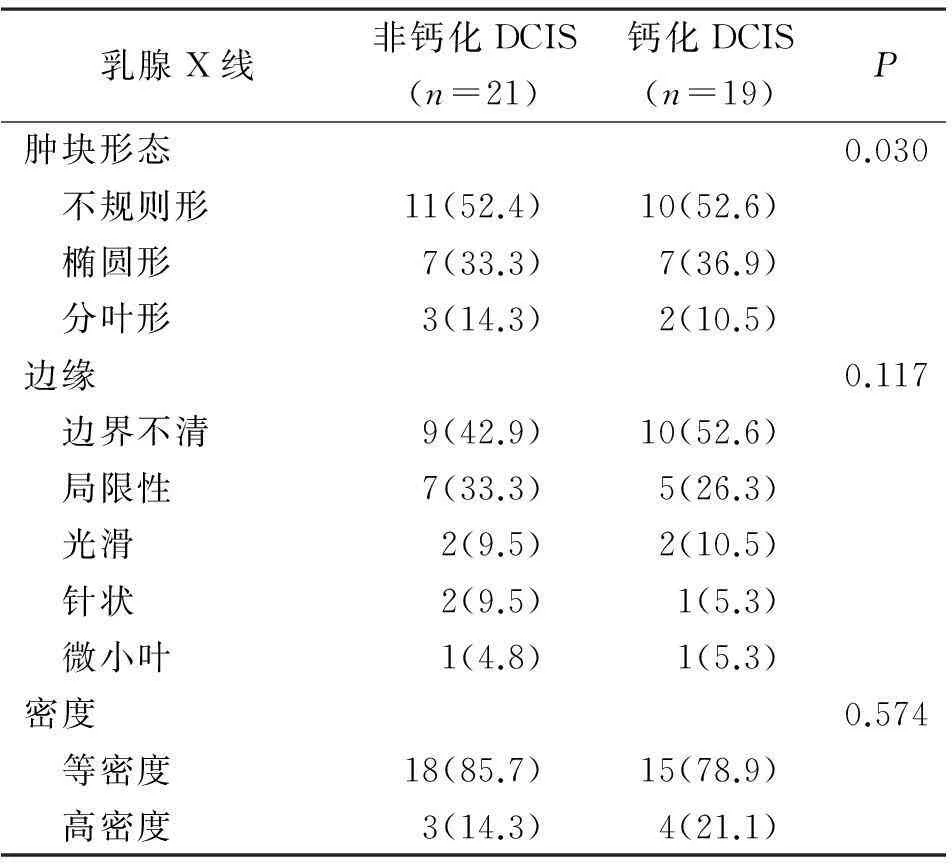
表1 非钙化与钙化DCIS肿块乳腺X线特点[例(%)]
2.3超声检查结果超声显示钙化组肿瘤直径(1.9±1.4)cm大于非钙化组直径(1.6±0.8)cm(P<0.035)。所有非钙化乳腺导管原位癌在超声上均为肿块形,见图2,显示钙化DCIS为61.6%(90/146),37例呈单纯性钙化,19例为假阴性表现。超声在检出钙化与非钙化DCIS差异时,有统计学意义(P<0.001)。超声显示19例为假阴性结果,而在乳腺X线摄影为16例单纯性钙化和3例局灶非对称性致密伴钙化,见表2。

图2 非钙化乳腺导管原位癌超声显示肿块形1例的影像图A为双侧乳腺增生,未见肿块影;B为超声显示左乳腺圆形均匀等回声肿块,肿瘤周围可见血流信号;C为MRI为显示呈均匀高信号肿块影,D为动态增强曲线为流入型
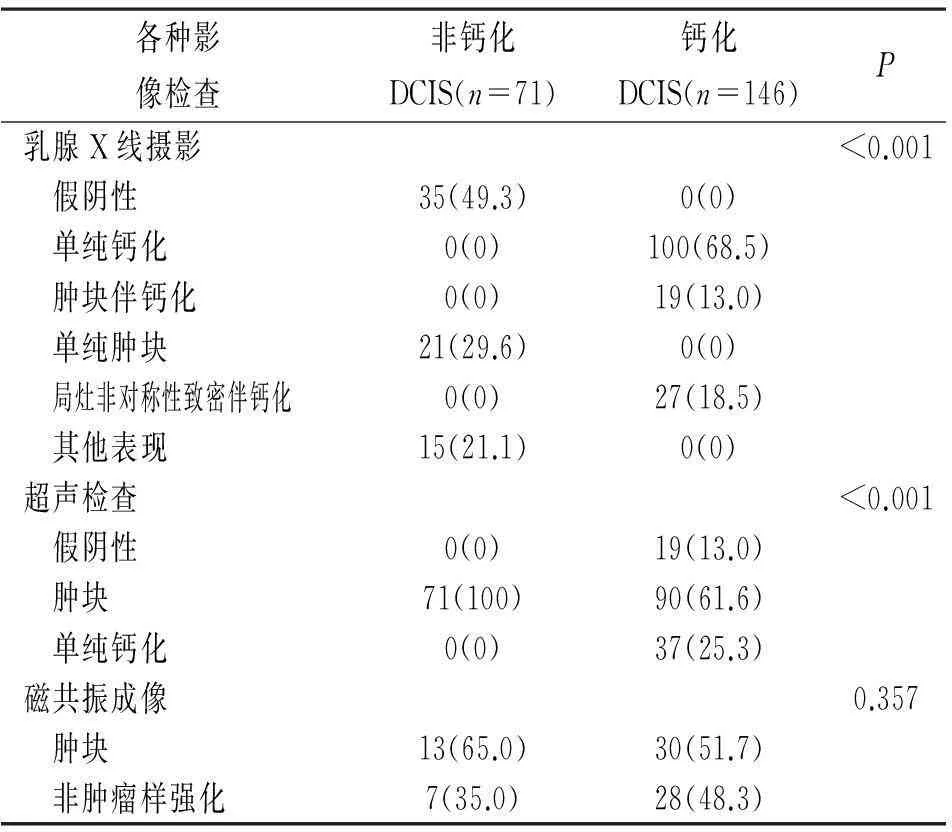
表2 乳腺X线摄影、超声检查、磁共振成像对非钙化与钙化DCIS影像表现[例(%)]
161例超声显示为肿块型,其中钙化DCIS 90例,57例(63.3%)呈高等混杂回声;非钙化71例,28例(39.4%)呈均匀高回声或等回声。钙化与非钙化DCIS回声差别时,有统计学意义(P<0.001)。87例钙化DCIS平行于皮肤,71例非钙化DCIS不平行与皮肤,两组存在统计学差异(P=0.002),而两组在形态、边缘、边界、后方回声及周围结构变化无统计学差异(分别为:P=0.669,P=0.476,P=0.050,P=0.127,P=0.171),见表3。
表3 非钙化与钙化DCIS 161例肿块超声影像特点[例(%)]

2.4MRI检查结果78例患者进行MRI检查,其中钙化DCIS 58例,非钙化DCIS 20例。见图3。MRI测量非钙化DCIS直径为(2.3±0.8)cm,钙化DCIS为(2.8±0.2)cm,两组无统计学差异(P=0.332)。MRI显示肿块样DCIS为43例(43/78,55.1%),其中非钙化DCIS 13例(65.0%),钙化DCIS 30例(51.7%);非肿块样强化33例(42.3%),其中6例(30.0%)非钙化DCIS,27例(46.6%)钙化;DCIS假阴性2例(2/78,2.6%)。MRI在观察肿块样钙化与非钙化DCIS间无统计学差异(P=0.357)。在观察钙化与非钙化DCIS形态、边缘、增强方式无统计学差异(分别为:P=0.757、0.820、=0.427)。见表4。MRI在观察肿瘤分布及非肿瘤样增强方式无统计学差异(P=0.106、0.117),见表5。
表4 非钙化与钙化DCIS肿块MRI影像特点[例(%)]

表5 非钙化与钙化DCIS非肿块MRI影像特点[例(%)]

图3 非钙化性乳腺导管原位癌MRI显示肿块1例的影像图A、B为右乳腺头尾位及侧位乳腺X线摄影,显示非钙化性肿块;C为超声显示单纯性肿块;D为MRI显示呈不均匀性肿块影,动脉增强呈流出型。
2.5组织病理学结果病理结果显示核分级、坏死、PR阳性、HER-2在钙化与非钙化DCIS有显著统计学差异(分别为P=0.017、P<0.001、P=0.027、P<0.001)。而ER、变异HER-1、变异p53抑制基因、CK5/6表达在钙化与非该DCIS无统计学差异(分别为:P=0.515、0.986、0.565、0.265),见图4、表6。钙化DCIS直径(1.9±0.3)cm,大于非钙化(1.4±0.4)cm(P=0.004),超声显示DCIS直径为(1.8±0.6)cm。超声测量肿瘤大小值与病理测定肿瘤大小值间ICC值为0.686。在非钙化DCIS乳腺X线摄影、超声、MRI与测量肿瘤大小值与病理测定肿瘤值大小间ICC值分别为:0.625、0.801、0.760;在钙化DCIS的乳腺X线摄影、超声、MRI与测量肿瘤大小值与病理测定肿瘤大小值间ICC值分别为:0.705、0.552、0.767。
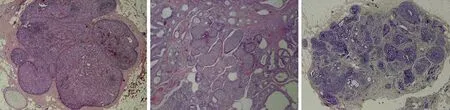
图4 同一患者非钙化性乳腺导管原位癌病理图A.显示主要乳突状导管原位癌导致的小叶扩张(HE×100);B.显示乳腺导管原位癌导致小叶结构扭曲、扩张(HE×100);C.表现为正常小叶组织被癌组织代替(HE×400)

表6 非钙化与钙化DCIS肿块组织病理学特点[例(%)]
3讨论
DCIS是一种恶性乳腺癌,其特点为恶性导管上皮细胞增殖,尚未侵入基底膜[7]。DCIS发病率明显上升,现在乳腺X线摄影对DCIS检查率不断提高[8]。1981—2001年女性发病率为2.4~27.7/10万[9],乳腺X线摄影已是检查DCIS重要手段,但对于致密型乳腺尚有一定局限性[10]。乳腺X线摄影能够发现大部分DCIS中微小钙化灶,但对于没有坏死低级别DCIS较难发现,亦能够发现肿块或结构扭曲等[11]。本研究显示乳腺X线摄影检出无症状DCIS为84%,与相关文献报道一致[12]。
超声在检查非钙化具有较高敏感性[13]。王凡等[14]对60例DCIS进行超声检查研究显示,DCIS最常见表现为边界不清或微小分叶肿块、无后方回声,常伴随导管改变和结构扭曲,与本研究结果相近。超声显示钙化与非钙化DCIS均为实性不规则肿块,边缘呈分叶状,后方无回声特点。因此超声能够弥补乳腺X线摄影不能够发现假阴性DCIS,尤其是在致密度型乳腺中,此外超声在检查乳腺能够提高DCIS检测率。在本文中,大部分女性为致密度型乳腺,在乳腺X线摄影检查中35例假阴性结果中26例为致密度型乳腺,而在乳腺X线摄影所有表现为假阴性结果都在超声上被检出。
MRI比乳腺X线摄影和超声更能敏感和准确检查出DCIS。刘泉源等[15]研究显示MRI对DCIS的检出敏感性为92%,而乳腺X线摄影仅有56%;另一研究显示MRI对DCIS的检出敏感性为94%,乳腺X线摄影86%,同时显示MRI在评估DCIS大小值与组织病理学相关性为0.786,乳腺X线摄影0.633,这些研究结果与本文一致。MRI增强扫描主要取决于导管周围及肿块内血管供应情况,过去认为DCIS主要强化方式为非肿瘤样强化,中心强化较为明显,在本研究显示97%DCIS能被MRI检查,且DCIS呈肿块样强化。钙化与非钙化DCIS大部分动态增强曲线为流入型和流出型。MRI在显示钙化与非钙化DCIS形态特点及动态增强方式上无统计学差异。
ER,PR,HER-2是乳腺癌常见普通生物标记物,ER、PR常位于上皮细胞核内,能够预测对激素治疗的反应。HER-2是人类表皮生长因子受体家族成员之一,其作用调节细胞增长[16]。大约50%DCIS的ER、PR或两者同时表达阳性。一般ER阳性表达常见于非粉刺癌,而在DCIS中PR阳性表达与ER阳性表达及非粉刺样坏死密切相关[17]。HER-2在DCIS主要作用与高级别DCIS调节增长相关。免疫组化显示高级别(P=0.017)、坏死(P<0.001)、PR阳性表达(P=0.027)、HER-2(P<0.001)阳性表达在钙化DCIS要比非钙化DCIS更为常见,提示钙化DCIS比非钙化DCIS更具有侵袭性。然而,本文显示DCIS中仅PR阳性表达与非粉刺样坏死有关,Lari等[18]对28例DCIS进行PR检查,其平均表达率为59.6%。本研究显示PR阳性表达(34.5%)可能与钙化DCIS有关,因PR表达率较低,而Albonico等[19]报道PR表达在筛状DCIS和非粉刺样DCIS更为常见,与本文基本一致。Elledge等[20]报道突变p53在DCIS发生率15%,而在侵袭性和远处转移乳腺癌是DCIS的2~3倍。本研究结果显示突变p53在非钙化DCIS发射率为20%在钙化DCIS为16%,两者差别无统计学意义(P=0.565)。钙化DCIS虽为高级别乳腺癌,但仍为原位癌。
本研究结果显示超声在测量非钙化DCIS大小值与病理组织学肿瘤大小值具有明显相关性(ICC=0.801),而MRI测量钙化DCIS大小值与病理组织学肿瘤大小值相关性为ICC=0.767,因此结果表明超声能够预测量非钙化DCIS大小,MRI能够预测量钙化DCIS大小,同时MRI能够评估钙化与非钙化DCIS疾病严重程度。
本研究局限性表现为:①因没有术前完整影像和病理资料,所以大量患者被排除;②本实验超声仅有19例为阴性结果,导致检出敏感性较高,而相关文献报道超声敏感性较低;③MRI检测DCIS样本量较小,从而影响MRI检查敏感性;④非钙化DCIS为低级别乳腺癌,影像学能否早期发现尚有一定争论。总之,乳腺X线摄影和超声能够良好鉴别非钙化与钙化DCIS,重视非钙化DCIS影像学表现有助于提高诊断,另外超声能够预测非钙化DCIS严重程度。MRI能够预测量DCIS大小及评估钙化与非钙化DCIS严重程度[21-22]。所以三种影像具有优势互补的作用。病理学在显示高核级、坏死、孕酮受体表达阳性及HER-2表达阳性常见于钙化DCIS。
[参考文献]
[1]何翠菊,赵林,罗娅红,等.乳腺导管原位癌及微浸润的MR影像学表现[J].实用放射学杂志,2014,30(9):1473-1476.
[2]俞芳,黄声岳.超声与钼靶X线检查对早期乳腺肿瘤的诊断价值比较[J].中国基层医药,2015,8(7):1082-1083.
[3]寇东平,张晓萍.乳腺X线摄影对早期乳腺癌的诊断价值分析[J].医学影像学杂志,2015,34(4):719-720.
[4]洪常华,韩德昌,杨新宇,等.乳腺MRI与乳腺X线诊断导管原位癌的临床效果[J].中国老年学杂志,2015,6(2):376-377.
[5]唐蓉,梁祯,丁力.高频彩超与X线钼靶在早期乳腺癌筛查中的价值[J].西部医学,2015,27(4):592-594.
[6]梁海丽.彩色多普勒超声诊断乳腺癌的临床价值研究[J].中国实用医药,2014,9(3):100-101.
[7]李相生,王萍,孙鹏,等.3.0TMR多期动态增强扫描在鉴别乳腺导管原位癌与乳腺腺病中的价值[J].现代肿瘤医学,2015,23(3):395-399.
[8]张洪营,柳杰,张连连,等.乳腺疾病的影像学检查方法的临床应用研究[J].实用放射学杂志,2015(1):143-146.
[9]何永胜,刘斌,潘少辉,等.磁共振多参数成像技术对乳腺癌诊断效能评价[J].实用放射学杂志,2015(3):388-392.
[10]连臻强,张嫣,王颀,等.乳腺X线和磁共振诊断导管原位癌及其微浸润的对比研究[J].中华普通外科杂志,2014,29(5):351-354.
[11]胡少波,王海霞.乳腺肿瘤X线摄影临床价值分析[J].医学影像学杂志,2015(4):717-719.
[12]姜蕾,李继生,王征,等.青年与中老年乳腺浸润性导管癌 MRI 增强形态类型的差异及病理基础初探[J].医学影像学杂志,2015(2):254-257.
[13]李旻,符惠宏,郑辉,等.MRI与乳腺X线摄影诊断导管原位癌敏感度的对比分析[J].医学影像学杂志,2014(4):653-655.
[14]王凡,陈家祥,赵伟志.乳腺导管原位癌的MRI特征性强化与病理分级对照[J].中国CT和MRI杂志,2014,18(3):45-48.
[15]刘泉源,张升华,杜海岭.数字化X线摄影与磁共振成像在乳腺导管原位癌诊断中的对比应用[J].医学影像学杂志,2014(7):1159-1161,1164.
[16]Gianni L, Pienkowski T, Im Y H,etal. Efficacy and safety ofneoadjuvant pertuzumab and trastuzumab in women with locally advanced inflammatory or early HER2-positive breast cancer(NeoSphere):arandomised multicentre open-label phase 2 trial[J].Lancet Oncol, 2012,13(1):25-32.
[17]Gianni L, Eiermann W J, Semiglazov V,etal. Neoad juvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone in patients with HER2-positive locally advanced breast cancer(the NOAH trial):A randomised controlled superiority trial with aparallel HER2-negative cohort[J].Lancet,2010,15(6):375-377.
[18]Lari S A, Kuerer H M. Biological markers in DCIS and risk of breast recurrence: a systematic review[J].Cancer 2011,2(1):232-261.
[19]Albonico G, Querzoli P, Ferretti S,etal. Biological profile of in situ breast cancer investigated by immunohistochemical technique[J].Cancer Detect Prev, 1998,22(4):313-318.
[20]Elledge R M, Allred D C. The p53 tumor suppressor gene in breast cancer[J].Breast Cancer Res Treatment , 1994,32(1):39-47.
[21]聂德红,李洪义,李凯,等.乳腺癌的影像学检查现状与新进展[J].中国当代医药,2015,22(15):20-24.
[22]金帅,白桦,黎功,等.彩色多普勒超声预测113例乳腺癌淋巴结转移相关因素[J].武警后勤学院学报,2014,23(11):951-953.
(收稿时间:2015-09-20修回时间:2015-10-25)
·论著·
Imaging and Histopathological Characteristics of Calcified and Non-calcified Ductal Carcinoma in Situ of Mammary Glands
WU Peng1, GUO Hong-bing1, LI Yong1, XU Ke-ning2(1. Department of Imaging, the First Hospital Affiliated to Hebei North University, Zhangjiakou, Hebei 075000, China; 2. Department of Imaging, 251 Hospital of PLA, Zhangjiakou, Hebei 075000, China)
[Abstract]ObjectiveTo compare histopathological characteristics of calcified and non-calcified ductal carcinoma in situ (DCIS) of mammary glands by mammography, ultrasound and magnetic resonance imaging (MRI). MethodsThe study involved 212 DCIS patients (217 sites) admitted during April 2009 and December 2013. The patients were divided into calcified and non-calcified DCIS groups according to the calcifications by mammography. The imagings were observed by two physicians using each method to carefully record tumorous shape, size, density/echo/signal features, borderline, boundary, calcified shape, surrounding tissue formation and so on. The histopathological features of the lesions were obtained from medical records. ResultsMammography showed 49.3% of non-calcified DCIS patients with a false-negative finding, and 100% of calcified patients with DCIS, in which 68.5% of calcified lesions were calcification alone. Ultrasound showed that all non-calcified DCIS were massive with 100% incidence rate, while the incidence rate of calcified DCIS was 61.6%. The MRI showed that incidence rates of non-calcified and calcified DCIS were 65.0% and 51.7% respectively, but there were no significant differences in MRI features between the two groups (P>0.05). Histopathology showed that high nuclear grade, necrosis, positive progesterone receptor and HER-2 were more common in the calcified DCIS patients compared with those in the non-calcified DCIS patients (P=0.017, P<0.001, P=0.027, P<0.001 respective). The ICC values of the non-calcified and calcified DCIS patients between predicted tumour size and pathologic size were 0.625 and 0.705 by mammography, 0.801 and 0.552 by ultrasound, and 0.760 and 0.767 by MRI. ConclusionThe calcified and non-calcified DCIS patients have different features in mammographic, ultrasonic and MRI features. The mammography has high sensibility for calcified DCIS, while ultrasound has high sensibility for non-calcified DCIS, and MRI has high sensibility for calcified and non-calcified DCIS.
[Key words]Carcinoma, ductal, breast; Mammography; Ultrasound; Magnetic resonance imaging; Histopathology
[DOI]10.3969/j.issn.2095-140X.2015.12.012
[文献标志码][中国图书资料分类号]R730.26A
[文章编号]2095-140X(2015)12-0051-08

