Nrf2-ARE信号通路在机体氧化应激损伤防护中的研究进展
王 宁,马慧萍,漆欣筑,蒙 萍,贾正平
Nrf2-ARE信号通路在机体氧化应激损伤防护中的研究进展
王宁,马慧萍,漆欣筑,蒙萍,贾正平

[摘要]核转录因子Nrf2是细胞抗氧化应激体系中的关键转录因子,Nrf2核转位并且结合核酸序列上的抗氧化反应元件ARE是活化Nrf2-ARE信号通路的关键环节。而Nrf2-ARE信号通路的活化,能够启动下游的Ⅱ相解毒酶、抗氧化酶系等的转录,从而减轻活性氧和亲电子物质引起的细胞损伤,使细胞处于稳定状态,维持机体氧化还原动态平衡。Nrf2-ARE信号通路在细胞氧化应激损伤防护中发挥重要作用。本文就Nrf2-ARE信号通路对机体氧化应激损伤防护的研究进展进行综述。
[关键词]氧化应激;Nrf2-ARE 信号通路;氧化还原平衡;综述
氧化应激是指机体在受到有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species, ROS)和活性氮自由基(reactive nitrogen species, RNS)产生过多,超出了机体对ROS和RNS的清除能力,导致氧化还原系统失衡,从而引起细胞内脂质、蛋白质和核酸的氧化性损伤,最终引发细胞凋亡和组织器官损伤[1-2]。为维持机体的氧化还原平衡,当自由基过多时,机体会自发产生防御反应以清除ROS和RNS。近年研究发现,Nrf2-ARE信号通路是细胞抗氧化应激的关键通路,由这条信号通路调控的抗氧化酶系和Ⅱ相解毒酶能够清除ROS等有害物质,因而表现出解毒和中和作用[3]。Nrf2-ARE信号通路被激活后可诱导血红素加氧酶-1[heme oxygenase-1,HO-1]、谷胱甘肽-S-转移酶(glutathione-S-transferses,GST)、NAD(P)H醌氧化还原酶1[NAD(P)H: quinine oxidoreductase 1,NQO1]等大量保护性基因的转录,进而抵抗各种刺激对机体产生的氧化应激损伤[4]。所以Nrf2-ARE信号通路在机体抗氧化体系中发挥着重要作用。
1Nrf2-ARE信号通路的基本结构
1.1Nrf2的基本结构核因子E2相关因子2 (nuclear factor erythroid 2 p45-related factor 2, Nrf2),分子量为66 kDa,广泛存在于机体多个组织器官中,在肝脏、肾脏等代谢和解毒器官以及皮肤、肺和消化道等持续暴露于外环境中的器官中高度表达。Nrf2是CNC(cap′n′collar)转录因子家族成员中活力最强的转录调节因子。Nrf2含有7个功能结构域(Nrf2-ECH homology domains, Neh),分别被命名为Neh1-Neh7。Neh1包含一个基本的碱性亮氨酸拉链结构 (basic leucine zipper, bZIP),能够与小分子肌腱纤维瘤蛋白(muscloaponeurotic fibrosarcoma protein, Maf)形成异源二聚体,促使Nrf2识别抗氧化反应元件(antioxidant responsive element, ARE)的DNA序列并与之结合,进而启动目标基因转录。Neh2位于Nrf2的N-末端,含有DLG和ETGE两个基本序列,能与胞浆蛋白Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein-1, Keapl)的DGR区结合被锚定于细胞质中,对Nrf2的转录活性起负性调节作用[5]。Neh3位于Nrf2的C-末端,可与CHD6结合,进而激活ARE调控相关基因的转录[6]。Neh4和Neh5是两个富含酸性残基的独立转录结构域,与下游基因转录的启动相关,最近研究表明,这两个结构域与核辅因子RAC3/AIB1/SRC-3相互作用可以增加Nrf2-ARE 信号通路下游相关基因的表达[7]。Neh6主要参与Nrf2的降解,含有DSGIS和DSAPGS两个基序,这两个基序能够被β-TRCP识别,进而引发SKP1-CUL1-RBX1/ROC1泛素连接酶复合体对Nrf2的降解反应,而且这两个β-TRCP识别基序对糖原合酶-3靶向SCF/β-TRCP依赖性降解的调控具有重要的作用[8]。Neh6对Nrf2的转录起负调节作用但不依赖于Keap1[9]。Neh7是与视黄醇类X受体(retinoid X receptor alpha, RXRα,一种抑制Nrf2-ARE 信号通路的受体)相互作用的区域[10]。在生理和应激状态下,机体内Nrf2的分布是不同的。Nrf2的基本结构如图1所示。

图1 Nrf2的基本结构
1.2ARE的基本结构ARE (antioxidant responsive element)位于某些细胞保护基因的上游启动子区域,是一个特异的DNA-启动子结合序列[11]。ARE是机体抗氧化应激和解毒作用过程中重要的保护性顺式应答元件,能够诱导HO-1等抗氧化酶的表达。ARE在转录因子及信号通路方面起增强作用。ARE在生物体内广泛分布,可以缓解细胞或组织受到的各类损伤,维持机体内稳态。ARE存在于Ⅱ相解毒酶基因启动子5′端调控区,在不同细胞中并非完全保守,其核心序列(或称共有序列)为5′-(G/A)TGA(G/C)nnnGC(G/A)-3′(n为任意核苷酸),其5′端基因激活后可诱导大量保护性基因的转录。Maf与Nrf2组成的复合物能够识别并且结合到相关基因5′端调控区的ARE上,从而使Nrf2-ARE信号通路激活。
1.3Keap1的基本结构Keapl是一种分子量为69 kDa的胞浆蛋白,富含半胱氨酸残基,是E3 泛素连接酶的适配底物,与果蝇肌动蛋白结合蛋白Kelch属同系物。其高反应活性的半胱氨酸残基参与Nrf2的降解,并与Nrf2的稳定化相关。Keap1是Nrf2位于细胞质中的结合蛋白,是体内重要的Nrf2负调控因子,Keap1自身的泛素化、磷酸化以及核穿梭机制都能影响到Nrf2的活力。Keap1含有624个氨基酸残基,由5个结构域组成[12],分别为NTR、BTB、IVR、DGR和CTR区域。Keap1的基本结构如图2所示。NTR、CTR 为两个氨基酸末端,BTB、IVR、DGR为主要功能区域。BTB是一个蛋白质-蛋白质相互作用结构域,通常和其他Keap1的BTB区形成同蛋白二聚体后与Nrf2结合,并参与Nrf2的泛素化降解。IVR区是连接BTB与DGR的区域,该区富含半胱氨酸残基,对氧化应激敏感,参与亲电试剂与氧化剂的反应,是整个蛋白的功能调节区,与Nrf2的稳定性相关,在非氧化应激状态下参与对Nrf2的泛素化降解过程,其中Cys273和Cys288对Nrf2活性的抑制起关键作用,当受到外源性或内源性刺激时IVR区构象发生改变引起Nrf2与Keap1的解离。DGR区有6个Kelch重复序列,含多个蛋白结合位点,是Keap1与Nrf2的Neh2区的结合位点,对Nrf2的活性具有负调控作用。

图2 Keap1的基本结构
1.4Nrf2和Keap1的相互作用Keap1的DGR区可以识别Nrf2的ETGE和DLG两个基序。Keap1可以通过BTB区相互结合形成同源二聚体,Keap1-Keap1复合体与Nrf2以1:1的比例结合。Keap1- Keap1复合体的两个DGR区分别与Nrf2的ETGE和DLG基序结合,ETGE基序与单个Keap1以强亲和力相互结合,而DLG基序与单个Keap1的结合作用较弱[13]。基于此,科学家提出了“铰链和闩锁”的假说来解释Keap1对Nrf2的调节机制[14],如图3所示,其中,“铰链”介导的高亲和力的ETGE基序与Keap1的结合不受诱导应激的影响;而“闩锁”介导的DLG基序从Keap1上转位后将对Nrf2诱导剂做出应答反应[15]。Dinkova-Kostova等最近试图以定量荧光共振能量转移(quantitative fluorescence resonance energy transfer, FRET)技术、结合荧光寿命成像显微术(fluorescence lifetime imaging microscopy, FLIM)将细胞中EGFP-Nrf2和Keap1-mCherry分子间的相互作用具现化。FRET是描述两个光敏感性分子之间能量转移的物理机制的方法,并经常用于审视细胞中两种蛋白的近似度[16]。根据FLIM-FRET观察,他们发现Keap1-Nrf2复合体存在着两种不同的构象。①开放构象:Nrf2中只有高亲和力的ETGE能够与Keap1结合形成二聚体;②闭合构象:即Nrf2中高亲和力的ETGE和低亲和力的DLG均能与Keap1结合[17]。与“铰链和闩锁”假说相反,他们观察到Nrf2诱导剂如莱菔硫烷(sulforaphane, SNF)增加了闭合式构象在细胞中的丰度。整合这些数据,他们提出一种新的模式,即由Keap1/Nrf2的相互作用而提出“构象循环模式”或“循环顺序连接与再生模式”[14]。根据这个模型,Nrf2诱导功能通过促进闭合构象的形成,进而促进Nrf2在Keap1-Nrf2复合体中的稳定性[18]。虽然Keap1-Nrf2复合体存在于闭合构象,但Nrf2诱导剂能直接结合于Keap1使Keap1的构象改变,进而引起Nrf2的解离。而Keap1-Keap1同二聚体在细胞中不能再生,构象改变的Keap1-Keap1同二聚体不能与新合成的Nrf2结合。所以大量游离的Nrf2转位进入细胞核,与ARE相互作用,进而激活ARE下游靶基因的表达。

图3 “铰链和闩锁”假说图
2Nrf2-ARE 信号通路的活化
2.1Keap1-Nrf2的解离机制Nrf2与Keap1解离是Nrf2-ARE的激活并发挥转录活性的关键步骤,其解离主要有两种机制。
2.1.1Keap1构象改变:Nrf2的活力受Keap1调节蛋白的调控,生理状态下,Keap1通过其DGR结构域和Nrf2的Neh2结构域结合,从而将Keap1-Nrf2异二聚体限制在细胞质内。应激状态时,ROS或亲电子物质对Keap1的IVR结构域内半胱氨酸残基(Cys273,Cys288)进行修饰,在Keap1-Keap1同源二聚体分子间形成二硫键,引起IVR结构域构象改变,导致Nrf2与Keap1解偶联,泛素蛋白酶体不再降解Nrf2,使Nrf2从胞质释放出来进入核内。有研究表明,Keap1的巯基修饰导致其失去对Nrf2负性调节功能,使Nrf2的稳定性增加并稳定地通过核膜转运至核内[19]。
2.1.2Nrf2磷酸化作用:蛋白质磷酸化作用是调节细胞信号的关键因素,也是蛋白质翻译后的主要修饰机制。多种蛋白激酶包括促分裂原活化蛋白激酶(MAPK)、蛋白激酶R 样内质网激酶(PERK)、磷脂酰肌醇-3-激酶(PI3K)和蛋白激酶C (PCK)等的活化均可通过诱导Nrf2的磷酸化使Nrf2的构象改变,促使其与Keap1分离,激活Nrf2[20-22]。另外,相关研究报道,Nrf2本身也可能含有氧化应激感受器[23]。
2.2Nrf2-ARE信号通路的激活Nrf2-ARE 信号通路的核心分子包括Nrf2、ARE 和Keap1。氧化应激、亲电子试剂或磷酸化作用均可导致Nrf2与Keap1解离和释放[15,24-26],同时减弱Keap1介导的蛋白酶对Nrf2的降解作用。正常生理状态下,Keap1通过其DGR与Nrf2的Neh2区相结合,以Keap1-Nrf2复合体的形式被锚定在胞浆内肌动蛋白细胞骨架上[12],使Nrf2稳定在胞质内,Nrf2无法进入细胞核从而抑制Nrf2 的转录活性,Keap1-Nrf2复合体则成为E3泛素连接酶的适配底物,促进Nrf2的泛素化降解,使其处于低浓度的非活性状态。而氧化应激状态下,氧化剂或亲电子化合物与Keap1的半胱氨酸残基相互作用使其构象发生变化,从而Nrf2与之解偶联,E3泛素连接酶不再降解Nrf2[27],Nrf2被激活后,转位进入细胞核内,通过其高度保守的bZIP结构与小分子Maf形成异二聚体并且识别ARE,启动下游一系列保护性基因如Ⅱ相解毒酶基因的转录,增强细胞的解毒及抗氧化能力,进而发挥保护作用。Nrf2-ARE信号通路的活化过程如图4所示。
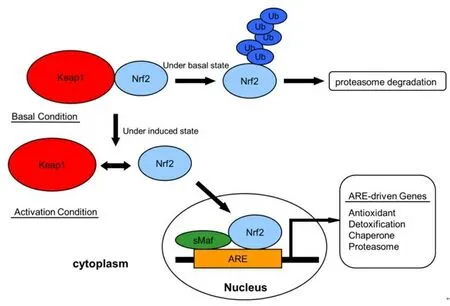
图4 Nrf2-ARE 信号通路的活化
2.3Nrf2的出核转运机制氧化还原平衡恢复后,Nrf2与ARE解离,Nrf2转回胞浆,通过Cullin3依赖的E3泛素连接酶进行泛素化后降解,促进Nrf2的消耗,关闭Nrf2通路,使Nrf2重新维持到正常生理水平[28]。研究发现Nrf2在细胞核内的过度激活和堆积同样会造成细胞的损害,因此要求Nrf2在完成基因激活后能够快速降解。关于Nrf2的出核转运机制主要有2种。
2.3.1Keap1介导的Nrf2出核转运:研究发现Keap1上存在潜在的核输出信号(NES),该结构域位于Keap1的干预区并且高度保守,是核转运蛋白(CRM1)所包绕的位置。Nrf2上存在一个核定位信号(NLS)。正常状态下,Keap1的NES作用强于Nrf2的NLS的作用,故Keap1-Nrf2复合存在于胞质中,Nrf2则由E3泛素连接酶进行泛素化后降解。而氧化应激状态下,Nrf2-ARE信号通路活化并发挥细胞保护作用后,由Keap1介导的Nrf2出核转运的机制如下所述。其一,胞质中的Keap1进入细胞核,Nrf2与ARE解离,重新与Keap1结合,CRM1识别并结合在Keap1-Nrf2复合体上的NES,然后将该复合体转运出核,胞质中Keap1-Nrf2复合体则由E3泛素连接酶识别并进行泛素化后降解[29]。其二,Keap1在胞质中与Cul 和Rbx1形成Keap1-Cul3-Rbx1复合体进入核内识别并结合Nrf2,Keap1上的NES经磷酸化修饰后被暴露,接着被CRM1识别并结合,介导Keap1-Cul3-Rbx1-Nrf2复合体转运出核[30]。如图5(A)示。

图5 Nrf2 的出核转运A.Keap1介导的Nrf2出核转运;B.NES介导的Nrf2出核转运
2.3.2NES介导的Nrf2出核转运:目前发现Nrf2上存在2个NES结构,分别为NESZIP和NESTA。NESZIP与ZIP结构域存在重叠,氧化应激状态下,Nrf2与Keap1解离,转位进入细胞核,其ZIP结构域与核内Maf结合,覆盖了NESZIP。随后Nrf2-Maf异二聚体与ARE结合,又覆盖了NESTA。这2个NES结构被覆盖使CRM1不能与Nrf2结合,导致Nrf2继续存在于细胞核中。而当Nrf2-ARE信号通路活化并完成其保护作用后,ARE与Maf解离,NESZIP和NESTA重新暴露,使CRM1识别并结合Nrf2,接着介导Nrf2转运出核[31-32],如图5(B)示。Nrf2的出核转运能够维持机体对氧化应激的持续应答,对防止耐药性的产生和肿瘤的形成具有重要意义。
2.4Nrf2-ARE信号通路调控的靶基因Nrf2-ARE信号通路在机体对抗氧化应激损伤中的作用至关重要,Nrf2-ARE信号通路激活后能够启动下游多种保护性基因的转录。到目前为止,发现Nrf2-ARE信号通路调节的可编码内源性保护基因超过200个,其激活的基因种类取决于激活剂类型和激活方式。这些保护性基因包括抗氧化蛋白类基因、Ⅱ相解毒酶类基因、抗氧化防御因子和抗炎因子类基因等,在增强组织抗氧化能力、抗炎症、抗肿瘤、抗凋亡等过程中起着重要的作用。其中,抗氧化酶类可有效促进环境毒物的代谢清除,将其转变为无毒性或易于排泄的物质,起到增强细胞抗氧化及解毒功能的作用,对维持机体氧化还原平衡有重要意义。Nrf2缺失将影响抗氧化酶系和Ⅱ相解毒酶等的转录。
2.5激活Nrf2-ARE信号通路对机体氧化应激损伤的防护作用Nrf2-ARE信号通路被激活后启动下游保护性基因转录,其中抗氧化酶系可以清除过多因氧化还原失衡而增加的自由基,同时也能清除被氧化的蛋白质,在一定程度上抑制氧化应激,从而减轻自由基和亲电子物质引起的细胞损伤,进而表现出对机体的氧化应激损伤的防护作用。Nrf2-ARE信号通路与肿瘤、炎症、神经系统疾病、自身免疫性疾病等多种疾病的病理生理进程密切相关,能够作为相关治疗药物的作用靶点[33]。
3Nrf2的诱导剂与抑制剂
3.1Nrf2诱导剂Nrf2诱导剂,如姜黄素、SNF、富马酸二甲酯(dimethyl fumarate, BG-12)等,是ARE依赖的Ⅱ相细胞保护酶的强诱导剂。越来越多相关的研究表明,ARE依赖性基因的活化是由诱导剂通过调节细胞内蛋白激酶信号通路的活性介导的。SNF是从十字花科植物绿花椰菜中提取的,其抗氧化应激作用机制是激活Nrf2-ARE信号通路,诱导Ⅱ相酶(NQO1、GST、γ-GCS、UGT等)的表达[34]。巴多克沙龙是一种合成的三萜类化合物,其作用主要由Nrf2-ARE 通路介导,能够诱导Ⅱ相解毒酶(如NQO1、GST等)表达,抑制诱导型一氧化氮合酶(iNOS)的表达。BG-12是已被开发的Nrf2的活化剂。Scannevin等[35]证明,用BG-12作用于原代培养的中枢神经系统(CNS)细胞或动物可引起核内Nrf2 和Ⅱ相细胞保护酶水平增高,由此来发挥抗氧化作用。
3.2Nrf2抑制剂截止目前,大多数研究集中在Nrf2的活化,对其抑制剂的研究比较少。近期研究发现,Nrf2 的过度表达具有致癌作用,而Nrf2致癌作用的分子机制仍未完全明了,需要进一步研究[36]。研究发现,参与抑制Nrf2的核受体包括维甲酸受体α (RARα)、视黄醇类X受体α (RXRα)、过氧化物酶体增殖物激活受体γ (PPARγ)、雌激素受体α (ERα)、雌激素相关受体-β (ERRβ)和糖皮质激素受体(GR)等,这些核受体都能与Nrf2相互作用而抑制ARE依赖性基因的表达。最近研究发现的Nrf2抑制剂,包括内源性蛋白,如Bach1、p53、ATRA、转录激活因子3(ATF3)、E-钙粘素和微囊蛋白-1等;外源性抑制剂如赭曲霉素-A、木犀草素、鸦胆苦醇、原花青素、芹菜素和葫芦巴碱等,都能有效抑制Nrf2-ARE信号通路的活化。然而,这些抑制剂对Nrf2-ARE信号通路的抑制作用机制在很大程度上尚不清楚。
4结语
近年来的研究表明,Nrf2-ARE信号通路在抗氧化应激损伤中起着重要的作用,能够维持细胞内氧化还原平衡,保护细胞和组织免受损伤,对这一通路的深入研究能够解释机体自身防御的机制。当前对Nrf2-ARE信号通路抗氧化机制的研究主要集中于其对下游抗氧化基因和Ⅱ相解毒酶的转录诱导。越来越多的研究表明Keap1-Nrf2-ARE信号通路的调控是十分精细和复杂的,并且还存在着其他信号通路的参与。需要注意的是,Nrf2的持续激活也会诱导疾病的发生,如癌症、动脉硬化等。多种疾病如肿瘤、神经系统疾病均伴随着氧化应激损伤,可以观察到Nrf2活性和抗氧化蛋白活性的改变是一致的,由Nrf2-ARE信号通路介导的一系列机体抗氧化反应还存在许多无法解释的问题,今后对于这一领域还需进行更加深入的探索。随着研究的深入,Nrf2-ARE信号通路将可能作为一个有效的药物作用靶点,为治疗相关疾病提供新的治疗方案,具有广阔的研究价值和发展前景。
[参考文献]
[1]Bartz R R, Piantadosi C A. Clinical review: Oxygen as a signaling molecule [J]. Critical Care, 2010,14(5):234-242.
[2]Valavanidis A, Vlachogianni T, Fiotakis K,etal. Pulmonary Oxidative Stress, Inflammation and Cancer: Respirable Particulate Matter, Fibrous Dusts and Ozone as Major Causes of Lung Carcinogenesis through Reactive Oxygen Species Mechanisms[J].Int J Environ Res Public Health, 2013,10(4):3886-3907.
[3]Kundu J K, Surh Y J. Nrf2-Keap1 signaling as a potential target for chemoprevention of inflammation-associated carcinogenesis [J].Pharm Res, 2010,27(10):999-1013.
[4]Li L, Dong H, Song E,etal. Nrf2/ARE pathway activation, HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling[J].Chemico-Biological Interactions, 2014,20(9):56-67.
[5]Niture S K, Khatri R, Jaiswal A K. Regulation of Nrf2-an update [J]. Free Radic Biol Med, 2014,66(11):36-44.
[6]Nioi P, Nguyen T, Sherratt P J,etal. The carboxy-terminal Neh3 domain of Nrf2 is required for transcriptional activation [J].Mol Cell Biol, 2005,25(24):10895-10906.
[7]Kim J H, Yu S, Chen J D,etal. The nuclear cofactor RAC3/AIB1/SRC-3 enhances Nrf2 signaling by interacting with transactivation domains [J].Oncogene, 2013,2(4):514-527.
[8]Rada P, Rojo A I, Chowdhry S,etal. SCF/TrCP promotes glycogen synthase kinase 3-dependent degradation of the Nrf2 transcription factor in a Keap1-independent manner[J].Mol Cell Biol, 2011,31(6):1121-1133.
[9]Chowdhry S, Zhang Y, Mcmahon M,etal. Nrf2 is controlled by two distinct beta-TrCP recognition motifs in its Neh6 domain, one of which can be modulated by GSK-3 activity[J]. Oncogene, 2013,32(32):3765-3781.
[10]Wang H, Liu K, Geng M,etal. RXRalpha inhibits the NRF2-ARE signaling pathway through a direct interaction with the Neh7 domain of NRF2[J].Cancer Res, 2013,73(10):3097-3108.
[11]Maqesh S, Chen Y, Hu L. Small molecule modulators of Keap1-Nrf2-ARE pathway as potential preventive and therapeutic agents[J].Med Res Rev, 2012,32(4):687-726.
[12]Itoh K, Mimura J, Yamamoto M. Discovery of the negative regulator of Nrf2, Keap1: a historical overview[J].Antioxid Redox Signal, 2010,13(6):1665-1678.
[13]Tong K I, Padmanabhan B, Kobayashi A,etal. Different electrostatic potentials define etge and dlg motifs as hinge and latch in oxidative stress response[J].Mol Cell Biol, 2007,27(21):7511-7521.
[14]Keum Y S, Choi B Y. Molecular and Chemical Regulation of the Keap1-Nrf2 Signaling Pathway[J].Molecules, 2014,19(14):10074-10089.
[15]Uruno A, Motohashi H. The Keap1-Nrf2 system as an in vivo sensor for electrophiles[J].Nitric Oxide, 2011,25(8):153-160.
[16]Aoki K, Kamioka Y, Matsuda M. Fluorescence resonance energy transfer imaging of cell signaling from in vitro to in vivo: Basis of biosensor construction, live imaging, and image processing[J].Develop Growth Differ, 2013,55(30):515-522.
[17]Baird L, Lleres D, Swift S,etal. Regulatory flexibility in the Nrf2-mediated stress response is conferred by conformational cycling of the Keap1-Nrf2 protein complex[J].Proc Natl Acad Sci USA, 2013,110(38):15259-15264.
[18]Baird L, Swift S, Lleres D,etal. Monitoring Keap1-Nrf2 interactions in single live cells[J].Biotechnol Adv, 2014,32(15):1133-1144.
[19]Buckley B J, Li S, Whorton A R. Keap1 modification and nuclear accumulation in response to S-nitrosocysteine[J].Free Radic Biol Med, 2008,44(10):692-698.
[20]Keum Y S. Regulation of Nrf2-mediated phase Ⅱ detoxification and anti-oxidant genes[J].Biomol Ther, 2012,20(2):144-151.
[21]Lee S, Lim M J, Kim M H,etal. An effective strategy for increasing the radiosensitivity of Human lung Cancer cells by blocking Nrf2-dependent antioxidant responses[J].Free Radic Biol Med, 2012,53(8):807-816.
[22]Tkachev V O, Menshchikova E B, Zenkov N K. Mechanism of the Nrf2/Keap1ARE signaling system[J].Biochemistry (Moscow), 2011,76(11):407-422.
[23]Baird L, Dinkova-Kostova A T. The cytoprotective role of the Keap1-Nrf2 p athway[J].Arch Toxicol, 2011,85(6):41-47.
[24]Satoh T, McKercher S R, Lipton S A. Reprint of: Nrf2/ARE-mediated antioxidant actions of pro-electrophilic drugs[J].Free Radic Biol Med, 2014,66(8):45-57.
[25]Niture S K, Kaspar J W, Shen J,etal. Nrf2 signaling and cell survival[J].Toxicol Appl Pharmacol, 2010,244:37-42.
[26]Li Y, Paonessa J D, Zhang Y S. Mechanism of chemical activation of Nrf2[J].PLoS One, 2012,15(4):e35122-e35128.
[27]Hu R, Saw C L, Yu R,etal. Regulation of Nrf2 signaling for cancer chemoprevention: antioxidant coupled with anti-inflammatory[J].Antioxid Redox Signal, 2010,13(3):1679-1698.
[28]Kaspar J W, Jaiswal A K. An autoregulatory loop between Nrf2 and Cul3-Rbx1 controls their cellular abundance[J].J Biol Chem, 2010,285(28):21349-21358.
[29]Velichkova M, Hasson T. Keap1 regulates the oxidation-sensitive shuttling of Nrf2 into and out of the nucleus via a Crm1-dependent nuclear export mechanism[J].Mol Cell Biol, 2005,25(11):4501-4513.
[30]Kaspar J W, Niture S K, Jaiswal A K. Antioxidant-induced INrf2 (Keap1) tyrosine 85 phosphorylation controls the nuclear export and degradation of the INrf2-Cul3-Rbx1 complex to allow normal Nrf2 activation and repression[J].J Cell Sci, 2012,125(4):1027-1038.
[31]Jain A K, Bloom D A, Jaiswal A K. Nuclear import and export signals in control of Nrf2[J].J Biol Chem, 2005,280(32):29158-29168.
[32]Li W, Yu S, Liu T,etal. Heterodimerization with Small Maf Proteins Enhances Nuclear Retention of Nrf2 via Masking the NESzip Motif[J].Biochim Biophys Acta, 2008,1783(10):1847-1856.
[33]Lisk C, McCord J, Bose S,etal. Nrf2 activation: A potential strategy for the prevention of acute mountain sickness[J].Free Radic Biol Med, 2013,63(15):264-273.
[34]Wang H, Khor T O, Yang Q,etal. Pharmacokinetics and pharmacodynamics of phase Ⅱ drug metabolizing/antioxidant enzymes gene response by anticancer agent sulforaphane in rat lymphocytes[J].Mol Pharm, 2012,9(10):2819-2827.
[35]Scannevin R H, Chollate S, Jung M Y,etal. Fumarates promote cytoprotection of central nervous system cells against oxidative stress via the nuclear factor (erythroid-derived 2)-like 2 pathway[J].J Pharmacol Exp Ther, 2012,341(1):274-284.
[36]Namani A, Li Y, Wang X J,etal. Modulation of Nrf2 signaling pathway by nuclear receptors: Implications for cancer[J].Biochim Biophys Acta, 2014,184(3):1875-1885.
(收稿时间:2015-09-25修回时间:2015-10-20)
·论著·
Progression of Nrf2-ARE Signaling Pathway in Protection of Oxidative Stress Injury of the Body
WANG Ning1,2, MA Hui-ping1, QI Xin-zhu1, MENG Ping1, JIA Zheng-ping1,2(1. College of Pharmacy, Lanzhou University, Lanzhou 730000, China; Key Laboratory of Prevention and Cure for the Plateau Environmental Damage of PLA, Lanzhou General Hospital of Lanzhou Military Area Command, lanzhou 730050, China)
[Abstract]The nuclear factor erythroid 2 p45-related factor 2 (Nrf2) is a key transcription factor of cell anti-oxidative stress system, and Nrf2 nuclear translocation combined with anti-oxidative response element antioxidant responsive element (ARE) on the nucleic acid sequence is a key link in the process of activation of Nrf2-ARE signaling pathways. The activation of Nrf2-ARE signaling pathway can start the transcription of the downstream phase Ⅱ detoxification enzymes and antioxidant enzymes so as to reduce the cell injuries caused by reactive oxygen and electronic materials, keep the cells in a stable state, and maintain the body's redox in dynamic balance. Nrf2-ARE signaling pathway plays an important role in the protection of cell oxidative stress injury. The paper summarizes the progression of Nrf2-ARE signaling pathway in protection of oxidative stress injury of the body.
[Key words]Oxidative stress; Nrf2-ARE signaling pathway; Redox equilibrium; Review
[DOI]10.3969/j.issn.2095-140X.2015.12.005
[文献标志码][中国图书资料分类号]R349.1A
[文章编号]2095-140X(2015)12-0021-07
[通讯作者]贾正平,E-mail:1026573411@qq.com
[基金项目][作者单位]730050兰州,兰州军区兰州总医院药剂科全军高原环境损伤防治重点实验室(王宁、马慧萍、漆欣筑、蒙萍、贾正平);730000兰州,兰州大学药学院(王宁、贾正平)

