紫花牡荆素干预食管鳞状细胞癌细胞转移的分子机制
冉永刚,游颜杰,李海军
[作者单位] 050081 石家庄,白求恩医务士官学校(冉永刚),462000 河南 漯河,漯河市医学高等专科学校药学系(游颜杰),641000 四川 内江,内江市第二人民医院放疗科(李海军)
紫花牡荆素干预食管鳞状细胞癌细胞转移的分子机制
冉永刚,游颜杰,李海军

[作者单位]050081 石家庄,白求恩医务士官学校(冉永刚),462000 河南 漯河,漯河市医学高等专科学校药学系(游颜杰),641000 四川 内江,内江市第二人民医院放疗科(李海军)
[摘要]目的研究紫花牡荆素对人食管鳞状细胞癌(食管鳞癌)细胞恶性转移能力的抑制效应并探讨其分子机制。方法人食管鳞癌细胞株EC9706与EC109细胞经紫花牡荆素处理后,以MTT比色法测定细胞增殖能力,侵袭与迁移实验检测细胞转移能力,Western blot检测转移相关蛋白表达变化。结果不同浓度紫花牡荆素处理可显著抑制EC9706与EC109细胞的增殖、侵袭与迁移能力,同未加药组比较差异均有统计学意义(P<0.05);紫花牡荆素处理下调兔抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶2(matrix metalloproteinase2,MMP2)与基质金属蛋白酶9(matrix metalloproteinase9,MMP9)表达水平,上调上皮细胞钙黏蛋白(E-cadherin)、周期素依赖性激酶10(cyclin-dependent kinase 10, CDK10)与兔抗人受体O型蛋白质酪氨酸磷酸酶(protein tyrosine phosphatase receptor type O, PTPRO)表达。结论紫花牡荆素对食管鳞癌细胞恶性转移能力有明显的抑制作用,下调VEGF、MMP2与MMP9表达,上调E-cadherin、CDK10与PTPRO可能是其抑制转移的分子机制。
[关键词]紫花牡荆素;食管肿瘤;细胞增殖;肿瘤侵润

我国是世界食管癌高发国家之一,以鳞状上皮细胞癌(简称食管鳞癌)为主,其发病率和死亡率逐年上升[1]。研究表明远处转移是导致食管鳞癌治疗失败和患者死亡的主要原因之一。紫花牡荆素是从植物蔓荆中提取的具有广泛药理活性的多甲基黄酮化合物,是蔓荆子的主要活性成分,具有抗炎与抗肿瘤等广泛的药理活性[2-3]。本文旨在分析紫花牡荆素对食管鳞癌细胞恶性转移能力的影响并研究其分子机制,以期为新型抗肿瘤转移药物的开发提供线索。
1材料与方法
1.1主要试剂紫花牡荆素(纯度为99%,以二甲基亚砜溶解,批号GS110,购自成都普瑞法科技开发公司);DMEM培养基(31600034)与胎牛血清(10099141)购自Gibco公司;Transwell培养小室购自Corning公司(44200);兔抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)(BA0472)、基质金属蛋白酶MMP2(BA0569)、MMP9(BA0573)、上皮细胞钙黏蛋白(E-cadherin)(BA0475)多克隆抗体均购自武汉博士德公司;兔抗人受体O型蛋白质酪氨酸磷酸酶(protein tyrosine phosphatase receptor type O, PTPRO)(ab114815)与周期素依赖性激酶10(cyclin-dependent kinase 10, CDK10)(ab181752)多克隆抗体购自Abcam公司;HRP标记的羊抗兔IgG购自北京中杉金桥公司(ZB2307);其他常规化学试剂均为进口或国产分析纯。
1.2细胞培养人食管鳞癌细胞株EC9706与EC109由汕头大学医学院附属肿瘤医院中心实验室提供,置于含10%胎牛血清(FBS)的DMEM培养液,于37℃、5% CO2条件下常规培养,定时换液、传代。
1.3MTT比色法检测细胞增殖能力细胞以5×103/孔接种于96孔板中,设4个复孔,培养24 h;更换含有不同浓度(0、1、2、4、8、16 μmol/L)紫花牡荆素的培养液(倍比稀释配制)继续培养72 h,加入20 μl MTT(5 mg/ml)作用4 h;弃去培养液加入150 μl DMSO,振荡10 min,测定490 nm吸光度值(A490)。实验重复3次取平均值。
1.4细胞侵袭与迁移实验检测细胞转移能力侵袭实验:细胞经2 μmol/L紫花牡荆素处理24 h后,以无血清DMEM培养液调整细胞密度为2×106/ml,于每个预先铺有Matrigel的Transwell上室内加入100 μl;将整个小室放入含10% FBS的DMEM培养液的24孔板内培养24 h;取出上室以甲醇固定,结晶紫染色,擦掉位于上表面未穿膜细胞后封片,光镜下计数5个200倍视野的细胞。实验重复3次。细胞迁移实验除Transwell小室未铺有Matrigel外,其余步骤与侵袭实验相同。
1.5Western blot检测转移相关蛋白表达EC109细胞经2 μmol/L紫花牡荆素处理24 h后,裂解细胞取50 μg总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转印至PVDF膜上,含5% BSA的TBST中4℃封闭过夜;分别加入适当稀释的MMP2、MMP9、E-cadherin、VEGF、CDK10或PTPRO抗体,37℃作用1 h;充分洗涤后加入1:1000稀释的HRP标记羊抗兔IgG,37℃作用30 min,以ECL Kit进行化学发光反应,胶片随后进行显影、定影。应用Bio-rad公司Quantity One软件分析结果,并以β-actin以作为内参半定量计算目的基因蛋白相对表达水平。

2结果
2.1紫花牡荆素抑制食管鳞癌细胞增殖EC109与EC9706细胞经不同浓度紫花牡荆素处理72 h后,其增殖能力相对于未处理(0 μmol/L)对照组显著降低,抑制效应呈剂量依赖性(表1),各组间差异均有统计学意义(F=45.31与71.21,P<0.05)。

表1 紫花牡荆素对食管鳞癌细胞增殖的抑制作用±s)
2.2紫花牡荆素减低肿瘤细胞侵袭能力EC109与EC9706细胞经2 μmol/L紫花牡荆素处理后,侵袭细胞数量分别为(177.9±23.5)和(265.7±32.1),未处理组分别为(95.0±23.5)和(115.0±18.5),差异有统计学意义(EC109组t=115.23,P<0.01;EC9706组t=65.73,P<0.05)。
2.3紫花牡荆素抑制肿瘤细胞迁移能力EC109与EC9706细胞经2 μmol/L紫花牡荆素处理后,迁移细胞数量分别为(247.5±23.5)和(115.0±18.5),未处理组分别为(386.7±33.5)和(337.7±37.1),差异有统计学意义(EC109组t=65.485,P<0.05;EC9706组t=65.73,P<0.05)。
2.4紫花牡荆素对转移相关蛋白表达的影响EC109细胞经2 μmol/L紫花牡荆素处理后,MMP2、MMP9与VEGF蛋白表达水平相对于对照组明显减弱,而E-cadherin、PTPRO与CDK10蛋白表达水平明显增强(图1)。半定量分析进一步证实了上述结果(MMP2与MMP9,P均<0.01;VEGF、E-cadherin、PTPRO与CDK10,P均<0.05)(表2)。
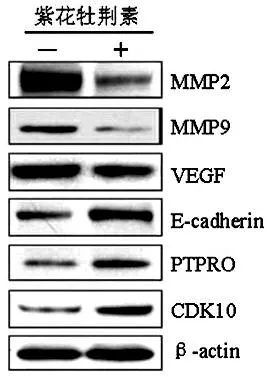
图1 2 μmol/L紫花牡荆素对转移相关蛋白表达的调节Western blot检测

表2 2 μmol/L紫花牡荆素对转移相关蛋白表达的调节半定量分析
3讨论
紫花牡荆素是一种植物来源的多甲基黄酮化合物,存在于多种植物果实或叶子,如马鞭草科植物蔓荆、香茶菜属、马鞭草科植物穗花牡荆等。紫花牡荆素可通过诱导肿瘤细胞凋亡抑制其恶性增殖[4-5]。本研究中发现紫花牡荆素可以呈剂量依赖性抑制食管鳞癌细胞增殖。在此基础上,为了避免高浓度药物的细胞毒作用对后续实验的影响,本研究选择较低药物浓度(2 μmol/L),进一步应用侵袭、迁移实验以及Western blot方法检测紫花牡荆素对食管鳞癌细胞恶性转移能力的调节及相关分子的表达水平变化。
基底膜的降解既是肿瘤恶性转移的关键步骤,同时又是肿瘤血管生成的重要环节。基质金属蛋白酶(MMPs)是一组锌离子依赖性内肽酶,其主要成员MMP2和MMP9通过降解Ⅳ型胶原破坏基底膜,从而促进肿瘤侵袭和转移[6]。最新研究表明,肿瘤细胞同样存在VEGF受体并接受VEGF信号通路的调节。VEGF既通过旁分泌机制作用于周围的血管内皮细胞,同时以自分泌方式作用于肿瘤细胞自身,阻断VEGF信号通路可以从多方面抑制肿瘤生长与转移[7-10]。E-cadherin介导细胞同质黏附而维持细胞间正常连接和细胞极性,其表达减弱或缺失直接引起细胞间黏附性降低,导致肿瘤细胞发生侵袭转移[11-14]。本研究结果提示,低浓度紫花牡荆素抑制食管鳞癌细胞与基质的黏附能力以及逆转癌细胞的恶性侵袭能力,可能是通过下调MMP2、MMP9和VEGF表达,同时恢复E-cadherin表达实现的。
本研究同时发现,紫花牡荆素处理食管鳞癌细胞后可以显著增强PTPRO与CDK10的蛋白表达水平。PTPRO是新发现的O型受体蛋白酪氨酸磷酸酶,是在肿瘤发展过程中发挥重要抑制性调节作用的磷酸化酶之一[15-17]。而作为一种特殊的周期素依赖激酶,过表达CDK10可逆转肿瘤细胞的恶性转移能力[18-20]。PTPRO与CDK10已被证实在多种肿瘤中表达下调,是潜在的候选抑癌基因。应用紫花牡荆素处理食管鳞癌细胞可导致PTPRO与CDK10表达上调,进一步阐明了紫花牡荆素作为抗肿瘤转移药物的分子作用机制。
[参考文献]
[1]Yong F, Xudong N, Lijie T. Human papillomavirus types 16 and 18 in esophagus squamous cell carcinoma: a meta-analysis[J].Ann Epidemiol, 2013,23(11):726-734.
[2]黄继红,游颜杰,郑坚.紫花牡荆素诱导食管癌细胞凋亡的分子机制[J].中国现代医生,2013,2(4):197-199.
[3]Chen D, Cao J, Tian L,etal. Induction of apoptosis by casticin in cervical cancer cells through reactive oxygen species-mediated mitochondrial signaling pathways[J].Oncol Rep, 2011,26(8):1287-1294.
[4]Zhou Y, Tian L, Long L,etal. Casticin potentiates TRAIL-induced apoptosis of gastric cancer cells through endoplasmic reticulum stress[J].PLOS One, 2013,8(3):e58855.
[5]王奕鸿,刘济生,盛伟华,等.RGD 修饰的腺病毒介导的 ING4 对人鼻咽癌细胞裸鼠移植瘤的影响[J].解放军医药杂志,2014,26(4):50-54.
[6]王光茂,原银萍,赵翠秀,等.结肠癌组织MMP2和MMP9及VEGF表达临床意义的研究[J].中国医师杂志,2011,18(16):1267-1269.
[7]Clarke J M, Hurwitz H I. Targeted inhibition of VEGF receptor 2: an update on ramucirumab[J].Expert Opin Biol Ther, 2013,13(8):1187-1196.
[8]You Y, Liu J, Wang Z,etal. The enhancement of radiosensitivity in human esophageal squamous cell carcinoma cells by zoledronic acid and its potential mechanism[J].Cytotechnology, 2014,66(1):17-25.
[9]Domigan C K, Warren C M, Antanesian V,etal. Autocrine VEGF maintains endothelial survival through regulation of metabolism and autophagy[J].Cell Sci, 2015,128(12):2236-2248.
[10]Wang L, Ji S, Cheng Z. Association between polymorphisms in vascular endothelial growth factor gene and response to chemotherapies in colorectal cance: A meta-analysis[J].PLoS One, 2015,10(5):e0126619.
[11]Ran Y, Wu S, You Y. Demethylation of E-cadherin gene in nasopharyngeal carcinoma could serve as a potential therapeutic strategy[J].Biochem, 2011,149(1):49-54.
[12]Jin Y, Shenoy A K, Doernberg S,etal. FBXO11 promotes ubiquitination of the Snail family of transcription factors in cancer progression and epidermal development[J].Cancer Lett, 2015,362(1):70-82.
[13]Tiwari I, Yoon M H, Park B J,etal. Hepatitis C virus core protein induces epithelial-mesenchymal transition in human hepatocytes by upregulating E12/E47 levels[J].Cancer Lett, 2015,362(1):131-138.
[14]Verduzco D, Lloyd M, Xu L,etal. Intermittent hypoxia selects for genotypes and phenotypes that increase survival invasion and therapy resistance.[J].PLoS One, 2015,10(3):e0120958.
[15]You Y, Chen Y, Zheng X,etal. Aberrant methylation of the PTPRO gene in peripheral blood as a potential biomarker in esophageal squamous cell carcinoma patients[J].Cancer Lett, 2012,315(2):138-144.
[16]Zhang W, Hou J, Wang X,etal. PTPRO-mediated autophagy prevents hepatosteatosis and tumorigenesis[J].Oncotarget, 2015,6(11):9420-9433.
[17]Zhang X, Tan Z, Wang Y,etal. Protein tyrosine phosphatase receptor type O expression in the tumor niche correlates with reduced tumor growth, angiogenesis, circulating tumor cells and metastasis of breast cancer[J].Oncol Rep, 2015,33(4):1908-1914.
[18]You Y, Yang W, Wang Z,etal. Promoter hypermethylation contributes to the frequent suppression of the CDK10 gene in human nasopharyngeal carcinomas[J].Cell Oncol (Dordr), 2013,36(4):323-331.
[19]Zhong X Y, Xu X X, Yu J H,etal. Clinical and biological significance of Cdk10 in hepatocellular carcinoma[J].Gene, 2012,498(1):68-74.
[20]Khanal P, Yun H J, Lim S C,etal. Proyl isomerase Pin1 facilitates ubiquitin-mediated degradation of cyclin-dependent kinase 10 to induce tamoxifen resistance in breast cancer cells[J].Oncogene, 2012,31(34):3845-3856.
(收稿时间:2015-09-20修回时间:2015-10-24)
·论著·

Molecular Mechanisms of Casticin in Intervention of Cancer Cell Metastasis in Esophagus Squamous Cell Carcinoma
RAN Yong-gang1, YOU Yan-jie2, LI Hai-jun3(1. Department of Teaching and Training, Bethune Military Medical NCO School of PLA, Shijiazhuang 050081, China; 2. Department of Pharmacy, Luohe Medical College, Luohe, Henan 462000, China; 3. Department of Radiotherapy, the Second People's Hospital of Neijiang City, Neijiang, Sichuan 641000, China)
[Abstract]ObjectiveTo investigate the depressive effect of Casticin on malignant metastasis of human esophagus squamous cell carcinoma (ESCC) cells and to analyze its molecular mechanisms. MethodsThe EC9706 and EC109 cells in ESCC cell line were treated with Casticin, and then the thiazolyl blue (MTT) colorimetry was used to detect cell abilities of proliferation, invasion and migration, and related protein expressions were detected using Western blot method. ResultsEC9706 and EC109 cells abilities of proliferation, invasion and migration were significantly inhibited after different concentrations of Casticin treatment, and the differences were statistically significant compared with those without Casticin treatment (P<0.05); after the Casticin treatment, the expressions of vascular endothelial growth factor (VEGF), matrix metalloproteinase-2 (MMP2) and matrix metalloproteinase-9 (MMP9) were decreased, while the expressions of epithelium-cadherin (E-cadherin), cyclin dependent kinase10 (CDK10) and protein tyrosine phosphatase receptor type O (PTPRO) were increased. ConclusionCasticin may significantly inhibit malignant metastasis of ESCC cells, and down-regulation of VEGF, MMP2 and MMP9 expressions and up-regulation of E-cadherin, CDK10 and PTPRO expressions. Its may be the molecular mechanisms to inhibit its transfer.
[Key words]Casticin; Esophagus squamous cell carcinoma; Esophageal neoplasms; Cell proliferation; Neoplasm invasiveness
[DOI]10.3969/j.issn.2095-140X.2015.12.006
[文献标志码][中国图书资料分类号]R735.1A
[文章编号]2095-140X(2015)12-0028-04

