中华补血草的组织培养和植株再生体系优化
卢兴霞+骆建霞+任志雨+孙世海+柴慈江

摘 要:为进行中华补血草优良品种的保存和培育,为从分子水平进行泌盐植物耐盐机理研究奠定基础,本研究以中华补血草无菌苗叶片为外植体,对中华补血草的组织培养和再生体系进行了优化。结果表明,以MS + 6-BA 0.1 mg·L-1+ NAA 0.2 mg·L-1培养基为愈伤组织诱导最佳培养基,愈伤组织诱导率为100%;以MS + 6-BA 1.5 mg·L-1+ NAA 0.2 mg·L-1为丛生芽诱导最佳培养基,诱导率为99.06%;丛生芽继代培养适宜的培养基为MS + NAA 0.2 mg·L-1 + 6-BA 0.15 mg·L-1;以MS + NAA 0.2 mg·L-1培养基为最佳生根率培养基,生根率为87%,且根系生长良好。
关键词:中华补血草;组织培养;植株再生
中图分类号:Q945 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.01.006
Optimized System of Tissue Culture and Plant Regeneration of Limonium sinense
LU Xingxia, LUO Jianxia, REN Zhiyu, SUN Shihai, CHAI Cijiang
(College of Horticulture and Landscape, Tianjin Agricultural College, Tianjin 300384, China)
Abstract: In order to save and breed new varieties, and to lay the foundation for studying salt tolerance mechanism of salt secreting plant by molecular techniques, tissue culture and plant regeneration of Limonium sinensewere were optimized with the leaf explants of sterile seedlings. The results showed that the optimal medium inducing the callus was MS + 6-BA 0.1 mg·L-1+ NAA 0.2 mg·L-1, the inducing ratio was 100%; the optimal medium of regeneration buds was MS + 6-BA 1.5 mg·L-1+ NAA 0.2 mg·L-1, the regeneration ratio was 99.06%; the MS medium containing NAA 0.2 mg·L-1and 6-BA 0.15 mg·L-1 was optimal subculture medium;the MS medium containing NAA 0.2 mg·L-1 was the optimal medium of rooting, the rooting ratio was 87%, and the roots could have vigorous growth.
Key words: Limonium sinense(Girard) Kuntze; tissue culture; plant regeneration
中华补血草[Limonium sinense(Girard) Kuntze]又名匙叶草、海金花,为蓝雪科(Plumbaginaceae)补血草属的多年生草本植物,是典型的泌盐植物,具有盐腺和盐囊泡等结构,可以将体内多余盐分排出体外,使盐碱地脱盐,改善盐碱地土壤环境,被誉为改造盐碱地的“先锋植物”[1-2]。其花萼膜质,花后宿存,形态似“梅”,被誉为干支梅,是插花中人们尤为钟爱的填充花材。中华补血草根或全草均可入药,具有清热解毒、祛风消炎、活血止血、调经的功效,用于感冒、失血以及月经过多等症状,也有抗衰老、抗癌等功效,具有较高的药用价值[3-4]。目前,中华补血草以野生为主,且主要以播种方式进行繁殖,致使后代发生严重变异。建立中华补血草组织培养及再生体系,既有利于中华补血草优良品种的保存及培育,也可以为从分子水平进行泌盐植物耐盐机理研究奠定基础。本研究以中华补血草无菌苗叶片为外植体,在前期组培工作的基础上,对中华补血草的组织培养和再生体系进行进一步优化。
1 材料和方法
1.1 试验材料
试验外植体为2013年5月在天津农学院园艺园林学院试验基地采集的中华补血草花梗上获得的无菌苗叶片,在无菌条件下将叶片切成0.5 cm的正方形方块,然后接种到愈伤组织诱导及分化培养基中。
1.2 试验方法
1.2.1 中华补血草愈伤组织的诱导及分化 以MS培养基为基本培养基,附加0.2 mg·L-1NAA和不同浓度6-BA(0.1,0.5,1.0,1.5,2.0 mg·L-1),共计5个处理。pH值为5.8。每个处理接种50块以上外植体。培养30 d后,统计愈伤组织诱导率,60 d后统计丛生芽的诱导率。
1.2.2 中华补血草丛生芽继代培养基的筛选 将叶片诱导的丛生芽分别继代培养在不同浓度6-BA(0.05,0.15,0.10 mg·L-1)的继代培养基内,基本培养基为MS+NAA 0.2 mg·L-1+30 g·L-1蔗糖+7 g·L-1琼脂,放在组培室内培养。每周统计、观察继代丛生芽的生长情况,40 d后结束统计。
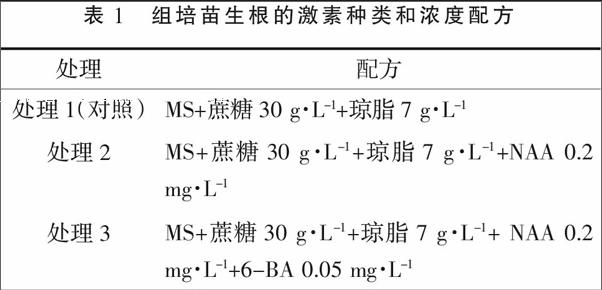
1.2.3 中华补血草组培苗的生根 以MS+蔗糖30 g·L-1+琼脂7 g·L-1为基本培养基,附加不同种类和浓度的激素,研究不同的激素种类和浓度对组培苗生根的影响。激素种类和浓度见表1,3个处理,每处理3次重复,每次重复4瓶,每瓶接种5个,每个处理接种60个组培苗。接种后每周观察1次,观察组培苗的生根时间、数量、质量,1个月后每个处理随机选取30株进行根系生长情况的观察、测量。
1.2.4 培养条件 以上试验材料均放置在组培室内,培养条件:光照3 000 lx,光照时间14 h·d-1,培养温度23~25 ℃。
1.2.5 中华补血草组培苗移栽和管理 将生根的组培苗在散射光下炼苗1周后,再开瓶炼苗5 d,然后洗去根部的琼脂,移栽到装有蛭石:草炭土=3∶1(体积比)的穴盘(12×5)中,将穴盘放入周转箱后,上面用塑料薄膜覆盖,放到室内散射光的地方,保持土壤湿润,1周后揭去塑料薄膜,正常管理。揭去塑料薄膜1周后,统计移栽成活率。
1.3 数据处理
数据采用EXCEL和SPASS 17.0 进行统计并做方差分析。
出愈率=生成愈伤组织的叶片数/接种叶片数×100%
丛生芽诱导率=分化出芽丛的愈伤组织数或叶片数/接种愈伤组织数或叶片数×100%
移栽成活率=成活植株数/移栽植株数×100%
2 结果与分析
2.1 中华补血草愈伤组织的诱导及分化
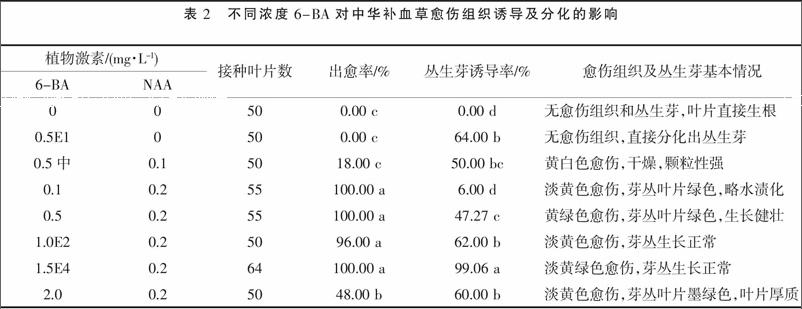
由表2可知,与对照相比,当培养基中添加了0.5 mg·L-1的6-BA时,叶片外植体伤口边缘直接发生64%的丛生芽,而不产生愈伤组织,当在此培养基中再添加0.1 mg·L-1的NAA时,外植体伤口边缘发生18%的愈伤组织,而丛生芽的发生率则从64%降低到50%。这表明,添加6-BA有助于丛生芽的诱导发生,而添加NAA则有助于愈伤组织的诱导发生。
表2中,当NAA的浓度不变(0.2 mg·L-1),6-BA的浓度从0.1 mg·L-1逐渐增加到2 mg·L-1时,尤其是6-BA浓度在1.5 mg·L-1以下范围内逐渐增加时,对愈伤组织诱导率的影响差异不显著,但当6-BA浓度增加到2 mg·L-1时,愈伤组织的诱导率显著下降到48%。这表明,当NAA浓度为0.2 mg·L-1,6-BA浓度为0.1~1.5 mg·L-1时,愈伤组织的诱导率均较高,为96%以上,愈伤组织的生长状态也较好,但从成本方面考虑,添加6-BA 0.1 mg·L-1、NAA 0.2 mg·L-1的培养基为中华补血草愈伤组织诱导最佳培养基。
但对于丛生芽诱导率而言,当6-BA 浓度在0.1~1.5 mg·L-1时,随着6-BA 浓度的增加,丛生芽诱导率也显著增加,当6-BA浓度增加到1.5 mg·L-1时,丛生芽诱导率达到最高,为99.06%,丛生芽生长正常;当6-BA浓度为2 mg·L-1时,丛生芽的诱导率显著下降到60%,且丛生芽生长异常,叶片肥厚,叶色为墨绿色。这表明,当NAA为0.2 mg·L-1时,6-BA浓度为1.5 mg·L-1是诱导丛生芽的临界浓度,低于或高于这个浓度,丛生芽诱导率均显著下降。因此,培养基中添加6-BA 1.5 mg·L-1、NAA 0.2 mg·L-1为中华补血草丛生芽诱导最佳培养基,丛生芽诱导率为99.06%,丛生芽生长发育良好。
2.2 中华补血草丛生芽继代培养基的筛选
由表3可知,6-BA浓度在0.05 mg·L-1时,转接的玻璃化丛生芽的茎叶没有伸长生长,生长状态不好,正常丛生芽生长较好,成苗率为46.67%;有18.33%的丛生芽被诱导生根,根系长势不良。6-BA浓度为0.10 mg·L-1时,转接的个别玻璃化丛生芽可以伸长生长,逐渐转向正常苗,正常丛生芽生长良好,成苗率为40%;丛生芽可以发出粗壮的根系,但须根较少。6-BA浓度为0.15 mg·L-1时,转接玻璃化丛生芽逐渐恢复正常生长,正常丛生芽健壮生长,叶色深绿,成苗率为83.33%,显著高于前两个处理;丛生芽发根的时间晚于前两个处理,根系短且须根少,生根率最少,为6.67%。由以上分析可知,随着6-BA浓度的增长,中华补血草畸形丛生芽的成苗率呈上升趋势,生根率呈下降趋势,适当增加细胞分裂素的含量可以促进丛生芽的生长发育。因此,中华补血草丛生芽适宜的继代培养基为MS + NAA 0.2 mg·L-1+ 6-BA 0.15 mg·L-1。
2.3 中华补血草组培苗的生根
由表4可知,以附加0.2 mg·L-1NAA培养基的生根率最高,达87%,其次为对照,生根率70%,二者之间达到显著性差异;附加NAA和6-BA处理的生根率最低,只有17%,且与其它两个处理达到了极显著差异。对于根系的生长情况而言,3个处理的生根数差异不大;3个处理的根长、根系的长势相比,附加0.2 mg·L-1NAA和0.05 mg·L-16-BA处理的根系最长、长势最壮,而且须根数明显多于其它两个组合;对照的根长较附加NAA处理的根系要长,但根系长势明显细弱,总体效果不好;附加NAA处理的根系粗壮,长势也较好。以上分析表明,添加6-BA不利于中华补血草的生根,但有助于促发须根。综合本试验结果认为,以MS+蔗糖30 g·L-1+琼脂7 g·L-1+ NAA 0.2 mg·L-1处理的生根率最高,且根系长势也较好。
2.4 中华补血草组培苗移栽和管理
中华补血草共移栽113株组培苗,成活101株,移栽成活率为89%,移栽成活率较高。陈世华等人[5]的研究表明,中华补血草移栽成活率可达93%以上,与本试验的结果相差不大。中华补血草的叶片为基生,且小苗叶片比较薄,浇水后容易粘附在基质表面,导致组培苗叶片霉烂,降低成活率。因此,中华补血草小苗在浇水后应及时挑离覆于湿土上的叶片,避免发生叶片霉烂而导致成活率降低。本试验认为,中华补血草属于移栽易成活的植物。
3 结论与讨论
陈世华等[5]以叶片为外植体在基本培养基中通过添加不同种类生长素及调节生长素浓度,对中华补血草的组织培养和快速繁殖体系进行了优化,不同浓度NAA与0.5 mg·L-1 6-BA组合时,当NAA浓度为0.2 mg·L-1时,不定芽诱导率最高,为88%,而本试验中NAA 0.2 mg·L-1、6-BA 0.5 mg·L-1组合培养基的不定芽诱导率仅为47.27%,显著低于前人的研究结果。但添加0.2 mg·L-1NAA和1.5 mg·L-16-BA培养基的不定芽诱导率却为99.06%,高于陈世华等人最佳不定芽培养基94%的不定芽诱导率。生根诱导时,陈世华等人在MS基本培养基中添加了不同浓度的NAA,当NAA浓度为0.1 mg·L-1时,生根率最高,为74%,NAA浓度为0.2 mg·L-1时,生根率为64%;本试验中,适宜的生根培养基为在MS培养基中添加0.2 mg·L-1NAA,生根率达87%,明显高于陈世华等的研究结果,且与他们筛选出的最佳生根培养基MS + IBA 0.1 mg·L-1的生根诱导率(86%)相近。造成试验结果不同的原因可能与中华补血草种资资源间的差异有关,一方面以播种繁殖的中华补血草其后代变异较大,另一方面种资资源也可能存在地域性差异。因此,今后应进一步扩大试验的取材范围,选取不同品种及不同产地的中华补血草进行试验,为中华补血草组织培养和再生体系建立更加完善的培养方案。
本试验对天津盐碱地栽植的中华补血草组织培养和再生体系进行了优化,为盐碱地中华补血草优株种质资源的保存和培育及泌盐植物的遗传转化研究奠定了基础。试验结果表明,诱导愈伤组织最佳培养基为MS + 6-BA 0.1 mg·L-1+ NAA 0.2 mg·L-1,诱导率为100%;丛生芽最佳培养基为MS + 6-BA 1.5 mg·L-1+ NAA 0.2 mg·L-1,诱导率为99.06%;丛生芽继代培养适宜的培养基为MS + NAA 0.2 mg·L-1+ 6-BA 0.15 mg·L-1;最佳生根率培养基为MS + NAA 0.2 mg·L-1,生根率为87%,且根系长势良好。
参考文献:
[1] 柴振光, 李萌, 王晓玲.中华补血草盐腺细胞发育的扫描电镜观察[J].现代农业科技,2009(22):100.
[2] 辛莎莎,谭玲玲,初庆刚.中华补血草盐腺发育的解剖学研究[J].西北植物学报,2011,31(10):1995-2000.
[3] 张铭清.中华补血草黄酮抑制白血病细胞增殖的初探[J].安徽农学通报,2011,17(1):54-55.
[4] 张华彬,张代臻,葛宝明,等.中华补血草的生药学研究[J].时珍国医国药,2011,22(12):2847-2848.
[5] 陈世华,张霞,赵彦修,等. 中华补血草的组织培养和快速繁殖体系的优化[J]. 安徽农业科学, 2006,34(19):4885-4886.

