西洛他唑片体内生物等效性研究
张惠海南医学院附属医院,海南 海口 570102
西洛他唑片体内生物等效性研究
张惠
海南医学院附属医院,海南海口570102
【摘要】目的:对两种国产西洛他唑片进行生物等效性研究.方法:用自身前后对照方法,20例健康男性受试者随机分组,单次口服参比制剂或受试制剂各100mg,60h内间断采血样;采用高效液相色谱法测定血浆中药物浓度,计算药动学参数.结果: 2种西洛他唑片在人体内药时曲线符合二室模型,主要动力学参数Tmax分别为3. 25±0. 85、3. 35±0. 81h; Cmax分别为876. 70±276. 48、823. 79± 242. 37ng/ml; AUC0~t分别为11137. 31±2847. 19、10981. 44±2475. 94(ng·h)/ml,AUC0~∞分别为11974. 78±3076. 05、11939. 44± 2998. 14(ng·h)/ml,T1/2分别为11. 07±5. 87、10. 23±8. 48h;两种制剂的主要药动学参数Cmax、AUC0~t经对数转换后进行方差分析及双单侧t检验,并计算90%置信区间,表明两种制剂生物等效,受试制剂西洛他唑片的人体相对生物利用度为(101. 3±24. 6)%.结论:试验和参比制剂具有生物等效.
【关键词】西洛他唑;生物等效性;高效液相色谱
Cilostazol tables in vivo bioequivalence Study
ZHANG Hui
Hainan Medical University Affiliated Hospital,Haikou 570102,China
Abstract:Objective To evaluate the bioequivalence of two formulations cilostazol tables in healthy volunteers. Methods 100mg Test preparation and reference preparation were given to 20 healthy male volunteers in randomized two-way crossover design for the pharmacokinetic and relative bioavailability study. Plasma concentration of cilostazol were determined by RP-HPLC. Results The concentration-curve in vivo oftwo formulations cilostazol tables in healthy volunteers. The main pharmacokinetic parameters of the two preparation were : Tmax 3. 25±0. 85 and 3. 35±0. 81h,Cmax 876. 70±276. 48 and 823. 79±242. 37ng/ml,AUC0~t11137. 31± 2847. 19 and 10981. 44±2475. 94ng·h/ml. AUC0~∞11974. 78±3076. 05 and 11939. 44±2998. 14ng·h/ml,T1/2(Ke)11. 07±5. 87 and 10. 23±8. 48h,respectively. The mean relative bioavailability of test preparation vs reference preparation were(101. 3±24. 6)% . Conclusion The results of statistical analysis shows that the reference and the test tablets were bioequivalent.
Key words:KEYWORDS: Cilostazol; Bioequivalence; HPLC
西洛他唑(Cilostazol)为抗血小板药,通过抑制血小板及血管平滑肌内磷酸二酯酶活性,从而增加血小板及平滑肌内cAMP浓度,发挥抗血小板作用及血管扩张作用.主要用于治疗由动脉粥样硬化、大动脉炎、血栓闭塞性脉管炎、糖尿病所致的慢性动脉闭塞症.西洛他唑能改善肢体缺血所引起的慢性溃疡、疼痛、发冷及间歇跛行,并可用作上述疾病外科治疗(如血管成形术、血管移植术、交感神经切除术)后的补充治疗以缓解症状.本试验以浙江大家制药有限公司的西洛他唑片作为参比剂,考察海南绿岛制药有限公司生产的西洛他唑片的药动学,作出生物等效性评价.
1 材料与方法
1. 1受试者资料受试者选择20名男性健康受试者,体重指数19. 2~24. 0kg/m2,年龄19~26岁.所有受试者均通过健康体格检查,实验室检查(血常规、肝功能、肾功能、心电图等)均属正常,精神状态良好.在试验期1个月内未服用过任何其他药物,且在试验期1个月内禁忌烟酒.所有受试者均签署知情同意书,并经本基地伦理委员会审批同意.
1. 2药品及试剂西洛他唑片(每片50mg,批号: 101201,海南绿岛制药有限公司);参比制剂(R):西洛他唑片(每片50mg,批号: 120403P,浙江大家制药有限公司);西洛他唑(批号: 100363-200301,中国药品生物制品检定所);地西泮(批号: 171225-
200903,中国药品生物制品检定所).乙腈(色谱纯,美国Fisher公司);甲醇(色谱纯,美国Fisher公司);其余试剂均为分析纯.
1. 3给药方案20例受试者随机分成2组,每组10例,按2×2交叉试验方案设计,两期研究间的清洗期为14d.参比制剂或受试制剂,经药物清除期(2周)后交换给药.在服药前禁食12h,次晨空腹口服100mg参比制剂(R)或受试制剂(T),统一饮水250ml,服药后2h内不喝水,不吃食物,至给药后4h给予统一低脂标准餐.
1. 4血样采集分别于给药前(0h)及给药后0. 5、1、2、3、4、6、8、10、12、24、36、48、60h各取静脉血4ml,血样采集后,于3000r/min离心10min,分离出血浆约2. 5ml,立即分装置EP管中于-20℃低温保存待测.
1. 5样品测定
1. 5. 1色谱条件色谱系统Agilent 1200型系列高效液相色谱仪(包括四元梯度泵、在线脱气机、自动进样器、柱温箱、化学工作站);色谱柱: Agilent Eclipse XDB-C18(4. 6×150mm,5μm);柱温: 35℃;流动相:乙腈-30mM乙酸铵水溶液(45∶55);流速: 0. 5ml/min;检测波长: 254nm.在此色谱条件下,西洛他唑的出峰时间约为9min,内标物地西泮的出峰时间约为16min,两个峰之间分离良好,血浆中无内源性物质干扰分离,见图1.
1. 5. 2血样预处理冷冻血浆在室温下融化,在涡旋器上涡旋约20s.吸取0. 6ml血浆,置10ml离心管中,加入内标液(22. 2μg/ml)15μl,漩涡混匀,加乙酸乙酯4ml,涡旋混合2min,3500r/min离心5min.精密吸取上层有机相于40℃水浴氮气吹干,残渣用甲醇100μl溶解,取15μl进样.记录色谱图,内标法以峰面积定量.

图1 高效液相色谱图
1. 5. 3标准曲线制备精密称取西洛他唑对照品10. 3mg置于100ml容量瓶中,加甲醇定容至刻度得103μg/ml标准储备液,精密称取内标物地西泮11. 09mg置于100mL容量瓶中,加甲醇定容至刻度得110. 9 μg·ml-1储备液,再用甲醇稀释得22. 2μg/ml的内标液.取健康人空白血浆10ml若干份,分别加入西洛他唑标准储备液使其浓度分别为25. 75、51. 5、103. 0、206. 0、515. 0、1030. 0、2060. 0ng/ml的标准含药血浆.按“1. 5. 2”项下操作,同时制备空白样品,进行HPLC分析,记录色谱图,计算西洛他唑峰面积As和内标峰面积Ai的比值.以比值(= As/Ai)对血药浓度C作权重回归计算,权重系数w = 1/C2,线性范围为25. 75~2060. 0 ng/ml(r = 0. 9995),最小可定量浓度为25. 75ng/ml(S/N>10).
1. 5. 4方法学评价配制低、中、高3种浓度(51. 5、206、1030ng/ml)的标准血样,按“1. 5. 2”项处理后进样,同时以相应浓度对照品溶液直接进样,将两组峰面积进行比较计算萃取回收率.另配制低、中、高3种浓度(51. 5、206、1030ng/ml)的标准血样,相应方法处理后进样,由标准曲线计算出浓度,将所得的浓度与已知加人浓度相比,计算相对回收率及日内、日间精密度.结果见表1.
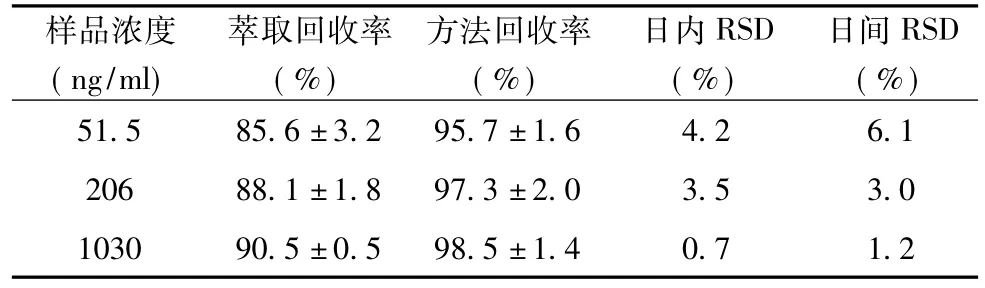
表1 西洛他唑血浆回收率及精密度测定结果
1. 6数据处理以实测值计算Cmax、Tmax;以末端相血药浓度的对数值对时间进行回归,求得斜率Ke及T1/2,运用梯形法计算曲线下面积AUC0~t、AUC0~∞= AUC0~t+ ct/Ke.两种制剂的主要药动学参数Cmax,AUC0~t经对数转换后进行方差分析,在α=0. 05水平进行双单侧t检验,按受试制剂AUC0~t在参比制剂80%~125%,Cmax在75%~133%内判定标准,考察两制剂是否具有生物等效性.
2 结果
2. 1药动学参数20例健康志愿者单剂量口服西洛他唑参比与受试制剂100mg平均药-时曲线见图2,主要药动学参数见表2.

图2 健康受试者口服100mg西洛他唑片后平均血药浓度—时间曲线
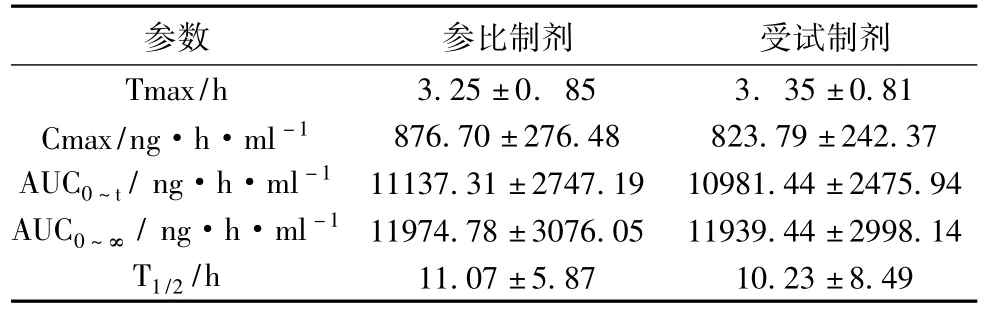
表2 20例志愿者口服两种西洛他唑片后的药动学参数
2. 2生物等效性两种制剂间和给药次序间无显著差别,AUC0→T、AUC0→∞在不同给药周期间有显著差异,Cmax在不同给药周期间无显著差异,双单侧t检验的统计参数th 和tl两药均大于单侧t(0. 05,18)(1. 75).试验制剂和参比制剂中西洛他唑的Tmax值经Wilcoxon检验,不同制剂间无显著差异(Z =-0. 587,P = 0. 557).按照生物等效性判定标准,认为两种制剂生物等效.分析结果见表3.
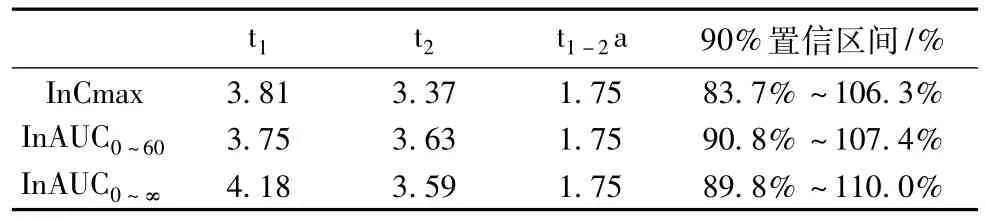
表3 生物等效性分析结果
2. 3临床观察受试者空腹单剂量口服100mg西洛他唑片后,一般情况良好,整个试验过程中,无明显不良反应发生.
3 讨论
本试验建立高效液相色谱法测定人血浆中西洛他唑的浓度,并使用液–液萃取法处理血浆样品,使内源性杂质与西洛他唑很好地分离.该方法操作简便、灵敏度佳、特异性高、重现性好,适于西洛他唑药动学及生物等效性研究.
20名受试者口服西洛他唑受试制剂与参比制剂后,主要药动学参数经统计学检验无显著性差异,说明两种制剂的吸收、分布过程基本相似.经计算受试制剂的平均相对生物利用度为(101. 3±24. 6)%;经生物等效性统计分析,均表明两种不同厂家生产的西洛他唑片具有生物等效性.
参考文献
[1]吴友良.市售不同批次西洛他唑片人体药动学参数比较[J].中国药房,2011,38(22): 3590-3592.
[2]乔海灵,胡玉容,贾琳静,等.西洛他唑片在健康人体的药代动力学和生物等效性[J].中国临床药理学杂志,200,20(6): 426-429.
[3]史美甫,郭涛,李明,等.精编临床用药必备[M].北京:中国科学技术出版社,2003: 772.
[4]Woo SK,Kang WK,Kwon KI.Pharmacokinetic and pharmacodyamic modeling of the antiplatelet and cardiovascular effects of cilostazol in healthy humans [J].Clin Pharmacol Ther,2002,71(4): 246-252.
收稿日期:( 2014. 10. 20)
【文章编号】1007-8517(2015)02-0006-03
【文献标志码】A
【中图分类号】R969. 1

