雄烯二酮的微生物生产与转化研究进展
王 鸿,周启春,邵燕燕,陈 苏
(浙江工业大学 药学院,浙江 杭州 310014)
雄烯二酮的微生物生产与转化研究进展
王鸿,周启春,邵燕燕,陈苏
(浙江工业大学 药学院,浙江 杭州 310014)
摘要:甾体激素类药物在制药行业至关重要,在医疗领域的应用范围不断扩大,并已广泛应用于临床,而雄烯二酮是生产甾体激素类药物不可或缺的关键中间体.微生物转化可以替代一些化学合成难以进行的反应,逐渐成为甾体激素类药物生产的关键技术,通过微生物转化得到药物关键中间体雄烯二酮,再由其生产出有价值的甾体激素类化合物,已成为现在研究的热点.通过微生物法生产及转化雄烯二酮的研究进展的综述,为进一步甾体激素类药物的研究提供了参考.
关键词:雄烯二酮;生物转化;甾体化合物
Studies on production and transformation of steroidal drugs
intermediate 4AD by microbacteria
WANG Hong, ZHOU Qichun, SHAO Yanyan, CHEN Su
(College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:Steroid hormone drugs are important in the pharmaceutical industry and have been widely used in clinical applications. Androstenedione is a key intermediate for the synthesis of steroid hormones drugs. Microbial transformation is an alternative for some reactions which may not happened under a regular chemical way. Androstenedione is the one which can be obtained by microbial transformation, and then be used to produce valuable compounds of steroid hormones as an intermediate. In this paper, the advances of microbial production and biotransformation of androstenedione were summarized. It could be used as a reference for the further research of steroid hormone drugs.
Key words:androstenedione; biotransformation; steroid
甾体激素类药物是世界上仅次于抗生素的第二大类药物,对机体起着非常重要的调节作用,已经成为临床上不可缺少的药物[1],被广泛应用于消炎、避孕、治疗心血管疾病、抗肿瘤、人体器官移植、内分泌失调和老年性疾病等.甾体激素类药物主要分为三大类:1) 肾上腺皮质激素(Adrenal cortex hormones),如醛固酮(Aldosterone)、去氧皮质酮(Desoxycortone)、氢化可的松(Hydrocortisone)、可的松(Cortisone)和地塞米松(Dexamethasone)等,主要用于免疫抑制、抗炎和抗毒素等;2) 性激素(Sexhormones),包括雌激素(Estrogens),如雌二醇(Estradiol)等,孕激素(Progestoens),如孕酮(Progesterone)等和雄激素(Androgens),如睾酮(Testosterone)等三类,主要用于治疗性功能型疾病和避孕等;3) 蛋白同化激素(Anabolic steroids),是一种半合成激素类药物,主要通过改造天然来源的雄性激素结构,使其激素活性降低,蛋白同化活性提高而得到.如南诺龙(Nandrolone)、康力龙(Stanozolol)和丙酸睾丸素(Testosterone Propionate)等,主要用于治疗骨质疏松、血管疾病和发育疾病等[2].
雄甾-4-烯-3,17-二酮简称雄烯二酮(Androstenedione)(4AD),分子式为C19H26O2,是生产甾体激素类药物不可替代的的关键中间体.雄烯二酮的发现最早可追溯至1931年,当时Butenandt在一名男性警察的尿液中发现了雄烯二酮的存在,并将其命名为雄甾酮,随后通过对雄烯二酮的研究,确立了其化学结构及其在机体内的作用.研究表明:4AD在体内,就像是甾体激素类化合物的营养补充剂,可以作为雄激素和雌激素的前体,通过代谢生成雌雄激素来维持机体的正常运转,如人体内对运动性能很重要的睾酮,其含量的二分之一就是通过腺外4AD转化而来.另外,人们发现4AD也具有蛋白同化激素的特性[3].而在体外,通过大量的研究发现,以4AD作为起始原料几乎可以生产所有肾上腺皮质激素、性激素及蛋白同化激素等甾体激素类药物,如用于治疗心血管疾病的坎利酮、普利酮和螺内酯等和用作避孕药的性激素类药物炔诺酮等,都可以通过4AD生产,目前工业上用4AD生产的药物有100余种,4AD已成为生产这些甾体激素类药物的基本原料,并且它的应用领域也在不断的扩大,不仅合成常用的甾体激素类药物,还应用于新药的研发和生产,如用于治疗乳腺癌的抗肿瘤药物福美司坦[4]就是通过对4AD的研究合成出来的新的甾体激素类药物.而且4AD还可以作为类固醇类激素免疫抗原,应用于诱导动物的双胎及多胎生产,对拯救濒危物种起到了十分重要的作用.因此,随着甾体类激素药物生产的不断发展,对4AD的生产及其转化的甾体激素类药物化合物的研究已成为甾体药物研究领域的热门.本文主要综述了近年来微生物法生产4AD及其转化成甾体激素类药物化合物的研究进展.
14AD的生产
1.1化学合成
传统工艺生产4AD的主要方法是从动植物中分离出的类固醇中间体原料合成,这种方式使用的原料主要从薯蓣属植物穿地龙、黄姜、柴黄姜和黄山药等的根茎中提取薯蓣皂素,经化学合成而制成,也有从动植物组织液中直接提取或者由非甾体化合物化学法直接合成,这三种方式不仅成本消耗高,产率也低,而且工艺十分复杂,对环境的污染也很严重.
1.2微生物转化法
微生物转化法产生4AD最早可追溯至上世纪60年代,美国的生物学家Sih等[5]首先发现可以利用微生物放线菌切除饱和甾醇的侧链而得到4AD,4AD再经化学结构修饰可合成几乎所有的甾体激素类药物.这一发现打破了传统方法用薯蓣皂素生产4AD工艺繁杂、产率低、价格贵以及污染大等的种种束缚,为甾体激素类药物的生产提供了新的途径.接着,70年代Marscheck等用诱变方法筛选到分枝杆菌突变株,能有效产生4AD.随后德国先令(Schering AG),日本三菱化成,荷兰Gist,美国Upjohn等许多大的制药公司先后对4AD开发成功,并已应用于生产,使得微生物转化逐步成为生产4AD的关键技术.
1.2.1甾体微生物转化产生4AD的菌株
甾体微生物转化是通过微生物产生一种或一系列的胞内或胞外酶对甾体化合物的分子结构进行修饰和改造的的过程.近些年来,关于微生物转化生产甾体激素类药物方面已被广泛研究.通过微生物转化甾体化合物生产甾体激素类药物关键中间体4AD已成为甾体医药工业普遍的生产技术,几乎替代了传统的化学工艺方法[6].经研究发现:许多微生物如简单节杆菌(Arthrobactersimplex)、芽孢杆菌(Bacillus)、棒状杆菌(Corynebacterium)、诺卡氏菌(Nocardia)、短杆菌(Brevibacterium)、沙雷氏菌(Serrattia)、马红球菌(Rhodococcusequi)、溶脂短杆菌(Brevibacteriumlipolyticum)、新月弯胞霉菌(Curvularialunata)和分枝杆菌(Mycobacterium)等都能够对一些甾体化合物的的侧链进行选择性的生物降解获得关键中间体4AD[7],其中,通过微生物分枝杆菌对甾醇侧链C17位降解、C5,6位双键的氢化以及C3位上的羟基的酮基化是典型的微生物转化生产4AD的例子.Pattana Sripalakit等[8]就成功的通过两株分枝杆菌(Mycobacteriumsp. NRRL B-3683和Mycobacteriumsp. NRRL B-3805)转化谷甾醇(Sitosterol)、豆甾醇(Stigmasterol)、胆固醇(Cholesterol)、麦角甾醇(Ergosterol)4种甾醇制备出4AD.其实早在1944年就有报道分枝杆菌能够利用胆固醇和植物甾醇作为唯一碳源进行生长繁殖,接着美国Sih和日本Arima先后成功的通过微生物转化甾醇获得4AD,随后人们从环境中筛选出很多不同微生物来转化甾体化合物制备4AD.表1详列了生产4AD的微生物及其利用的底物.
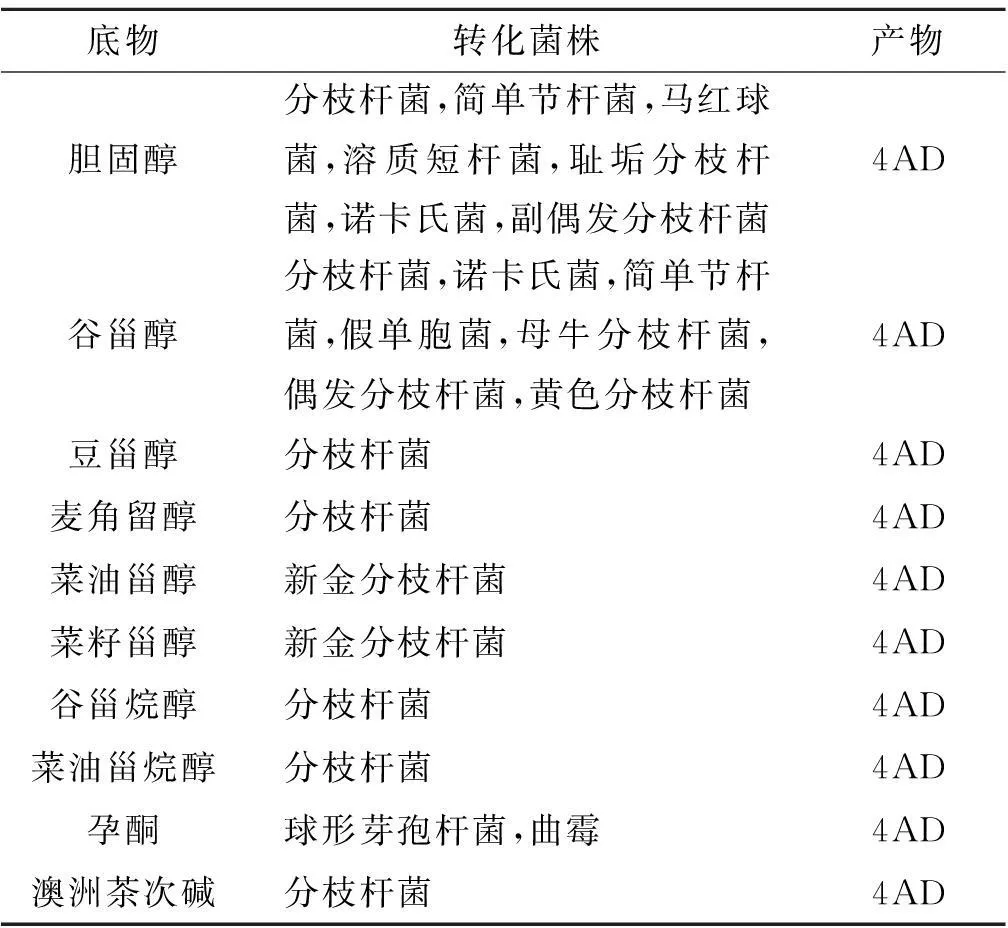
表1 生产4AD的微生物及其利用的底物
1.2.2不同甾醇微生物转化生成4AD
甾醇(Sterol)是广泛存在于自然界中由3个己烷环及一个环戊烷稠合而成的环戊烷多氢菲衍生物,是一类重要的甾体化合物,按其原料来源主要分为植物性甾醇、动物性甾醇和菌类甾醇三大类.植物性甾醇包括谷甾醇、豆甾醇和菜油甾醇等,动物性甾醇以胆固醇为主,而麦角甾醇则属于菌类甾醇.由于自然界中动植物甾醇的来源广泛,可以从大豆、玉米等植物中提取豆甾醇、β-谷甾醇和菜油甾醇等植物甾醇,也可以从猪、牛、鱼等动物的脂肪和油中提取胆固醇等[9],加之这些甾醇价格低廉,所以通过微生物转化廉价的甾醇制备4AD是现在甾体微生物转化制备4AD的重点.
在近期的研究中,Yuchang Liu等[10]从云豹(Neofelisnebulosa)的粪便中分离出一株新的放线菌戈登氏菌(Gordonianeofelifaecis)能够选择性的降解胆固醇(I)生成4AD.Preeti Sharma等[11]报道的从喜马拉雅山脉的西北土壤中分离出的诺卡氏菌(Nocardiasp)也具有将胆固醇(I)转化成4AD的能力,如图1所示.M.J.C. Claudino等[12]采用硅酮固定化分枝杆菌(Mycobacteriumsp. NRRL B-3805)细胞技术对谷甾醇(II)进行生物转化生产出了4AD,并且比自由细胞转化有更好的转化活性和稳定性.随后Filipe Carvalho等[13]用此株菌株在水和有机相的双相体系中转化谷甾醇(II),同样得到了4AD,并具有很好的转化效率,如图1所示.Vrushali Gulla等[14]采用丝裂霉素C和紫外联合处理获得许多突变株,通过对突变株的筛选,发现了一株偶发分枝杆菌能够降解豆甾醇(III)C-17的边链获得4AD,如图1所示.Yanbing Shen等[15]报道了新金分枝杆菌可将菜油甾醇(IV)和菜籽甾醇(V)转化成4AD,他们利用两株新金分枝杆菌通过在转化体系中加入羟丙基-β-环糊精来提高生产4AD和ADD的产率及反应速率.Zhilong Wang等[16]用分枝杆菌通过浊点系统中微生物静息细胞转化也证明了混合植物甾醇中菜油甾醇(IV)能够转化成4AD,如图1所示.Araceli Olivares等[17]报道的文献中指出谷甾烷醇(β-sitostanol)(VI)和菜油甾烷醇(Campestanol)(VII)也可以通过分枝杆菌生成4AD,如图1所示.另外,Weber等报道的麦角甾醇(VIII)通过分枝杆菌转化和Wadhwa等报道的孕酮(IX)通过球形芽孢杆菌转化,同样都可以通过微生物降解得到4AD,如图1所示.大量的研究表明甾醇已成为制备4AD的首选原料,日益受到科学家们的重视,为甾体激素类药物的研发提供了保障和动力.

图1 甾醇微生物转化制备4AD的途径Fig.1 Track of 4AD production from phytosterol by biotransformation
24AD的转化
2.1化学合成
通过对4AD的研究发现,4AD可以合成许多甾体激素类药物.主要是可以通过化学合成出氢化可的松(X),再进一步合成其它高档皮质激素,如图2所示.也可以通过多步反应合成出螺内酯(spironolactone)(XI)等矿质皮质激素,如图2所示.还可以先转化成雄二烯二酮(ADD),再由其生产出雄激素、蛋白同化激素、雌激素等激素类药物,如睾酮(XII)、甲基睾酮(XIII)、甲基雄甾烷醇酮(XIV)、雌二醇(XV)和雌三醇(XVI)等[18],如图2所示.然而通过化学方法把4AD合成甾体激素类药物,不仅化学步骤繁多、工艺条件复杂、副产物多,而且生产成本高、产率低,对环境也有较大的污染,并且一些基团的引入和修饰对化学合成来说是十分困难的.
2.2微生物转化法
作为制备甾体激素类药物的中间体4AD,其甾体母核不同位点的羟基化是生产甾体激素类药物的最重要的反应,其甾体上的羟化除了C-17位上,想通过化学合成的方法在其他位点上引入羟基是相当困难,而且化学合成引入羟基是没有选择性的,无法引入到指定的位点,尤其C-11α位的羟化,人体内的酶都无法将甾体C-11α羟化,而化学方法也只能对某些甾体化合物的C-11α进行羟化,并且至少需要9步以上的化学反应,而对于微生物这却是特有的转化反应,仅需一步就可以在C-11α位上导入羟基,与化学方法相比,微生物转化的这种独特性和方便性解决了化学合成的很多困难,受到人们越来越多的关注[19].
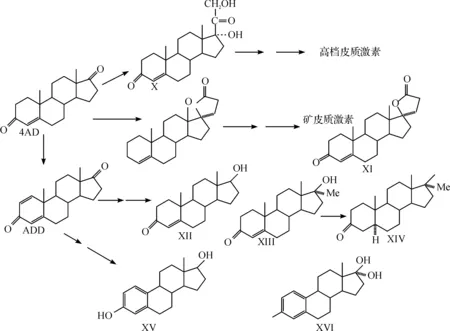
图2 4AD化学合成甾体激素类药物的途径Fig.2 Track of steroid hormone drugs from 4AD by chemosynthesis
2.2.14AD微生物转化产生甾体激素类药物化合物的菌株
4AD的微生物转化是利用微生物代谢产生的的酶对底物4AD的特定部位进行的化学结构修饰的反应,微生物转化4AD具有化学合成没有的区域选择性和立体选择性.研究表明:甾体激素类药物中间体4AD的生物转化主要是羟基化反应,4AD的C-6β、C-9α、C-11α、C-14α、C-15α和C-16α等羟化位点都有活性,都能够通过微生物在这些羟化位点引入羟基,生产出所需的甾体类药物.具有羟基化的微生物主要有根霉(Rhizopus)、曲霉(Aspergillus)和链霉(Streptomyces)等[20],诸多研究表明:许多微生物如黑根霉(Rhizopusnigricans)、白僵菌(Beauveriabassiana)、酿酒酵母菌(Saccharomycescerevisiae)、玫瑰色红球菌(RhodococcusrhodochrousIFO 3338)、枝顶胞霉(AcremoniumstrictumNN 106)、漆斑菌(Mycothectiumtriatisporum)、炭疽病菌(GlomerellacinggulataATCC 10534)、枝顶胞霉(Acremoniumstrictum)、新月弯胞霉(Curvularialunata)和氧化节杆菌(Arthrobacteroxydans)等都能对底物4AD进行生物转化获得结构类似的一系列甾体激素类药物化合物.如利用漆斑菌(Mycothectiumtriatisporum)可以转化4AD为14α-羟基雄甾-4-烯-3,17-二酮的关键中间体,用来制造6β,14α-二羟基-3,6,17-三酮,并发现其具有雄性激素活性并且具有抑制乳腺癌细胞的活性.表2列举了转化4AD的微生物及其转化产物.
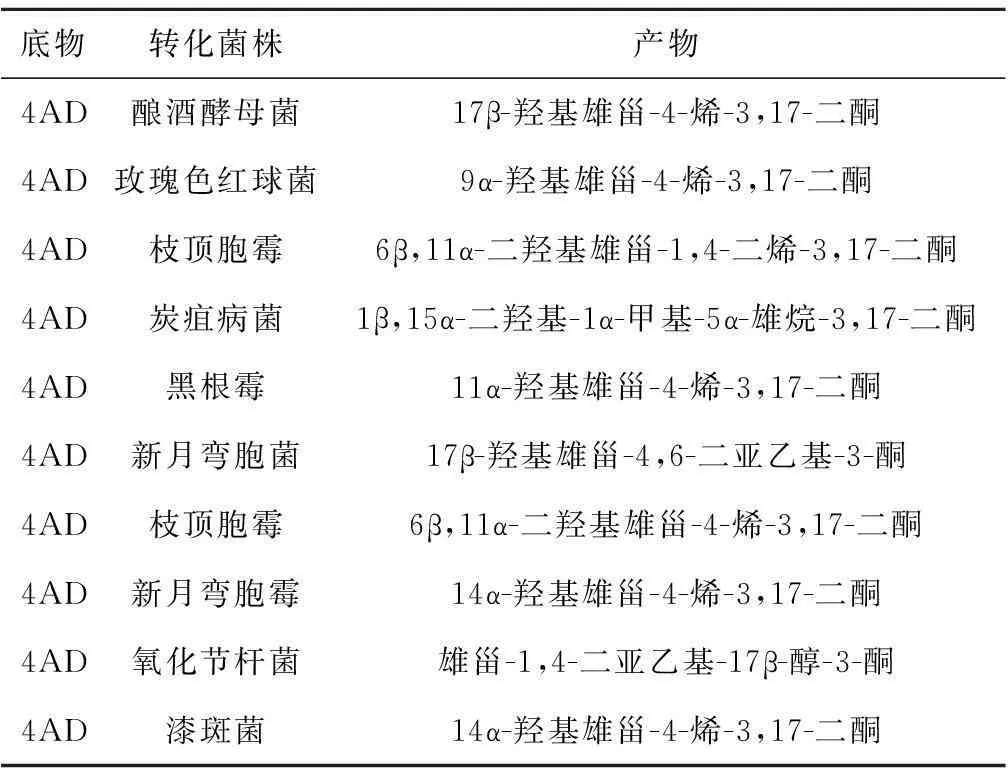
表2 转化4AD的微生物及其转化产物
2.2.24AD微生物转化产生的甾体激素类药物化合物
在微生物对4AD转化的研究中,陈代杰、刘靖和戈梅等科研团队获得了大量的研究成果,如陈代杰[21]、刘靖等通过以4AD为底物进行微生物转化菌株筛选,得到了三株不同活性菌株,分别对4AD进行生物转化,得到了一系列的羟基化甾体化合物:其中通过白僵菌(BeauveriabassianaHCB-00059)转化4AD得到产物6,11-二羟基雄甾烯二酮(XVII)和6-羟基睾酮(XVIII);通过黑根霉(RhizopusstolonifeHCB-00643)转化4AD得到产物6-羰基睾酮(XIX)和6,15-二羟基雄甾烯二酮(XX);通过黑根霉(RhizopusstolonifeHCB-00644)转化4AD得到产物6-羟基雄甾烯二酮(XXI)和14-羟基雄甾烯二酮(XXII),如图3所示.另外陈代杰等还获得了一种未知物,经研究鉴定为20-羟基-23,24-二降胆-4-烯-3-酮(XXIII),是胆固醇侧链切除过程中一中间产物甾醇C22-羧酸的类似物,如图3所示.这一些列甾体化合物充分的说明了4AD的各个羟化位点都有活性,都能通过微生物进行羟基化.戈梅等[22]利用一株白僵菌对4AD进行生物转化获得:6,11-羟基雄甾二烯二酮(XXIV)、11-羟基-18-氧杂D扩环雄甾烯二酮(XXV)、6,11-羟基睾酮(XXVI)和11-羟基睾酮(XXVII)4种产物.这也充分的证明4AD甾体母核上C-11位特有的微生物转化活性,而白僵菌具有产生11α-羟化酶的能力.魏琦等采用4AD转化成目标产物11α-羟基-4-雄甾烯3,17-二酮(XXVIII)筛选出一株白僵菌(BeauveriabassianaMEL15),进一步证明了白僵菌对4AD的C-11α位的羟化能力.此外,Olga V. Egorova等[23]报道中指出4AD可以通过分枝杆菌生成的9α-羟基酶转化成9α-羟基雄甾-4-烯-3,17-二酮(XXIX),如图3所示.还有葛枳江等[24]报道的黑曲霉(AspergillusnigerTCCC41650)可以将4AD转化成16β-羟基-4-雄甾烯-3,17-二酮(XXX),如图3所示.另外,报道的4AD微生物羟化产物还有:6β,14α-二羟基雄甾-4-烯-3,17-二酮[25]、14α-羟基雄甾-4,6-双烯-3-酮[26]和17β-羟基雄甾-4-烯-3-酮[27]等.
除了生物转化能使4AD发生羟化反应外,往往还会发生一些像脱氢反应、羰基化反应、氢化反应、脱氢反应和氧化反应等非羟基化的反应.如Wenqing Zhang等[28]报道的通过对菌株进行基因改造获得了一株新金分枝杆菌,它能够产生3-甾酮-△1-脱氢酶(3-ketosteroid-△1-dehydrogenase)(KSDD)对4AD进行生物转化脱氧反应获得药物中间体雄二烯二酮(ADD)(XXXI),如图4所示.Hongliu Zhang等[29]报道的利用青霉菌对4AD转化,发生了氧化反应,生成了1,2-二氢睾内酯(XXXII),如图4所示.由此可见,通过微生物转化4AD可以获得许多化学方法难以合成的甾体药物化合物,通过微生物对一些指定基团的引入和修饰是化学合成无法取代的,像用于制备高血压和心力衰竭等疾病特效药的11α-羟基雄甾-4-烯-3,17-二酮和用于合成高效抗炎活性药物的9α-羟基雄甾-4-烯-3,17-二酮等,都是微生物转化所特有的反应,而对于化学合成却比较困难.因此,通过微生物转化4AD制备甾体激素类药物具有广阔的应用价值.
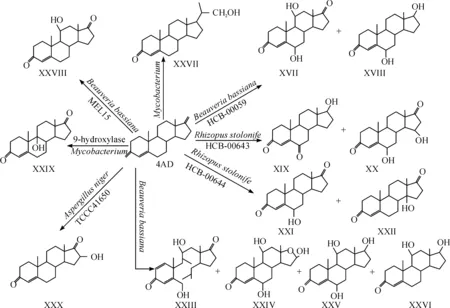
图3 4AD微生物转化生成羟化产物的途径Fig.3 Track of hydroxylated production from 4AD by biotransformation
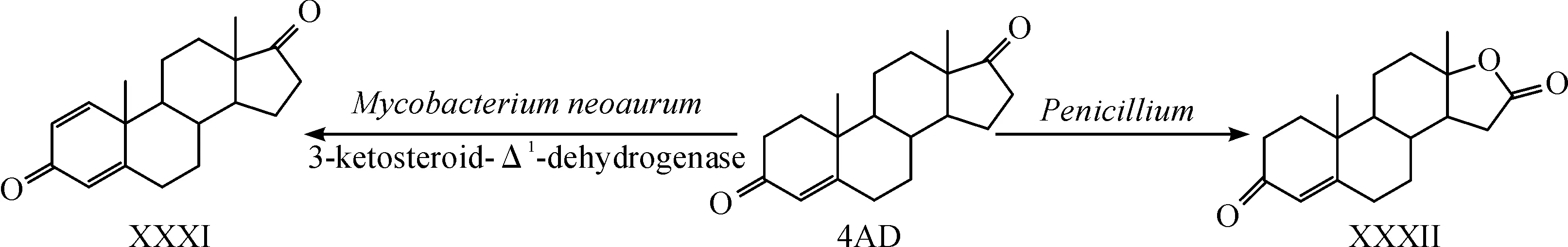
图4 4AD生物微转化生成非羟化产物的途径Fig.4 Track of non-hydroxylated production from 4AD by biotransformation
3结论
甾体微生物转化与化学合成相比,有着原料来源丰富,生产成本低,生产工艺简单,产率高和对环境污染小等诸多优点,已被广泛应用于甾体类药物及其关键中间体的生产,成为医药领域中重要的一部分,而雄烯二酮(4AD)是生产甾体激素类药物的关键中间体,对其生物转化的来源和去处的研究有着重要意义,通过对由不同的底物利用不同的微生物生产4AD,再到不同的微生物转化4AD生产不同的甾体产物的研究,推动着甾体激素类药物的发展,目前,甾体生物转化的微生物主要来源于陆地,还可以通过海洋微生物的筛选,获得更多的生产或转化4AD的工艺途径,来扩大甾体微生物转化的领域,为制药行业带来更多的贡献.
参考文献:
[1]TONG W Y, DONG X. Microbial biotransformation recent developments on steroid drugs[J]. Recent Patents on Biotechnology,2009,3(2):141-153.
[2]张小燕.新金分枝杆菌ZJUVN-08转化植物甾醇合成雄甾烯二酮的研究[D].杭州:浙江大学,2013.
[3]MELINDA K S, DENNIS J C, DAVID L B, et al. Screening indicators of dehydroepiandosterone, androstenedione, and dihydrotestosterone use: a literature review[J]. Journal of Analytical Toxicology,2011,35:638-655.
[4]GLENROY D A M, JAVIER N, ANNE M. Synthesis and bioconversions of formestane[J]. Journal of Natural Products,2013,76:1966-1969.
[5]SIH C J, WANG R C. A new route to estrone from sterols[J].Journal of American Chemical Society,1965,87:1387-1388.
[6]ZHANG Xiaoyan, PENG Yong, SU Zhongrui, et al. Optimization of biotransformation from phytosterol to androstenedione by a mutant Mycobacterium neoaurum ZJUVN-08[J]. Journal of Zhejiang University SCIENCE B,2013,14(2):132-143.
[7]MALAVIYA A, GOMES J. Androstenedione production by biotransformation of phytosterols[J]. Bioresource Technology,2008,99(15):6725-6737.
[8]SRIPALAKIT P, WICHAI U, SARAPHANCHOTIWITTHAYA A. Biotransformation of various natural sterols to androstenones by Mycobacterium sp. and some steroid-converting microbial strains[J]. Journal of Molecular Catalysis B: Enzymatic,2006,41(1):49-54.
[9]张志旭,昌超,刘东波.天然植物甾醇的来源,功效及提取研究进展[J].食品与机械,2014(5):288-293.
[10]LIU Yuchang, CHEN Guiying, GE Fanglan, et al. Efficient biotransformation of cholesterol to androsta-1,4-diene-3,17-dione by a newly isolated actinomycete gordonia neofelifaecis[J]. World Journal of Microbiology and Biotechnology,2011,27(4):759-765.
[11]SHARMA P, SLATHIA P S, SOMAL P, et al. Biotransformation of cholesterol to 1, 4-androstadiene- 3, 17-dione (ADD) by Nocardia species[J]. Annals of Microbiology,2012,62(4):1651-1659.
[12]CLAUDINO M J C, SOARES D, VAN KEULEN F, et al. Immobilization of mycobacterial cells onto silicone-assessing the feasibility of the immobilized biocatalyst in the production of androstenedione from sitosterol[J]. Bioresource Technology,2008,99(7):2304-2311.
[13]CARVALHO F, MARQUES M P C, CARVALHO C C C R, et al. Sitosterol bioconversion with resting cells in liquid polymer based systems[J]. Bioresource Technology,2009,100(17):4050-4053.
[14]GULLA V, BANERJEE T, PATIL S. Bioconversion of soysterols to androstenedione by Mycobacterium fortuitum subsp. fortuitum NCIM 5239, a mutant derived from total sterol degrader strain[J]. Journal of Chemical Technology and Biotechnology,2010,85(8):1135-1141.
[15]SHEN Yanbing, WANG Min, LI Huanan, et al. Influence of hydroxypropyl-β-cyclodextrin on phytosterol biotransformation by different strains of Mycobacterium neoaurum[J]. Journal of Industrial Microbiology & Biotechnology,2012,39(9):1253-1259.
[16]WANG Zhilong, ZHAO Fengsheng, CHEN Daijie, et al. Biotransformation of phytosterol to produce androsta-diene-dione by resting cells of Mycobacterium in cloud point system[J]. Process Biochemistry,2006,41(3):557-561.
[17]OLIVARES A, ACEVEDO F. Effect of inoculation strategies, substrate to biomass ratio and nitrogen sources on the bioconversion of wood sterols by Mycobacterium sp[J]. World Journal of Microbiology and Biotechnology,2011,27(11):2513-2520.
[18]刘靖.微生物转化甾体药物关键中间体4AD的研究[D].福州:福州大学,2004.
[19]郭一平,郑璞.甾体微生物C11T-羟化反应的研究进展[J].浙江工业大学学报,2004,32(4):437-441.
[20]DONOVA M V,EGOROVA O V. Microbial steroid transformations: current state and prospects[J]. Applied Microbiology and Biotechnology,2012,94(6):1423-1447.
[21]陈代杰,朱宝泉.微生物转化技术在现代医药工业中的应用[J].中国抗生素杂志,2006,31(2):112-118.
[22]戈梅,刘靖,陈代杰.一株白僵菌对雄甾烯二酮转化产物的研究[J].中国抗生素杂志,2006,31(3):176-177.
[23]EGOROVA O V, NIKOLAYEVA V M, SUKHODOLSKAYA G V, et al. Transformation of C 19-steroids and testosterone production by sterol-transforming strains of Mycobacterium spp[J]. Journal of Molecular Catalysis B: Enzymatic,2009,57(1):198-203.
[24]葛枳江,毛淑红,李宴清,等.黑曲霉催化雄甾-4-烯-3,17-二酮16β-羟基化[J].生物工程学报,2014,9:1481-1485.
[25]SCHAAF O, DETTNER K. Transformation of steroids by Bacillus strains isolated from the foregut of water beetles (Coleoptera: Dytiscidae): I. Metabolism of androst-4-en-3, 17- dione(AD)[J].Journal of Steroid Biochemistry and Molecular Biology,1998,67(5):451-465.
[26]TOMASZ J, JADWIGA D G, EDYTA K S, et al. Biotransformations of steroid compounds by Chaetomium sp. KCH 6651[J]. Steroids,2009,74(8):657-661.
[27]FARAMARZI M A, BADIEE M, YAZDI M T, et al. Formation of hydroxysteroid derivatives from androst-4-en-3, 17-dione by the filamentous fungus Mucor racemosus[J]. Journal of Microbiology and Biotechnology,2008,50(1):7-12.
[28]ZHANG Wenqing, SHAO Minglong, RAO Zhiming, et al. Bioconversion of 4-androstene-3, 17-dione to androst-1, 4-diene-3, 17-dione by recombinant Bacillus subtilis expressing ksdd gene encoding 3-ketosteroid-Δ 1-dehydrogenase from Mycobacterium neoaurum JC-12[J]. The Journal of Steroid Biochemistry and Molecular Biology,2013,135:36-42.
[29]ZHANG Hongliu, REN Jie, WANG Yu, et al. Effective multi-step functional biotransfor- mations of steroids by a newly isolated fusarium oxysporum SC1301[J]. Tetrahedron,2013,69(1):184-189.
(责任编辑:陈石平)
文章编号:1006-4303(2015)06-0611-07
中图分类号:Q815
文献标志码:A
作者简介:王鸿(1972—),女,黑龙江齐齐哈尔人,教授,博士生导师,研究方向为药学,E-mail: hongw@zjut.edu.cn.
基金项目:国家自然科学基金资助项目(30973681)
收稿日期:2015-03-23