急性缺血性卒中静脉应用阿替普酶纳入及排除标准的科学声明(第九部分)美国心脏协会/美国卒中协会致医疗卫生专业人员的声明
译者及校译者:沈东超,王子璇,肖伏龙,张玮艺,张潇潇,张宁,王春雪
(接上期)
27 大面积梗死的ASPECTS评分及三分之一准则
FDA指南中已将大面积梗死的早期CT征象移除(如皮层下水肿,占位效应,中线移位)。之前的FDA指南提出对于这部分患者,应用阿替普酶治疗后不良事件风险会增加。在2013版AHA/ASA指南中,如果患者出现缺血的CT征象,可以使用阿替普酶治疗,而不用考虑缺血病灶的大小,但同时如果出现CT上低密度病灶,应用阿替普酶治疗后可能增加出血风险。如果CT低密度病灶超过大脑中动脉供血区的1/3,则阿替普酶治疗为禁忌。
最有挑战性的一项排除标准为在没有CT对比增强的情况下,判定缺血的早期CT征象。没有CT对比增强的情况下,缺血的早期CT征象表现为脑实质的对比度下降(灰白质对比度下降,或与其他组织相比,病灶组织的密度相对降低)或局灶性水肿、占位效应(如由于缺血区脑组织肿胀导致邻近脑脊液或脑室受压)。而肿胀的脑组织则代表恢复血供的缺血半暗带组织。缺血的早期CT征象则代表X线的低衰减区,与脑组织的水摄取量呈负性相关,并可能是缺血性脑组织不可逆损伤的一个指征。目前关于X线低衰减区评价脑组织不可逆缺血性损伤还存在争议。ECASSⅠ研究首先提出缺血的早期CT征象以及超过大脑中动脉供血1/3的准则。ECASSⅠ的析因分析显示表现出缺血早期CT征象的脑组织是应用阿替普酶治疗的重要预测指标。对于表现出小面积的X线低衰减区(小于大脑中动脉供血区的1/3),阿替普酶治疗可使患者获益(OR3.43,95%CI1.61~7.33)。对于未表现出缺血早期CT征象或X线低衰减区的患者(包括病灶大于大脑中动脉供血区1/3),阿替普酶治疗后获益无显著性(OR0.41,95%CI0.06~2.7)。ECASSⅠ及ECASSⅡ研究中,如果表现为缺血早期CT征象的脑组织区域大于大脑中动脉供血区的1/3,则阿替普酶治疗后颅内自发出血风险增加。在不考虑治疗目标的情况下,尽管表现为缺血早期CT征象的脑组织区域大于大脑中动脉供血区的1/3是预后不良的一个指标,ECASSⅡ研究也并未提供这些患者治疗后的证据。目前缺乏证据支持对于表现为缺血早期CT征象的脑组织区域大于大脑中动脉供血区1/3的患者阿替普酶治疗效果不明显。但对于这部分患者,由于临床上阿替普酶应用的限制,因此无法得出具体结果。
在NINDS研究中,CT被用来排除阿替普酶治疗前颅内出血。在此项研究中,缺血早期CT征象的脑组织区域大小并不影响患者的入组及选择性。而缺血早期CT征象的标准为水肿及占位效应。在所有参加研究的人群中,总共有5.2%患者表现此影像学征象。尽管这种影像学征象可能增加溶栓治疗后颅内自发出血风险,但研究中并未涉及治疗方案的改变。一项更为详细的NINDS研究的回顾性分析发现,31%患者表现出缺血早期CT征象,系由于缺血早期CT征象的判定标准发生了变化。即便部分患者表现为缺血早期CT征象的脑组织区域大于大脑中动脉供血区1/3,但并未发现缺血早期CT征象与治疗方案之间的交互作用。
Alberta早期CT评分(Alberta Stroke Program Early CT Score,ACPECTS)可以在没有CT增强扫描的情况下提供系统性、非定量的描述缺血早期脑组织情况。在这个评分系统中,基于功能的不同,将大脑中动脉供血区划分为10个区域,小的脑组织结构(如内囊、基底节、尾状核)及大的皮层结构权重相同。在此评分系统中,缺血早期CT征象仅定义为脑实质X线低衰减。
NINDS的析因分析结果显示,在没有CT增强的情况下,将ASPECTS评分二分类分为>7分及≤7分,评分并不影响治疗方案。但ASPECTS得分越高(>7分),死亡率越低。与安慰剂组相比,阿替普酶治疗组平均梗死体积是前者的一半(7.8 cm3vs15.2 cm3)。对于ASPECTS评分0~2分伴有缺血早期CT征象的患者,平均梗死体积较大,均超200 cm3。但在NINDS2研究中,这类患者仅占2.6%(608例患者中的16例),因此限制了临床关联性。
目前报道的文献中,并未发现在允许的时间窗内,直接因患者出现缺血早期CT征象而排除阿替普酶治疗。而大脑中动脉供血区1/3准则及ASPECTS评分均未显示出与阿替普酶有明显交互作用,两组影像学标准也并未显示出可以判定患者的预后。对于发病6 h内的急性卒中患者,通过基线的非增强CT判定的缺血早期征象并不是阿替普酶治疗的严格指征。RCT研究或者未按照缺血早期CT入组患者(如ASPECTS评分0~2)或者将此项指征排除在入组标准之外(如ECASSⅢ研究);因此关于缺血早期CT在判定阿替普酶治疗的安全性和有效性方面缺乏足够的证据。
27.1 缺血早期CT征象在溶栓治疗中的意义
①表现为轻中度的缺血早期CT征象的患者可以接受阿替普酶治疗(Ⅰ级推荐;A级证据)。②目前缺乏通过CT低衰减区的严重程度及大小判定是否合适进行阿替普酶治疗的证据。但对于CT表现为大面积明显的低衰减区患者不推荐接受阿替普酶治疗。无论是否进行溶栓治疗,这部分患者预后均不理想,严重的低衰减区定义为CT上明显的低密度影,提示不可逆的缺血性损伤(Ⅲ级推荐;A级证据)。
28 糖尿病出血性视网膜病变或其他眼科疾病
尽管报道较少,眼底出血是阿替普酶治疗的并发症之一。特别是对于伴有糖尿病及糖尿病性眼底病变的患者,阿替普酶治疗后出血风险增加。尽管目前缺乏足够的证据预测风险,但糖尿病性视网膜病变仍作为阿替普酶治疗的禁忌证或警告指征。
在FDA关于阿替普酶治疗的出血风险中,糖尿病性视网膜病变及其他出血性眼部病变均被列入警告指征中,治疗后可能获得与预期获益相反的结果。
最新的AHA/ASA关于缺血性卒中的指南及美国心脏病学会(American College of Cardiology,ACC)/AHA关于急性心肌梗死的指南中均未将糖尿病出血性视网膜病变或其他出血性眼部病变列为阿替普酶的绝对或相对禁忌证。
由于潜在的眼底出血,曾经将糖尿病出血性视网膜病变列为急性心肌梗死患者阿替普酶治疗的禁忌证。但目前缺乏足够的证据支持糖尿病视网膜病变患者溶栓治疗后出血风险升高。ACC/AHA 1990版急性心肌梗死指南中,仅有2例患者溶栓治疗后出现眼内出血,其中一例患者伴有糖尿病。
目前仅有3项相关研究发表。Chorich等报道了3例急性心肌梗死患者应用阿替普酶或链激酶治疗后出现眼部出血及眼部并发症。研究为涉及少数样本的回顾性研究。在3例眼部出血中,1例为脉络膜自发性出血,2例为白内障术后及外直肌切除术后眼球周围眼睑出血。眼部手术或降低眼内压力,或减轻视神经卡压。在3例眼部出血病例中,2例在随后的2~8周随访中出现视觉丧失。Barsam等报道了1例86岁患有糖尿病的急性心肌梗死患者接受阿替普酶治疗后出现脉络膜自发性出血。Khawly等报道了1例67岁心肌梗死心搏骤停抢救后恢复的男性患者,应用阿替普酶治疗4 d后出现出血性脉络膜剥离。后针对眼部出血给予处理,眼科检查并未发现脉络膜其他性质的病变。
为了更好地定义有无糖尿病接受阿替普酶治疗的心肌梗死患者溶栓治疗后眼部出血部位及发生率,Mahaffey等分析了“全球链激酶及阿替普酶应用治疗冠状动脉阻塞”(Global Utilization of Streptokinase and Alteplase for Occluded Coronary Arteries,GUSTO)-Ⅰ期研究患者眼部出血的情况。该研究中报道的溶栓治疗后眼部出血均为确定的,该研究中的溶栓治疗方案为静脉使用链激酶或阿替普酶,或采用逐渐加量方式(首次静脉注射15 mg,继以0.75 mg/kg 30 min,再换用0.5 mg/kg 60 min),或采用静脉输注方式,1 mg/kg 60 min,此外溶栓治疗还配合肝素及阿司匹林治疗。研究中共有40 899例患者患有糖尿病及眼部出血。12例患者(0.03%)患有持续性眼部出血,其中1例为持续性眼球出血(视网膜下,跌倒后出现),其余的为眼球外出血(4例为眼球周围,7例为结膜周围)。在整个研究人群中,6011例患者(15%)有糖尿病史。对于有糖尿病和无糖尿病的患者,两组之间眼部出血比例无明显差异。糖尿病患者眼球内出血风险的95%CI上限为0.05%,无糖尿病患者为0.006%。Mahaffey等认为心肌梗死溶栓治疗后眼球出血及眼球内出血并不是常见的并发症,糖尿病视网膜病变也不应作为溶栓治疗的禁忌证。
糖尿病视网膜病变为增生性或非增生性。在增生性糖尿病视网膜病变中,可观察到新生血管但无出血倾向。在非增生性糖尿病视网膜病变中,可观察到视网膜微动脉瘤及视网膜点状出血。对于患有糖尿病视网膜病变的患者,玻璃体积血可能与玻璃体后剥离有关,而玻璃体剥离产生的牵拉力可导致周围血管的损害。溶栓治疗可能增加自发剥离的风险,类似情况还可能会出现在外伤损害破坏眼组织局部结构的完整性,累及微血管。
对于急性卒中患者,快速诊断是否伴有视网膜病变比较困难。患者可能不能配合完成眼底检查,因为卒中患者可能伴有意识障碍或失语。尽管部分患者先前可能进行过一些眼科检查,但在快速决策卒中是否需要溶栓治疗时先前的诊断结果可能不能及时得到。如果没有训练有素的医师进行完全的眼底检查(包括散瞳),糖尿病视网膜病变可能会漏诊。
而关于卒中或心肌梗死溶栓治疗后眼球内出血给眼部造成的结局,目前仍不十分清楚。
然而,尽管阿替普酶治疗后可导致眼部出血,但玻璃体内或视网膜下注射阿替普酶,结合玻璃体切割术,可有效提高黄斑出血后的视力。
Ahmad等报道1例急性缺血性卒中的70岁男性患者,由于玻璃体积血,不能接受阿替普酶治疗,此种眼部出血为阿替普酶治疗的相对禁忌证,此病例的报道引起了相当的反响和讨论。Sethi等提出了一个敏感的问题“你是拯救患者的眼还是脑?”Moudgil等指出主要治疗脑梗死优先于防治玻璃体积血的进一步恶化;这种抉择需要综合患者、家属及医师的意见;此外,陈旧性玻璃体积血再出血的风险很小,而业已存在的视网膜病变可能会导致视觉减退。此外,作者指出,为了降低玻璃体再出血的风险,可使用动脉内溶栓及机械取栓的方法。
28.1 结论
急性卒中及心肌梗死溶栓治疗后眼部出血及眼球内出血的发生率较低。糖尿病患者此项风险的发生率为0(95%CI0~0.05),非糖尿病患者此项风险的发生率为0.003%(95%CI0~0.006)。对于糖尿病患者溶栓治疗后眼球内出血风险的95%CI上限值为0.05%,与急性卒中溶栓治疗的获益呈鲜明对比。对于急性缺血性卒中患者,糖尿病视网膜病变并不是阿替普酶治疗的绝对禁忌证。
28.2 糖尿病出血性视网膜病变或其他出血性眼部病变的卒中患者的治疗建议
①对于伴有糖尿病出血性视网膜病变或其他出血性眼部病变的急性卒中患者可以推荐进行阿替普酶治疗,但必须考虑溶栓治疗的获益以及视网膜出血带来的风险(Ⅱa级推荐;B级证据)。
29 对早期可疑蛛网膜下腔出血患者的评估
早期FDA的指南指出,对于可疑蛛网膜下腔出血的患者,禁忌使用阿替普酶治疗;同样2013版AHA/ASA指南中也将蛛网膜下腔出血列为阿替普酶治疗的排除标准。新的FDA指南中将蛛网膜下腔出血列为阿替普酶治疗的排除标准,且不用考虑临床医师的选择或临床表现。
临床上,怀疑蛛网膜下腔出血往往病史上首先有雷击样头痛,腰椎穿刺时脑脊液可有黄变。CT证实的蛛网膜下腔出血为溶栓治疗的绝对禁忌证。蛛网膜下腔出血提示患者存在动脉瘤可能性大。
Sheth等回顾性分析发现急性卒中患者同时伴有无症状性动脉瘤的比例很高。在此研究中,5%患者伴有动脉瘤,在应用阿替普酶治疗后颅内出血风险并未提高。上述对阿替普酶治疗及颅内无症状性未破裂动脉瘤的讨论已经很详尽。与Sheth等回顾的相比,已经破裂的动脉瘤则表现出明显的结构不稳定性。此外,腰椎穿刺在阿替普酶治疗中潜在的价值也应该肯定。对于表现为雷击样头痛而CT检查阴性的患者,需要进一步行腰椎穿刺排除蛛网膜下腔出血的可能,此外,后续还要进行非侵袭性的血管造影检查头颅[计算机断层扫描血管成像(computed tomography angiography,CTA)或MRA]及MRI检查。临床上表现为卒中症状的患者,但同时伴有雷击样头痛时,就诊流程应进行相应的调整,如果患者头颅CT平扫阴性,则应进一步进行头CTA或MRA检查,而并不是立即进行腰椎穿刺检查。
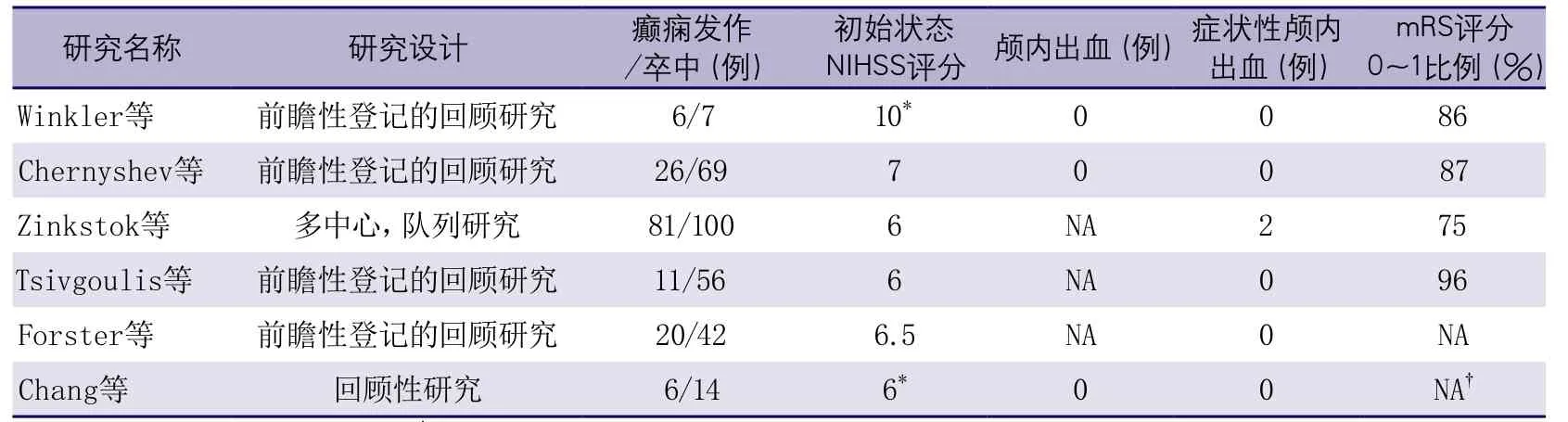
表16 以癫痫发作起病的大于5例的卒中接受阿替普酶治疗患者的统计
考虑到其他潜在血管损伤的可能性,包括硬脑膜动静脉瘘、动脉夹层、脑静脉血栓形成、可逆性脑血管收缩综合征,血管影像学检查如CTA或MRA对于决定是否应用阿替普酶治疗非常必要。在缺乏血管影像学检查的情况下,没有证据支持溶栓是否会增加颅内出血风险。因此,阿替普酶治疗在这种情况下看似合理。血管影像学检查可以更进一步检查出卒中病因及颅内其他潜在不确定因素。临床医师在没有得到确切的血管影像学检查的情况下,应综合考虑,权衡潜在的蛛网膜下腔出血风险及溶栓获益。
29.1 可疑蛛网膜下腔出血的卒中患者的治疗建议
对于临床表现及辅助检查证据支持蛛网膜下腔出血的患者,阿替普酶治疗为禁忌证(Ⅲ级推荐;C级证据)。
30 根据ECASS Ⅲ试验检查患者是否存在扩大时间窗的排除标准
FDA的说明强调应在卒中症状出现后3 h内启动静脉阿替普酶治疗,而2013年AHA/ASA指南则提出在3~4.5 h也可应用。AHA/ASA发布的一项科学建议声明,推荐对于符合ECASS Ⅲ试验合格标准的患者,可将其静脉应用阿替普酶的时间窗扩大至3~4.5 h。在0~3 h静脉阿替普酶溶栓的排除标准外,3~4.5 h时间窗溶栓的排除标准还包括:年龄>80岁,使用任何OAC(无论初始INR),初始NIHSS评分>25分,CT显示低密度区域超过1/3的MCA供血区,此前有卒中和糖尿病病史。尽管在美国,FDA尚未批准阿替普酶的超时间窗应用,但其已在临床广泛应用。在辛辛那提的一项研究中,66例不符合3~4.5 h时间窗溶栓标准的患者原因分别如下:15例年龄>80岁,3例卒中和糖尿病病史,2例使用OAC,2例NIHSS评分>25分。总体上,仅有3.4%的急性卒中患者在延长的时间窗内到达救治中心,仅有0.5%的患者能够达到更为严格的3~4.5 h静脉使用阿替普酶的标准;有0.7%的患者可以达到更为灵活的0~3 h溶栓的入组标准。多项研究已经报道了阿替普酶在0~3 h时间窗内非适应证使用的安全性和有效性,但报道3~4.5 h时间窗内溶栓治疗安全性的研究相对很少。
30.1 年龄
此前的研究对不同年龄组使用阿替普酶的安全性进行了探索。前文已经提到了0~3 h时间窗内溶栓的年龄标准。在EPITHET和IST-3研究的汇总分析中,970例年龄>80岁的受试者在3~6 h时间窗内被随机分配至应用阿替普酶组或安慰剂组。与年龄≤80岁的患者相比,阿替普酶组和安慰剂组在3个月时获得良好的结局的可能性并不因年龄而有所差异;然而,阿替普酶组获得良好结局的OR值与安慰剂组对比差异无显著性(OR0.97,95%CI0.97~1.30),并且其获益远小于0~3 h时间窗内接受治疗的患者。但该研究并未给出3~4.5 h时间窗内各年龄组结局的相关数据。仅有两项其他研究对年龄>80岁患者在3~4.5 h时间窗接受治疗进行了评价。在GWTGStroke数据库中,1008例年龄>80岁的受试者在延长的时间窗内接受了静脉阿替普酶治疗,sICH的发生率为8%(年龄>80岁的受试者在<3 h时间窗内sICH的发生率为6.7%;P=0.11),19.5%的患者在出院时可自行走动(<3 h时间窗组为17.7%;P=0.08),21.2%的患者出院后回家(<3 h时间窗组为20.3%;P=0.41)。一项更小的研究比较了不同年龄分层的超时间窗静脉应用阿替普酶治疗的结局,31例年龄>80岁的患者中有2例(6.5%)发生了sICH,而160例年龄<80岁的患者中有6例(4.4%)发生sICH(P=0.64)。上述结果并不令人惊讶,但年龄>80岁组的患者院内死亡率更高(16.1%vs3.8%;P=0.02)。一项研究探索了除去特定阿替普酶溶栓治疗排除标准后的影响,发现若移除3~4.5 h时间窗的治疗年龄上限后,符合标准的患者比例将由26%上升至29%。
30.2 NIHSS评分
有关NIHSS评分>25分的患者接受超时间窗治疗的数据非常有限。在GTWG-Stroke分析中,179例符合这一排除标准的患者接受了阿替普酶治疗,其中8.4%发生了sICH(<3 h时间窗组为10.0%;P=0.50),7.8%可以自行走动(<3 h时间窗组为10.0%;P=0.05),11.7%出院后回家(<3 h时间窗组为11.5%;P=0.05)。
30.3 使用华法林
在SITS-ISTR和GWTG-Stroke研究中,与阿替普酶相比,华法林于治疗与sICH或不良结局的风险增加并无相关性。但研究并未单独报告基线时使用华法林的患者在3~4.5 h时间窗接受治疗的sICH风险。然而,在一项GWTG-Stroke的后续研究中,282例基线时口服应用OAC且INR<1.7的患者在3~4.5 h时间窗内接受了阿替普酶治疗。该组与<3 h时间窗组的症状性脑出血发生率分别为5.7%与6.8%(P=0.49),出院时可自行走动的比率分别为26.6%和24.7%(P=0.53),出院时回家的比率分别为30.5%和26.4%(P=0.38)。在Cronnin等的一项小型研究中,使用华法林组的11例患者中有2例发生sICH(18.2%),而未使用华法林组为3.9%(P=0.09),但两组的死亡率相近(P=0.49)。
30.4 卒中和糖尿病病史
由于前文中并未提及,且此为阿替普酶在欧洲于0~3 h和3~4.5 h时间窗使用的一项禁忌证,因此伴有卒中病史和糖尿病的卒中患者静脉使用阿替普酶治疗的风险值得进行探讨。既往有卒中病史和糖尿病是阿替普酶治疗后结局不良的强力预测因素。一些研究还提到了这些患者对溶栓治疗反应较差,需联合使用抗栓治疗,且有更高的卒中复发和并发症发生风险。考虑到这些原因,ECASS Ⅲ试验排除了同时存在这两种疾病的患者。在此之后,有多项登记分析为这一亚组患者静脉应用阿替普酶的安全性和有效性提供了更多的证据。然而,尚无安慰剂对照数据的存在。
在Helsinki卒中登记的1104例进行溶栓的卒中患者中,有26例患者存在卒中病史和糖尿病。在多元分析中,同时有卒中病史及糖尿病与发病后3个月时mRS得分>2分或sICH并无相关性。一项Madrid的多中心登记纳入了24例此前有卒中病史和糖尿病的患者,该研究也未发现合并两种疾病对应用阿替普酶后的sICH或结局不良风险有所影响。在SITS-EAST分析中,接受超欧洲许可治疗的患者中有216例此前有卒中病史和糖尿病。在多元分析中,合并两种疾病并不是sICH、结局不良或死亡的预测指标。在VISTA中,无糖尿病和既往卒中病史的患者,其结局显著优于合并两种疾病的患者。然而,在合并糖尿病与既往卒中病史的患者中,溶栓患者(86例)较未溶栓患者(405例)有获得良好结局的趋势(OR1.5,95%CI0.98~2.3)。一项更大的研究比较了SITS-ISTR登记中接受了静脉阿替普酶的患者与VISTA中的未溶栓患者。在这29 500例患者中,1141例(5.5%)患者同时存在糖尿病和卒中病史。在这一亚组中,通过有序分析得出溶栓患者相较未溶栓患者有更低的mRS得分(OR1.23,95%CI1.00~1.52,P=0.05)。既往有卒中病史/糖尿病与静脉阿替普酶治疗和发病后3个月时的预后并无交互作用。VISTA的一项更新分析对672例(106例接受了阿替普酶治疗,566例对照者)合并卒中和糖尿病的患者进行了有序变化分析,经校正年龄和基线时的NIHSS评分后发现,使用阿替普酶与3个月时获得良好结局的可能性增加相关联(OR1.5,95%CI1.03~2.18)。
但遗憾的是,这些数据并未给出3~4.5 h时间窗内接受治疗患者的具体风险。在GWTGStroke登记中,335例伴有既往卒中病史和糖尿病的患者于3~4.5 h时间窗内静脉使用了阿替普酶,6.9%发生了sICH(<3 h时间窗组为4.6%;P=0.08),34.9%出院时可自行走动(<3 h时间窗组为30.8%;P=0.07),40.3%出院后回家(<3 h时间窗组为36.9%;P=0.30)。在单中心研究中,14例合并卒中与糖尿病的患者中有1例(7.1%)发生了sICH,而未合并两种疾病的患者中有8例(4.5%)(P=0.50)。从这些数据中我们可以看出,似乎没有必要排除合并卒中病史和糖尿病的患者进行静脉阿替普酶治疗,特别是在0~3 h时间窗内。这有很多已发表的数据支持,但对于延长的3~4.5 h时间窗内上述类型患者的治疗,仍需要更多的数据。
30.5 扩大的3~4.5h时间窗建议
①推荐对经仔细选择的符合ECASS Ⅲ试标准并在3~4.5 h时间窗内的患者进行静脉阿替普酶治疗(Ⅰ级推荐;B级证据)。②对于3~4.5 h时间窗内到达的年龄>80岁的患者,静脉阿替普酶治疗是安全的,并与更为年轻的患者一样有效(Ⅱa级推荐;B级证据)。③对于3~4.5 h时间窗内到达的使用华法林且INR<1.7的患者,静脉阿替普酶治疗似乎是安全的,可能是有益的(Ⅱb级推荐;B级证据)。④对于3~4.5 h时间窗内到达的基线评分>25分的急性卒中患者,静脉使用阿替普酶的获益是不确定的(Ⅱb级推荐;C级证据)。⑤对于存在既往卒中病史和糖尿病的急性缺血性卒中患者,在3~4.5 h时间窗内进行静脉阿替普酶治疗与0~3 h时间窗一样有效,并可能是一种合理的选择(Ⅱb级推荐;B级证据)。
31 其他话题
31.1 醒后/发作时间不明的卒中
FDA将卒中症状出现3 h后定为静脉应用阿替普酶的禁忌证,而2013年的AHA/ASA指南则聚焦于CT和MRI灌注成像应用于超静脉阿替普酶溶栓时间窗患者的可能性,以帮助临床决策的制定。
在不符合阿替普酶治疗入组标准的缺血性卒中患者中,发生时间不明者占到24%。这些患者中14%~30%为醒后卒中。有人提出MRI的液体衰减反转回复(fluid-attenuated inversion recovery,FLAIR)序列可用于评价4.5 h内的醒后/发作时间不明的卒中患者。尤其是,缺血性卒中发生数分钟内,弥散加权成像(diffusion-weighted imaging,DWI)上即可出现高信号,而FLAIR序列上的改变则有延迟。因此,DWI-FLAIR出现不匹配区即可用于区分超急性(<4.5 h)和急性(>4.5 h)缺血性卒中。在一项回顾性研究中,130例卒中发生时间已知的患者在症状出现12 h内进行了1.5-T MRI扫描,其中63例于症状出现后3 h内进行检查,67例于3 h后进行检查。使用卒中区域和对侧感兴趣区的信号强度来计算DWI、FLAIR序列的成像比和表观扩散系数。FLAIR比率对区分<3 h和>3 h卒中的敏感性和特异性均>90%。但其他研究均未达到如此强有力的敏感性和特异性。
一项研究对94例已知卒中发生的患者,在其症状出现12 h内进行了MRI检查,FLAIR序列阴性用于识别卒中发生时间<4.5 h的敏感性为46%,特异性为79%,而且信号强度与卒中发生时间并无相关性。在一项多中心观察性研究中,543例缺血性卒中患者在症状发生后12 h内进行了DWI和FLAIR序列的扫描。516例(95%)患者在DWI序列上可见缺血性损伤,271例(50%)患者在FLAIR序列上可见损伤。DWI-FLAIR不匹配用于识别症状发生时间<4.5 h的敏感性为62%,特异性为78%。而且,观察者内部对识别FLAIR序列缺血性损伤的一致性为中等程度(κ=0.57)。尽管有限的研究尝试使用MRI和临床标准来对醒后或症状发生时间不明的卒中患者静脉应用阿替普酶加以筛选,但目前现有的数据仍不充分。
也有研究尝试基于CT成像对醒后或发生时间不明的卒中患者是否可以静脉应用阿替普酶进行选择。17例醒后卒中患者和46例卒中发生时间已知的患者,其CT发现并无差异,但发生时间不明的患者有出现更多低密度的趋势。在另一项研究中,28例从抵院至最后看上去正常的时间>4 h的患者在最后看上去正常时的15 h内进行了头部CT检查,将其与卒中发生时间已知并在症状出现后4 h内进行了CT扫描的68例患者进行比较。醒后组ASPECTS评分8~10分者为89%,对照组为96%(P=0.35)。在一项前瞻性观察性研究中,676例于症状发生24 h内进行扫描的患者,其损伤体积要大于125例发生时间未明的患者,但对131例醒后卒中患者与420例发生时间已知的患者进行比较,两组的损伤体积、CT灌注不匹配区和颅内大血管损伤差异无显著性。以上数据说明,醒后卒中更有可能发生于接近醒来时,因此如果在醒后很快即到达医院,可以考虑对醒后卒中患者静脉应用阿替普酶。
在一项对醒后卒中的回顾性研究中,28例患者仅接受了静脉阿替普酶治疗,4例患者同时接受了静脉和动脉内阿替普酶治疗,14例患者仅接受了动脉内阿替普酶治疗。有2例(4.3%)患者发生了sICH。
尽管治疗组醒后卒中患者的死亡率要高于未接受治疗的醒后患者组(15%vs0),但将治疗组醒后卒中患者与174例于症状发生3 h内进行静脉阿替普酶治疗的患者进行比较后发现,两组的安全性和临床结局的差异无显著性。在一项近期的观察性研究中,醒后卒中进行阿替普酶治疗的选择标准为:①最后看起来正常的时间<12 h或症状出现后>4.5 h;②最后清醒时无神经功能缺陷并在醒后存在持续性的功能障碍;③急诊至医院;④首次评估时NIHSS评分≥5分;⑤基线CT扫描时无EICs或EICs小于1/3MCA供血区;⑥无使用阿替普酶的绝对禁忌证。在68例接受阿替普酶治疗的患者中,2例发生了sICH,该组的总体结局与未接受阿替普酶治疗的对照组相似。
总之,对醒后卒中和发生时间未明的卒中患者进行静脉阿替普酶治疗是一项十分火热的议题。目前正在进行的试验,如欧洲卒中试验“基于MRI的醒后卒中溶栓的有效性与安全性:一项随机、双盲、安慰剂对照试验(wakeup stroke:a randomized,double-blind,placebo-controlled Trial,WAKE-UP)”和美国国立卫生研究院(National Institute of Health,NIH)/NINDS资助的试验“MR WITNESS(A Phase Ⅱa Safety Study of Intravenous Thrombolysis with Alteplase in MRISelected Patients):一项对经MRI选择的患者进行阿替普酶静脉溶栓的Ⅱa期安全性研究”,应该会进一步揭示醒后卒中治疗方法的安全性和有效性。
31.1.1 对于醒后/发作时间不明的卒中建议
①不推荐对醒后卒中距基线状态>3 h或4.5 h的缺血性卒中患者进行静脉阿替普酶治疗(Ⅲ级推荐;B级证据)。②不推荐对发生时间不明和(或)症状发生时未被觉察且距最终为基线状态的时间>3 h或4.5 h的缺血性卒中患者进行静脉阿替普酶治疗(Ⅲ级推荐;B级证据)。③不推荐在临床试验外,使用影像学标准选择进行静脉阿替普酶治疗的醒后卒中或症状发生时间不明的缺血性卒中患者(Ⅲ级推荐;B级证据)。
31.2 月经期和月经过多
FDA说明和2013年AHA/ASA指南均未对这一风险进行特别说明,但药物标签警示了内出血的风险,包括泌尿生殖道出血风险。有关处于月经期或有月经过多病史的女性使用阿替普酶安全性的数据十分有限。2项1995 NINDS阿替普酶试验并未将处于月经期作为排除标准;在5例接受阿替普酶治疗的月经期女性中,1例具有功能异常性阴道出血病史的女性其月经流量增多,出现轻度的低血压并进行了3 U浓缩红细胞的输血。此外,有1例46岁无月经过多病史的女性,治疗后出现月经流量增多并进行了2 U浓缩红细胞输血的报道;在开始静脉输注阿替普酶12 h后,其月经流量恢复正常。这一病例报道的作者对25例因MI或深静脉血栓接受溶栓药物治疗而处于月经期的女性进行了回顾,发现仅有2例合并应用肝素的患者进行了输血治疗。
31.2.1 对于月经期和月经过多建议
①正处于月经期而没有月经过多病史的急性缺血性卒中患者可以进行静脉阿替普酶治疗。但应警示女性,阿替普酶治疗有增加月经量的风险(Ⅱa级推荐;C级证据)。②对于近期有月经过多病史或存在持续性月经过多但临床无显著贫血或低血压的女性,因为静脉阿替普酶治疗的潜在收益可能高于严重出血的风险,可以考虑对其静脉应用阿替普酶(Ⅱb级推荐;C级证据)。③当有阴道出血病史或存在活动性阴道出血而造成临床显著的贫血时,应在决定静脉应用阿替普酶前紧急咨询妇产科专家(Ⅱa级推荐;C级证据)。④对处于月经期或有活动性阴道出血而接受阿替普酶治疗的患者,应在应用阿替普酶后对阴道出血程度进行24 h监测(Ⅰ级推荐;C级证据)。
31.3 心脏内肿块
在2项NINDS阿替普酶卒中试验中,心脏肿块并不是一项排除标准,目前的AHS/ASA指南也未将其作为排除标准,目前的FDA标识也未对其加以警示或作为禁忌证。我们对文献进行回顾,发现了两种与急性缺血性卒中相关的最常见心脏肿块的溶栓经验:黏液瘤和弹力纤维瘤。
黏液瘤是最为常见的原发性心脏肿瘤。肿瘤起源自具有神经和内皮分化能力的多能间充质细胞,约80%起自左心房。超过1/4的患者会发生系统性栓塞并经常出现缺血性卒中。瘤栓也可侵犯脑动脉,造成血管破裂或形成动脉瘤,而以脑出血和SAH为首发表现。尽管栓子多来源于黏液瘤组织,但也可能来源于与肿瘤相连的血栓。尽管瘤栓对于纤维蛋白溶解反应较差,但血栓栓子会有反应,有局部动脉应用纤溶治疗后血管再通的报道即可说明这一点。目前至少有15例心房黏液瘤患者接受静脉阿替普酶纤溶治疗的报道。其中1例,对比其治疗前的磁共振血管成像与治疗后的经颅多普勒和导管造影,可见血管再通。15例患者中有2例(13%)在治疗后24 h内发生了出血转化。
乳头状弹力纤维瘤是第二常见的良性心脏肿瘤,通常呈现为起自杆状中央核心的叶状分支。超过80%的弹力纤维瘤见于心脏瓣膜,通常为心房或二尖瓣,其余的损伤散在贯穿心房和心室。最常见的临床表现为栓塞引起的卒中或短暂性脑缺血发作。与黏液瘤不同,该疾病对脑血管的侵袭性破坏和脑出血的表现并不常见。栓子可能由肿瘤组织组成或源自于肿瘤处形成的血栓。在1例后循环闭塞的患者中,动脉内纤溶治疗使血管部分再通,提示溶解治疗可能对一些栓子有效。目前至少有2例报道描述患者静脉应用阿替普酶后未出现出血并发症。
31.3.1 对于心脏肿块建议
①对于存在心脏黏液瘤而缺血性卒中可能导致严重致残者,使用静脉阿替普酶治疗可能是合理的(Ⅱb级推荐;C级证据)。②对于存在乳头状弹力纤维瘤而缺血性卒中可能导致严重致残者,使用静脉阿替普酶治疗可能是合理的(Ⅱb级推荐;C级证据)。
31.4 已知或疑似的主动脉弓夹层与头颈部动脉夹层
FDA的说明中并未提及动脉夹层的相关问题,而2013年AHA/ASA指南则在诊断研究部分中提出治疗时应对动脉夹层给予考虑。
美国缺血性卒中标准化治疗为在症状出现后3 h内进行静脉阿替普酶治疗。然而,对存在升主动脉夹层的患者,静脉应用阿替普酶可能会诱发夹层破裂。一些急性主动脉夹层患者可出现神经功能缺损,特别是当夹层扩展至颈内动脉时。鲜有文献对此进行报道,大多数医生都倾向于避免对主动脉夹层患者进行静脉阿替普酶治疗。急性卒中患者在静脉应用阿替普酶时,部分患者会出现如侧腹痛、胸部和耳部疼痛,或肢端发凉、脉搏消失的表现。进一步的影像学检查发现这些患者均存在主动脉夹层。几乎所有的报道都在发现患者存在主动脉夹层时停止了使用阿替普酶。因此,应寻找是否存在放射至背部的胸痛、大汗或低血压等临床线索。若临床怀疑存在主动脉夹层,应在应用阿替普酶前进行胸部X线检查以发现是否存在纵隔增宽,或进行CT血管造影(头颈部,并包括主动脉弓)。
因颈动脉夹层造成的卒中,其阿替普酶的使用情况并不十分明确。颈动脉夹层不仅会造成颈内动脉的闭塞/狭窄,也会导致纵向的远端形成栓子。在瑞士一项有关颈内动脉夹层与阿替普酶应用的大型多中心研究中,研究者对因颈动脉夹层造成的卒中患者与其他原因导致的卒中患者进行了比较。与接受静脉阿替普酶治疗的无颈动脉夹层的患者相比,颈动脉夹层患者进行静脉阿替普酶治疗后恢复良好的概率更低。更低的恢复概率并不是由两组颅内出血或卒中复发率的不同而造成的。一项针对颈动脉夹层静脉应用阿替普酶安全性的meta分析发现,颈动脉夹层相关性卒中患者进行溶栓的安全性和结局与全因卒中患者相似,怀疑存在颈动脉夹层不应成为卒中患者进行静脉阿替普酶治疗的排除标准。来自颈动脉夹层与缺血性卒中患者数据库的数据显示,在616例因颈动脉夹层导致的卒中患者中,68例(11.0%)患者接受了阿替普酶治疗,其中55例(81%)为静脉应用。溶栓患者的卒中严重程度更高(中位NHISS评分16分与3分;P<0.001),更常见夹层动脉闭塞(66.2%与39.4%;P<0.001)。然而对卒中严重程度和血管闭塞进行校正后,两个治疗组获得良好结局的可能性的差异无显著性。作者认为“溶栓与结局不良和症状性出血增加均无独立相关性”。大部分RCT并未将颈动脉夹层视为静脉阿替普酶治疗的禁忌证。
自发性颅内动脉夹层极为罕见,目前仅有<100例报道。这通常见于伴有纤维肌性发育不良、囊性中央坏死和动脉粥样硬化的年轻患者。受累患者可出现伴或不伴SAH的缺血性卒中。应将自发性颅内动脉夹层作为颈内动脉狭窄和闭塞的鉴别诊断,特别是对年轻患者。目前的文献建议:抗凝治疗是非出血性颅内动脉夹层的唯一治疗手段。
31.4.1 对于已知或疑似的主动脉弓夹层与头颈部动脉夹层建议
①对已知或怀疑存在主动脉弓夹层的缺血性卒中患者进行静脉阿替普酶治疗可能是有害的,不予推荐(Ⅲ级推荐;C级证据)。②对发病4.5 h内的已知或怀疑存在颅外颈动脉夹层的缺血性卒中患者进行静脉阿替普酶治疗是足够安全的,可予推荐(Ⅱa级推荐;C级证据)。③对与已知或怀疑存在的颅内颈动脉夹层相关的缺血性卒中患者进行静脉阿替普酶治疗的实用性和出血风险仍不可知、不明确、尚未得到证实(Ⅱb级推荐;C级证据)。
31.5 7 d内硬膜穿刺
FDA说明和2013年AHA/ASA指南均未对硬膜穿刺后静脉应用阿替普酶的风险做出任何特定的描述。
穿刺后有发生腰椎硬膜外血肿和神经结构受压的可能,促使穿刺成为静脉应用阿替普酶的禁忌证。操作信息,包括脑脊液检测的适应证、操作的次数和使用针头的规格,可能会提示操作处出血的风险。文献中有关静脉阿替普酶治疗后出现自发性硬膜外血肿的报道十分有限。但大多数病例报告均描述是在同时应用阿替普酶和肝素后出现了自发性硬膜外血肿。仅有Connolly等在1996年时报道了1例患者在静脉应用阿替普酶后出现了硬膜外血肿,而并未特别提及是否同时应用了肝素。尽管作者未特别提到肝素的使用,但肝素化是当时许多医疗中心的标准化治疗。而且血肿发生于静脉应用阿替普酶后10 d时。没有腰椎穿刺或硬膜外麻醉后静脉应用阿替普酶的报道或文献存在,然而有肝素化后进行局部穿刺麻醉并出现自发性硬膜外血肿的报道。近期有硬膜穿刺史者绝对禁忌同时应用肝素和阿替普酶。然而,在缺乏数据和病例报道的情况下,不应将硬膜穿刺作为单独静脉应用阿替普酶治疗的绝对禁忌证。考虑到相对于神经结构,腰椎管的空间仍比较充裕,血肿积累至足够大的体积以促使出现神经功能缺损的可能性不大。总之,临床医师必须权衡首次腰椎穿刺的适应证和溶栓的可能获益。
31.5.1 对于7 d内硬膜穿刺建议
①即使急性缺血性卒中患者在此前7 d内进行过腰椎穿刺,也可考虑对其进行静脉阿替普酶治疗(Ⅱb级推荐;C级证据)。

