两个地理群体香港牡蛎(Crassostrea hongkongensis)杂交子代早期生长发育的杂种优势研究*
官俊良 张跃环 苏家齐 肖 述 张 明① 李琼珍 喻子牛①
(1. 广西大学 动物繁殖研究所 亚热带农业生物资源保护与利用国家重点实验室 南宁 530004; 2. 中国科学院南海海洋研究所 热带海洋生物资源与生态重点实验室 广州 510301; 3. 中国海洋大学水产学院 教育部海水养殖重点实验室 青岛266003; 4. 广西水产研究所贝类科学实验站 南宁 530004)
香港牡蛎Crassostrea hongkongensis在我国有近千年的养殖历史, 是华南沿海养殖的主要经济种, 喜欢生活在近河口或附近有淡水注入的地方, 主要分布在广东、广西等地, 年产量约130多万吨, 产值在80—100亿元(张跃环等, 2013)。香港牡蛎个体大, 味道鲜, 其单价远远高于近江牡蛎C. ariakenesis、长牡蛎C. gigas、葡萄牙牡蛎C. gigas angulata等, 深受东南亚一些国家和地区消费者青睐(张跃环等, 2014a)。
香港牡蛎在我国华南沿海具有明显的地理区划,福建、粤东、粤西、广西群体间存在着显著的遗传差异, 这种差异受到温度、盐度、洋流等自然因素及人为活动影响(Li et al, 2013)。在香港牡蛎养殖过程中,经常出现冬季大规模死亡现象, 获得生长快、抗性强的新品种, 可能是提高产量, 解决冬季大规模死亡的有效途径(张跃环等, 2014c)。研究表明, 香港牡蛎珠海群体具有较快的生长速度, 而茅尾海群体抗逆性较强(肖述等, 2014)。本文以生长快的珠海群体和抗性强的茅尾海群体为材料, 进行两个群体间的双列杂交, 旨在培育出具有杂种优势的新品系。
1 材料与方法
1.1 亲贝来源
2014年5月下旬, 采集香港牡蛎广西茅尾海群体(M)和广东珠海群体(Z)作为实验材料, 暂养于广西北海市竹林贝类科学实验站育苗场的种贝池中。
1.2 实验设计和处理
2014年6月上旬, 选取成熟的香港牡蛎茅尾海群体5雌5雄, 珠海群体5雌5雄, 采用解剖的方式, 获得茅尾海 M♀卵子、M♂精子和珠海 Z♀卵子、Z♂精子。按照双列杂交策略, 采用单对单方式, 将获得的精卵按照表 1组合受精, 建立两个自交组(MM、ZZ)和两个杂交组(MZ、ZM)共4个实验组。用200目筛绢网滤除大块杂质, 受精30—60min后将受精卵转入100L白桶中微充气孵化, 密度控制在8—10个/mL。大约经过20h, 受精卵发育为D形幼虫。整个实验操作过程中, 严格隔离各实验组, 防止组间污染。
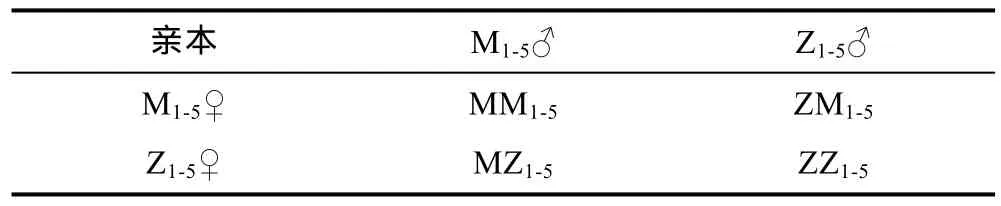
表1 双列杂交的配对原则Tab.1 Mating strategy of diallel cross of C. hongkongensis from two populations
1.3 幼虫培养
幼虫在100L的白桶中培育, 密度控制在4—5个/mL。每2天全量换1次水, 每天投喂2次单胞藻饵料, 6日龄以前饵料为云微藻, 后期为云微藻和扁藻(体积比1︰1)混合投喂, 投饵量在5000—20000 cell/(mL·d)。当幼虫出现眼点、足外伸时, 用黑色塑料板作为附着基采苗。幼虫浮游期间, 换水网袋单独使用, 水温为26.4—27.8°C, 盐度为15—20。定期调整幼虫培育密度, 使每个重复组间密度保持一致。
1.4 稚贝培育
眼点幼虫附着后, 大约经过 8d左右完成变态,固着在黑色塑料板上。在20 m3育苗池中进行稚贝培育, 将塑料板附着基置于池中, 每天投喂云微藻600L [2.0×104cell/(mL·d)]、金藻 300L [1.0×104cell/(mL·d)]、扁藻 200L [0.15×104cell/(mL·d)]。在此期间,为了防止外来牡蛎幼虫污染, 室内用水经过400目筛绢网过滤。室内中间育成期间, 水温25.4—28.5℃, 盐度15—20, pH 值 7.80—8.62。
1.5 测定指标
生长指标为壳高, 幼虫期间采用显微镜测量, 稚贝期间采用电子游标卡尺测量; 幼虫存活率以 D形幼虫作为 100%, 稚贝存活率以刚刚完成变态的新生稚贝作为100%。壳高每个重复组随机测量30个个体,存活率每个重复组测量3次。
1.6 杂种优势
为了确定卵源及其配对策略对幼虫表型性状的影响, 参照 Zhang等(2007)方法, 利用双因子分析模型检测母本效应(EO)及配对方式(MT)对杂交组幼虫生长与存活的影响:
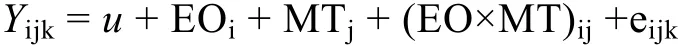
式中,Yijk为k个重复i个卵源j种配对方式下的壳高(存活率);u为常数; EOi为壳高(存活率)的卵源效应(母本效应)(i=1, 2); MTj为壳长(存活率)的配对效应(j=1, 2); (EO×MT)ij为卵源与配对策略的交互作用;eijk为随机误差(k=1, 2, 3, 4, 5)。
参照Zheng等(2006, 2011)、郑怀平等(2012)的方法, 计算群体间的杂种优势(heterosis):
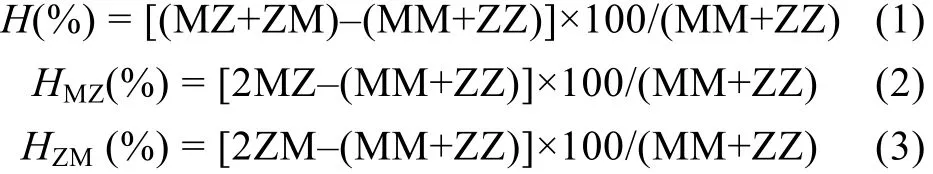
式中, MM(茅尾海自繁组)、MZ(正交组)、ZM(反交组)、ZZ(珠海自繁组)分别表示各实验组的子代在同一日龄的表型值(壳高、存活率)。公式(1)表示中亲杂种优势; 公式(2)、(3)表示正反交组的杂种优势。
1.7 数据处理
采用单因素方差分析方法对实验组数据进行分析(SPSS 18.0统计软件), 差异显著性设置为P<0.05。
2 结果
2.1 幼虫生长与存活
幼虫浮游期间, 正交组(MZ)在第 3—9日龄的平均壳高表现出杂种劣势, 大小在–3.07— –6.92, 至 12日龄以后, 正交优势值分别为5.34。反交组(ZM)则从3日龄开始就表现出了杂种优势, 9日龄时, 杂种优势值最高为 22.36。总体水平上看, 浮游期间均表现出一定程度的杂种优势, 大小为 5.69±1.77(3.69—7.72)(表 2)。在幼虫生长过程中, 杂种优势受卵源效应、配对策略及二者间交互作用共同影响(表3)。
3—12日龄期间, 各实验组幼虫存活率, 均在80%以上。MZ、ZM组存活率高于对照组, 其ZM、MZ存活优势分别为 4.21±1.76 (2.87—6.73)和 4.21±1.76 (2.87—6.73), 总体水平上的存活优势为 5.51±1.44(4.13—7.53)(表 4)。浮游期间, 幼虫存活率主要受配对策略影响(表3)。
2.2 室内培育期稚贝生长与存活
各实验组稚贝在30、45、60日龄的平均壳高及其杂种优势见表5。稚贝期正交组(MZ)生长表现出明显的杂种优势, 母本效应逐渐减弱, 其生长优势平均值为 7.86±3.12 (4.33—10.25)。反交组(ZM)的生长也表现出正杂种优势, 但是随着日龄增长生长优势明显减弱, 其大小为17.47±13.14 (9.39—32.62)。总体水平上, 中亲生长优势为12.67±7.74 (6.81—21.44)。

表2 浮游期各实验组幼虫的壳高及杂种优势Tab.2 Shell height and heterosis in larval stage

表3 幼虫生长及存活的卵源(EO)及配对效应(MS)分析Tab.3 Egg origin (EO) for early growth and survival and the mating strategy (MS) effect
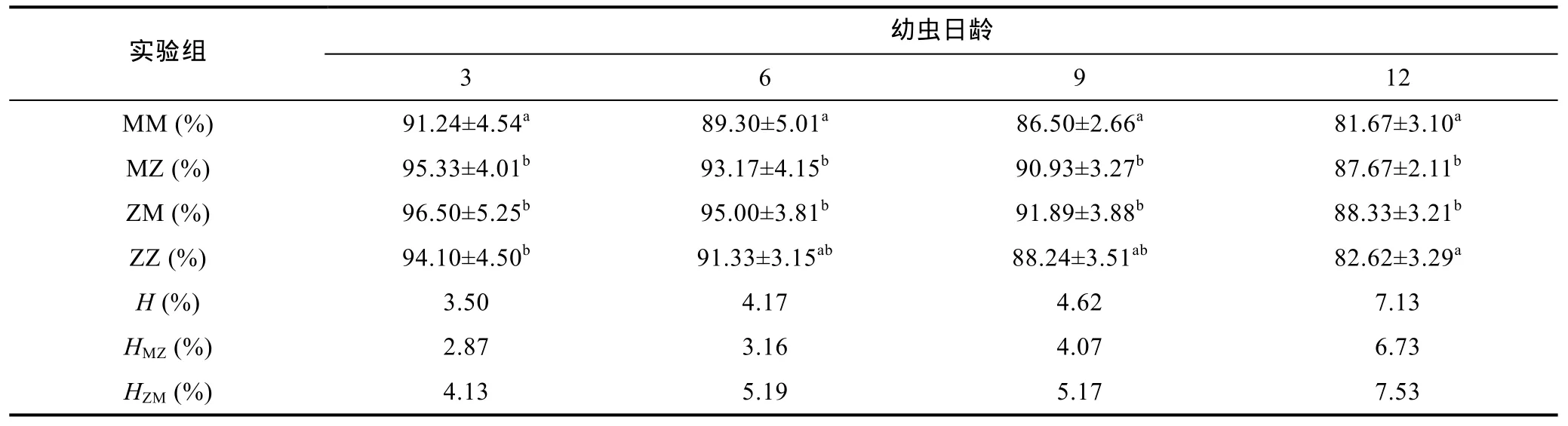
表4 浮游期各实验组幼虫的存活率和杂种优势Tab.4 Survival rates and heterosis in the larval stage
稚贝存活及其优势见表6。将刚刚完成变态的稚贝存活率定义为100%。30—60日龄期间, 稚贝存活率均在 80%以上, 大小顺序为 MZ>MM>ZM>ZZ, 进一步证实了茅尾海群体的存活力高于珠海群体。M×Z、MZ、ZM 存活优势平均值分别为5.59±1.22 (4.32—6.76)、8.33±1.41 (6.99—9.81)、2.86±1.08 (1.65—3.72), 且正交组 MZ>反交组ZM。由此可见, 杂交在一定程度上有效的改良了存活性能。
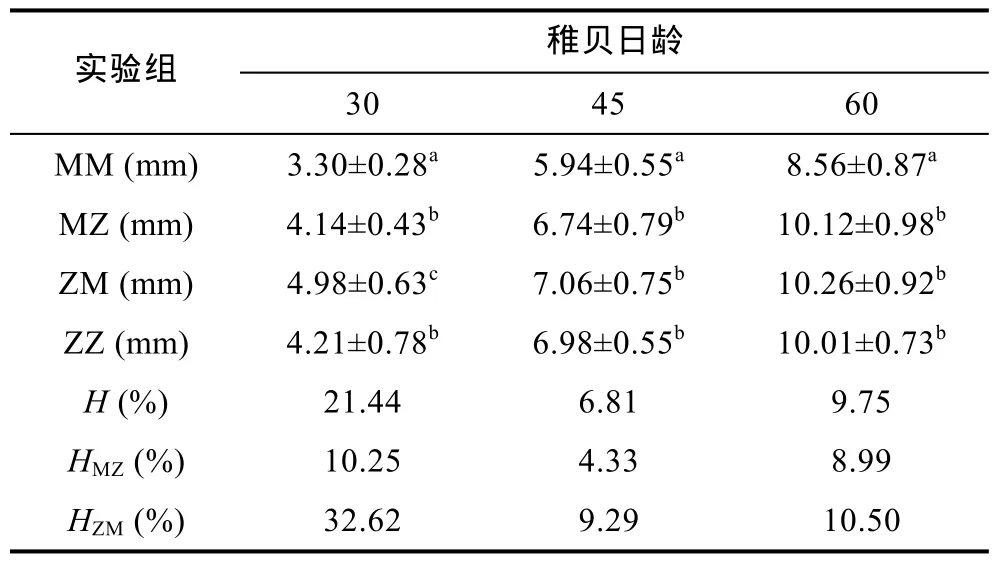
表5 各实验组稚贝的壳高和杂种优势Tab.5 Shell height and heterosis in the spat stage
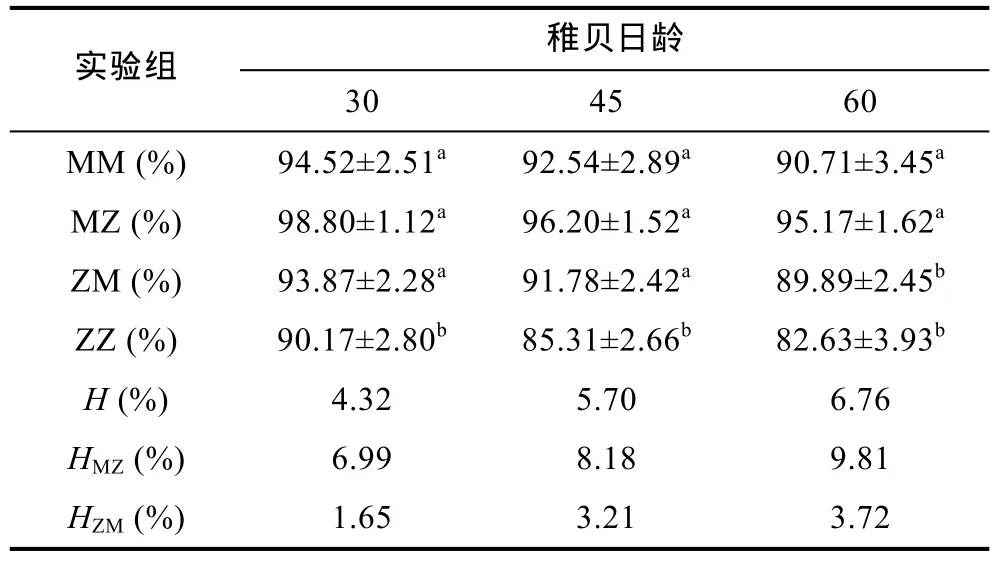
表6 各实验组稚贝的存活率和杂种优势Tab.6 Survival rates and heterosis in the spat stage
3 讨论
3.1 群体间差异
分布在我国广东、广西、福建、香港等地的香港牡蛎, 可以划分为两大类, 一类为生长快、贝壳薄、抗性较差的珠海群体; 另一类为生长相对较慢、贝壳较厚、抗性较强的茅尾海群体(肖述, 2014; 张跃环等,2014c)。
这两个群体牡蛎除了上述差异外, 还存在着明显的遗传差异。学者们综合运用微卫星位点和线粒体基因两种分子标记, 通过扩增香港巨牡蛎 12个微卫星位点和2个线粒体基因片段序列, 采用支序分析方法、谱系生物地理学方法以及遗传变异参数分析等方法研究发现, 这两个群体的牡蛎存在着一定程度的遗传分化。由于雷州半岛的地理隔离作用及其香港牡蛎幼虫对高盐度海水适应能力差, 致使群体间基因交流较少, 形成了群体间的遗传差异(Liet al, 2013)。
3.2 杂种优势
杂种优势产生的重要原因是亲本间的遗传差异,只有群体间的基因频率不同, 优良显性基因的互补作用和群体中杂合子频率的增加, 它们之间的杂交才有可能出现杂种优势。反之, 杂交子代表型性状不但没有得到改良, 甚至会退化, 表现为杂种劣势(张国范等, 2009, 2010)。
本研究中发现杂交可以在一定程度上改良生长及其存活性状, 但是其正反交组的杂种优势与中亲优势间存在着一定程度关联, 而且主要受母本效应影响。此外, 在不同阶段表现的杂种优势值存在着差异, 这可能是幼虫期及稚贝期生活方式不同造成的(孙长森等, 2010; 霍忠明等, 2010)。当幼虫生长至300 µm 以上时, 生长速度会减慢, 自身能量主要用于器官发生, 为其变态积累营养, 这样就会导致前期生长较快的实验组在浮游末期生长缓慢, 而生长相对较慢的实验组在此期间壳高会增大, 与快速生长组大小差别不显著(闫喜武等, 2008; Yanet al, 2009;滕爽爽等, 2010; Barroset al, 2013; 张跃环等,2014b)。而到了稚贝60日龄阶段时, ZM反交组个体最大, MZ组生长优势很不明显, 主要是由于珠海群体本身具有较快的生长速度造成的; 虽然MZ实验组个体略小于ZM实验组, 但是由于茅尾海群体自身存活率高, 所以使其ZM组出现了一定程度的存活优势,总体水平上, 仍表现出积极的杂种优势。
3.3 应用潜力
杂种优势是指杂交子代在生长势、生活力、产量等方面超越双亲或者单亲的现象(Xuet al, 2009, 2014;王爱民等, 2010; Zhanget al, 2012, 2014; 苏家齐等,2013; Huoet al, 2013; 吴杨平等, 2015)。本研究中,两个群体香港牡蛎存在着表型性状差异, 尤其是在生长、存活性状上各自具有优势。通过杂交将珠海群体的快速生长及其茅尾海群体的抗逆性强优点结合起来, 可获得生长快、抗性强的牡蛎新品系。我们相信, 这种杂交牡蛎新品系经过小试、中试以后, 具有较好的应用前景。
4 结论
本文以具有遗传差异的两个群体香港牡蛎进行杂交育种, 杂交子代获得了双亲的优良性状, 表现为杂种优势。虽然只研究了杂交子代早期阶段的表型性状, 但也为后期的杂种优势评估及其开发利用奠定了坚实的理论与实践基础。
王爱民, 王 嫣, 顾志峰等, 2010. 马氏珠母贝(Pinctada martensii) 2个地理群体杂交子代的杂种优势和遗传变异.海洋与湖沼, 41(1): 140—147
闫喜武, 张跃环, 霍忠明等, 2008. 不同壳色菲律宾蛤仔品系间的双列杂交. 水产学报, 32(6): 864—875
孙长森, 林志华, 董迎辉等, 2010. 泥蚶(Tegillarca granosa)主要经济性状遗传参数的估算. 海洋与湖沼, 41(6): 907—913
苏家齐, 闫喜武, 张跃环等, 2013. 两种三元杂交菲律宾蛤仔(Ruditapes philippinarum)壳色品系间的聚合杂交. 海洋与湖沼, 44(2): 513—518
肖 述, 张跃环, 李琼珍等, 2014. 一种防御香港牡蛎大规模死亡的逐级淡泡方法. 中国发明专利, 专利号:ZL201410117205.8
吴杨平, 陈爱华, 张 雨等, 2015. 红壳文蛤双列杂交及杂种优势分析. 海洋与湖沼, 46(1): 43—49
张国范, 闫喜武, 2010. 蛤仔养殖学. 北京: 科学出版社,299—326
张国范, 郑怀平, 2009. 海湾扇贝养殖遗传学. 北京: 科学出版社, 76—99
张跃环, 王昭萍, 闫喜武等, 2013. 香港巨牡蛎与长牡蛎种间配子兼容性. 生态学报, 33(10): 3047—3055
张跃环, 王昭萍, 喻子牛等, 2014a. 养殖牡蛎种间杂交的研究概况与最新进展. 水产学报, 38(4): 613—623
张跃环, 王昭萍, 喻子牛等, 2014b. 香港牡蛎(Crassostrea hongkongensis)与长牡蛎(Crassostrea gigas)种间杂种遗传力评估. 海洋与湖沼, 45(6): 1367—1373
张跃环, 肖 述, 李琼珍等, 2014c. 一种回避香港牡蛎冬季大规模死亡的露空防御方法. 中国发明专利, 专利号:ZL201410118000.1
郑怀平, 王迪文, 林 清等, 2012. 太平洋牡蛎与葡萄牙牡蛎两近缘种间杂交及其早期阶段生长与存活的杂种优势.水产学报, 36(2): 210—215
滕爽爽, 李 琪, 李金蓉, 2010. 长牡蛎(Crassostrea gigas)与熊本牡蛎(C. sikamea)杂交的受精细胞学观察及子一代的生长比较. 海洋与湖沼, 41(6): 914—922
霍忠明, 闫喜武, 张跃环等, 2010. 菲律宾蛤仔(Ruditapes philippinarum)大连群体家系建立及生长比较. 海洋与湖沼, 41(3): 334—340
Barros P, Sobral P, Range P et al, 2013. Effects of sea-water acidification on fertilization and larval development of the oyster Crassostrea gigas. J Exp Mar Biol Ecol, 440:200—206
Huo Z M, Wang Z P, Yan X W et al, 2013. Fertilization, survival,and growth of Crassostrea hongkongensis♀ × Crassostrea ariakensis♂ hybrids in Northern China. J Shellfish Res,32(2): 377—385
Li L, Wu X Y, Yu Z N, 2013. Genetic diversity and substantial population differentiation in Crassostrea hongkongensis revealed by mitochondrial DNA. Mar Genomics, 11: 31—37
Xu F, Li L, Wang J F et al, 2014. Use of high-resolution melting analysis for detecting hybrids between the oysters Crassostrea sikamea and C. angulata reveals bidirectional gametic compatibility. J Mollus Stud, 80(4): 435—443
Xu F, Zhang G F, Liu X et al, 2009. Laboratory hybridization between Crassostrea ariakensis and C. sikamea. J Shellfish Res, 28(3): 453—458
Yan X W, Zhang Y H, Huo Z M et al 2009. Effects of starvation on larval growth, survival, and metamorphosis of Manila clam Ruditapes philippinarum. Acta Ecol Sin, 29(6): 327—334
Zhang H B, Liu X, Zhang G F et al, 2007. Growth and survival of reciprocal crosses between two bay scallops, Argopecten irradians concentricus Say and A. irradians irradians Lamarck. Aquaculture, 272(S1): S88—S93
Zhang Y H, Wang Z P, Yan X W et al, 2012. Laboratory hybridization between two oysters: Crassostrea gigas and Crassostrea hongkongensis. J Shellfish Res, 31(3): 619—625
Zhang Y H, Zhang Y, Wang Z P et al, 2014. Phenotypic trait analysis of diploid and triploid hybrids from female Crassostrea hongkongensis × male C. gigas. Aquaculture,434: 307—314
Zheng H P, Xu F, Zhang G F, 2011. Crosses between two subspecies of bay scallop Argopecten irradians and heterosis for yield traits at harvest. Aquac Res, 42(4): 602—612
Zheng H P, Zhang G F, Guo X M et al, 2006. Heterosis between two stocks of the bay scallop, Argopecten irradians irradians Lamarck (1819). J Shellfish Res, 25(3): 807—812

