使用多普勒超声成像比较栉孔扇贝与虾夷扇贝循环生理特征*
郝杰华 许 强① 汝少国 杨红生
(1. 中国海洋大学海洋生命学院 青岛 266003; 2. 中国科学院海洋研究所海洋生态与环境科学重点实验室 青岛 266071)
栉孔扇贝(Chlamys farreri)和虾夷扇贝(Patinopecten yessoensis)是我国近海重要的养殖贝类。近年来, 全球气温的变化和海水温度异常波动对近海扇贝的不利影响日趋严重(高菲, 2005)。掌握不同温度下扇贝的血液循环生理特征, 是揭示扇贝生理代谢机能变化的有效途径, 也是制订应对策略、优化养殖管理的必然需求。循环系统生理学是动物生理学重要组成部分, 主要研究动物心脏、血管的生理特征、活动规律及其影响因素等, 研究的指标主要包括心率、血管收缩舒张特征、血流动态(流向、流速、流量、阻力)等(杨秀平等, 2002)。能反映心血管机能的循环系统生理学指标是指示新陈代谢水平和机体机能状态的有效参数(Trueman, 1967; Campbell et al, 2007)。但是由于缺乏适用的技术, 贝类血液循环生理的研究迟迟无法开展, 国外也仅对贻贝、腹足类等心率指标的生理节律变化开展研究(Bakhmet et al, 2006; Braby et al,2006; Kholodkevich et al, 2009; Burnett et al, 2013),对其它循环生理功能的研究尚不多见。
多普勒超声成像技术是高等动物循环生理学研究的核心技术之一, 可清晰呈现组织器官内部的血流信息, 包括血流方向、速度、加速度等, 从而实现血流状态的无损实时监测(Braby et al, 2006; Novelo et al, 2012)。近年来, 该技术正逐步应用于鱼类、两栖类和其它水生动物的循环生理研究, 但超声成像技术在双壳贝类研究中的应用还很少, 仅见于Haefner等(1996)针对贻贝的研究, 阐述了不同温度下贻贝心率和血流速度的变化特征。
本研究将多普勒超声成像技术引入贝类循环生理研究中, 选取我国北方重要的扇贝种类——栉孔扇贝和虾夷扇贝, 解析并量化了不同温度下两种扇贝循环生理指标特征, 以期揭示两种不同适温性的扇贝在循环生理功能方面的适应性。
1 材料与方法
1.1 实验材料
1龄栉孔扇贝(C.farreri)和虾夷扇贝(P.yessoensis)分别在青岛胶州湾筏式养殖区和大连獐子岛底播养殖区获得。清除扇贝表面的污物及附着生物, 控温水箱内暂养两周, 暂养期间温度为(10±1)°C; 盐度为31.3。每天上午10点全量换水1次, 并定量投喂小球藻(Chlorellasp.)、金藻(Chrysophytasp.)和三角褐指藻(Phaeodactylumtricornutum)。驯养1周后, 栉孔扇贝和虾夷扇贝分别随机挑选 6—10只健康及规格相近的个体用于实验(见表1)。

表1 栉孔扇贝和虾夷扇贝基础生物学指标Tab.1 Basic biological indices of C. farreri and P. yessoensis
1.2 实验方法
1.2.1 温度处理 实验设置10、15、20和25°C 4个温度梯度, 从 10oC缓慢逐步加温(2°C/d)达到设定温度, 到既定温度后保持1h, 使扇贝处于相对稳定的状态, 然后测定血液循环生理学指标。采用控温水族箱水浴控制温度, 误差为±0.5°C。
1.2.2 仪器设备 实验所用仪器为Z6 Vet型便携式彩色多普勒超声诊断仪(中国深圳 Mindray公司),探头频率为8—14MHz。
1.2.3 测定方法 在测定扇贝时, 用万向支架固定超声探头, 使探头没入水中且可自由调节探头方向; 用塑料夹固定扇贝于塑料水族箱底, 待其自然张口后调节探头的声波切面与扇贝贝壳面平行, 微调探头方向, 使超声面切过扇贝出鳃血管, 此时仪器显示屏上出现扇贝血流的稳定图像, 稳定30s后保存至少1min的动态录像待后续分析。
1.2.4 彩超图像 在多普勒彩超模式下保存的扇贝血管彩超图和心率波动图, 见图 1。图中不同颜色的血管代表不同的流动方向, 其中蓝色代表入鳃血管, 红色代表出鳃血管; 在心率波动曲线中, 每个周期代表一次心脏的收缩过程, 波动的高低代表血管中血液的瞬时流速, 波峰处为其最大瞬时流速; 其中“62/170”表示在该分析录像时长共 170s, 图像停留在62s处, 左侧纵坐标表示套头的位置, 右侧纵坐标表示血流速度和方向。

图1 多普勒彩超模式下扇贝血管的彩超图和心率波动图Fig.1 The Doppler color picture showing scallop vascular and heart rate fluctuation
1.2.5 指标体系 实验扇贝的血流指标、计算方法及其循环生理学意义指征如下:
(1) 心率(Heart Rate, HR, 次/min)
每分钟的心动周期即为扇贝的心率(HR), 心率的大小能反映心脏的泵血能力。
(2) 收缩峰值速度(Peak Systolic Velocity, PS,cm/s)
代表所测量血管内血液瞬时峰值流速。
(3) 舒张末期速度(End-Diastolic Velocity, ED,cm/s)
代表所测量血管内血液最低瞬时速度。
(4) 血流加速度(Acceleration of Blood Flow,ABF, cm/s2)
单位时间内血流速度的提升率, 即 ABF=(PSED)/t, 能反映血流速度变化快慢和心脏的泵血机能。
(5) 血液最大瞬时流量(Maximum Instantaneous Blood Flow, Max-IBF, mL/s)
Max-IBF表示扇贝血流收缩峰值速度对应的血管的瞬时最大血流量, 与血管的直径和血液流速相关。
(6) 血液最小瞬时流量(Minimum Instantaneous Blood Flow, Min-IBF, mL/s)
Min-IBF表示扇贝血流舒张末期速度对应的血管的瞬时最小血流量, 与血管的直径和血液流速相关。
(7) 阻力指数(Resistive Index, RI)
阻力指数的意义为RI=(PS-ED)/PS, 其值的大小可以用来判断血液或血管的机能是否异常。
(8) S/D
S/D表示血管收缩峰值速度与血管舒张末期速度的比值, 即S/D=PS/ED; 其值的大小可以用来判断扇贝的血管是否受到损伤。
1.3 统计方法
使用SPSS 19.0进行单因素方差分析, 显著性差异定义为 P<0.05, 数据以平均值±标准差(Mean±SD)表示。同时分别对不同扇贝基础循环指标进行相关性分析。
2 结果与分析
2.1 温度对栉孔扇贝和虾夷扇贝HR的影响
温度对栉孔扇贝和虾夷扇贝 HR的影响总体相似。栉孔扇贝和虾夷扇贝的HR与温度正相关, 且温度对栉孔扇贝和虾夷扇贝的 HR均影响显著(图 2,P<0.05)。在同一温度下, 栉孔扇贝的HR大于虾夷扇贝; 在 10—25°C之间, 栉孔扇贝变化范围为 16—39次/min, 虾夷扇贝变化范围为 14—31次/min。在10—20°C范围内相邻两个温度设置下, 栉孔扇贝HR有显著差异(P<0.05), 20°C与最高温25°C无显著差异(P>0.05); 在 15—25°C 范围内相邻两个温度设置下,虾夷扇贝 HR 有显著差异(P<0.05), 15°C 与最低温10°C 无显著差异(P>0.05)。
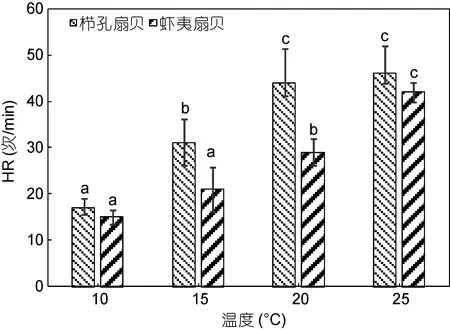
图2 不同温度下栉孔扇贝和虾夷扇贝的心率Fig.2 The HR of C. farreri and P. yessoensis in different temperatures
2.2 温度对栉孔扇贝和虾夷扇贝ABF的比较
栉孔扇贝和虾夷扇贝 ABF与温度呈正相关, 且温度对栉孔扇贝和虾夷扇贝 ABF均影响显著(图 3,P<0.05)。栉孔扇贝 ABF整体大于虾夷扇贝; 在10—25°C内, 栉孔扇贝变化范围为1.75—15.84cm/s2,虾夷扇贝变化范围为 0.99—7.41cm/s2(P<0.05)。栉孔扇贝在15—25°C范围内, 相邻两个温度设置下ABF无显著差异(P>0.05), 与最低温 10°C 差异显著(P<0.05); 虾夷扇贝则在10—20°C范围内, 相邻两个温度设置下 ABF无显著差异(P>0.05), 与最高温25°C 差异显著(P<0.05)。
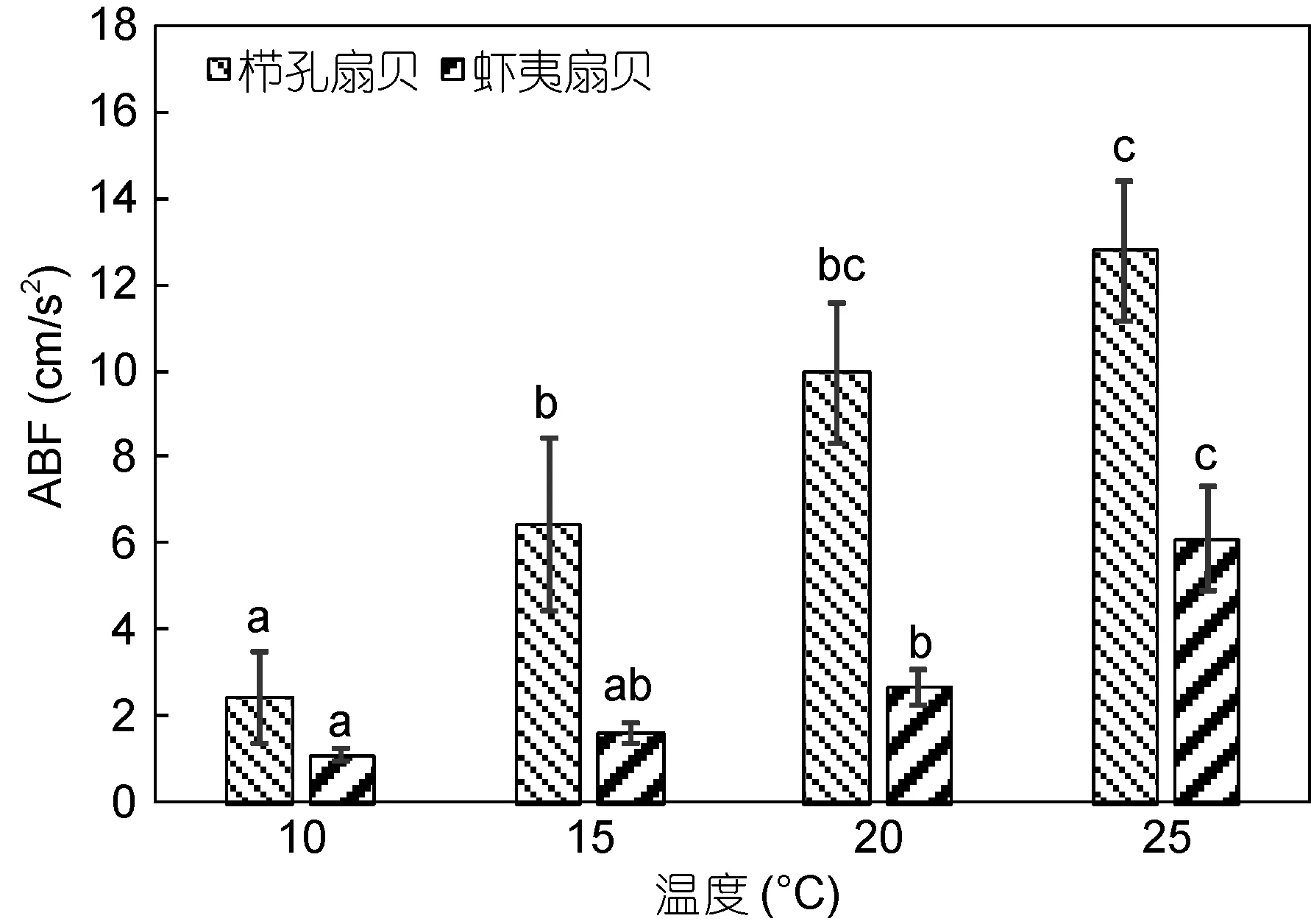
图3 不同温度下栉孔扇贝和虾夷扇贝的ABFFig.3 The ABF of C. farreri and P. yessoensis in different temperatures
2.3 温度对栉孔扇贝和虾夷扇贝血管PS及ED的影响
栉孔扇贝和虾夷扇贝的PS值随温度的增加呈上升趋势(见图4)。在同一实验温度下, 栉孔扇贝的PS大于虾夷扇贝; 在 10—25°C 内, 栉孔扇贝变化范围为 3.54—8.09cm/s, 虾夷扇贝变化范围为 2.32—8.85cm/s。栉孔扇贝在 10—20、15—25°C 内, 相邻两个温度设置下PS无显著差异(P>0.05), 20°C与最低温10°C 差异显著(P<0.05); 虾夷扇贝则在 10—20°C 范围内, 相邻两个温度设置下 PS有显著差异(P<0.05),20oC与最高温25°C无显著差异(P>0.05)。
温度对栉孔扇贝和虾夷扇贝的 ED影响不明显(见图 5)。在 10—25°C 内, 栉孔扇贝变化范围为1.51—3.15cm/s, 虾夷扇贝变化范围为1.09—4.23cm/s。栉孔扇贝在10—20°C内, 相邻两个温度设置下ED无显著差异(P>0.05), 20°C 和 25°C 与最低温 10°C 差异显著(P<0.05); 虾夷扇贝则在10—20°C内, 相邻两个温度设置下ED无显著差异(P>0.05), 20°C和25°C与最低温 10°C 差异显著(P<0.05)。
2.4 温度对栉孔扇贝和虾夷扇贝瞬时血流量的影响

图4 不同温度下栉孔扇贝和虾夷扇贝血管的PSFig.4 The PS of C. farreri and P. yessoensis in different temperatures

图5 不同温度下栉孔扇贝和虾夷扇贝血管的ED的比较Fig.5 The ED of C. farreri and P. yessoensis in different temperatures
栉孔扇贝和虾夷扇贝的 Max-IBF随温度升高呈增加的趋势(见图6); 同一温度下, 虾夷扇贝的Max-IBF大于栉孔扇贝。在实验温度梯度内栉孔扇贝的Max-IBF, 在10°C下最小值为0.098mL/s, 25oC下的最大值为 0.210mL/s, 20°C、25°C 与 10°C 间差异显著(P<0.05)。虾夷扇贝在实验温度梯度内, 10°C下的最小值为0.226mL/s, 20°C下出现峰值0.297mL/s, 25°C又略呈下降趋势, 实验温度梯度范围内血流量差异不显著(P>0.05)。
栉孔扇贝和虾夷扇贝的 Min-IBF变化趋势与最大瞬时趋势相近(见图 7)。在实验温度内, 栉孔扇贝在 10°C 下为其最小值, 25°C 为其最大值, 分别为0.047、0.071mL/s, 且温度范围内血流量差异不显著(P>0.05)。栉孔扇贝在 10°C 下为其最小值, 25°C 为其最大值, 分别为 0.084、0.133mL/s, 且温度范围内血流量差异不显著(P>0.05)。
2.5 温度对栉孔扇贝和虾夷扇贝RI及S/D的影响

图6 不同温度下栉孔扇贝和虾夷扇贝的Max-IBFFig.6 The Max-IBF of C. farreri and P. yessoensis in different temperatures

图7 不同温度下栉孔扇贝和虾夷扇贝的Min-IBFFig.7 The Min-IBF of C. farreri and P. yessoensis in different temperatures
温度对栉孔扇贝和虾夷扇贝的RI影响不明显(图8,P>0.05); 在10—25°C内, 栉孔扇贝RI变化范围为0.49—0.69, 虾夷扇贝 RI变化范围为0.42—0.54。栉孔扇贝在4个温度点的RI无显著的差异(P>0.05); 在虾夷扇贝中, RI整体差异不大, 但15°C与20°C之间的RI具有显著性差异(P<0.05)。
温度对栉孔扇贝和虾夷扇贝的 S/D影响不明显(图9,P>0.05), 10—25°C内, 栉孔扇贝S/D变化范围为2.28—2.83, 虾夷扇贝S/D变化范围为1.75—2.12。栉孔扇贝在4个温度点的S/D无显著的差异(P>0.05);在虾夷扇贝中, S/D 整体差异不大(P>0.05), 但 15°C与20°C之间的S/D具有显著性差异(P<0.05)。
2.6 栉孔扇贝和虾夷扇贝生理指标相关性对比分析
对四种基础生理指标进行相关性分析发现, 两种扇贝存在十分相近的规律。心率与血流加速度、收缩峰值血流速度均呈显著正相关, 即心率越快, 血流加速度越大, 收缩峰值血流速度越高。血流加速度与收缩峰值血流速度呈极显著正相关, 即血流加速度越大, 收缩峰值血流速度越高(表2, 表3)。

图8 不同温度下栉孔扇贝和虾夷扇贝的RIFig.8 The RI of C. farreri and P. yessoensis in different temperatures
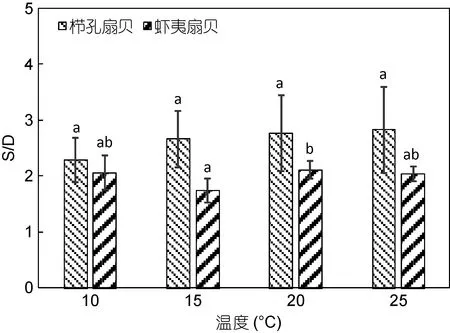
图9 不同温度下栉孔扇贝和虾夷扇贝的S/DFig.9 The S/D of C. farreri and P. yessoensis in differenttemperatures

表2 栉孔扇贝循环生理指标相关性分析Tab.2 Correlation result of the circulatory physiological index of C. farreri

表3 虾夷扇贝循环生理指标相关性分析Tab.3 Correlation result of the circulatory physiological index of P. yessoensis
3 讨论
3.1 多普勒超声成像技术的应用
反映心血管机能的循环系统生理学指标可有效地指示生物新陈代谢水平和机体机能状态。但是受监测技术的限制, 以往对贝类循环生理指标的研究仅限于心率, 研究方法多采用呼吸描记法(Trueman,1967; Brabyetal, 2006)、体积描记法(Dietzetal, 1980)和直接观察法(Harrison, 1977a, b), 其缺点是只能间接测定, 且需要破坏贝壳结构, 会对测定指标产生影响。本研究创新引入医用多普勒超声成像技术, 准确测量了扇贝心脏搏动特征、血液动力学以及血管机能等多个指标, 该技术对待测生物无创伤, 可重复连续获得血流生理数据, 具有安全、方便等优点。该技术的应用大大方便了贝类循环生理学的研究, 为下一步双壳贝类的循环生理学研究开辟了新出路。
3.2 温度变化对两种扇贝心脏机能和血流动力学特征的影响
扇贝心率的高低能反映出扇贝心脏的泵血能力,本实验中扇贝的心率与实验温度呈正相关, 这与其它双壳贝类(紫贻贝、河蚌、紫踵劈蚌)的研究结果一致(Nicholson, 2002; Pandolfoetal, 2009)。心率的高低与儿茶酚胺类激素的调控密切相关。温度升高可以显著提高栉孔扇贝和牡蛎血淋巴中儿茶酚胺的含量(Lacosteetal, 2001a, b; Chenetal, 2008), 儿茶酚胺通过儿茶酚胺-β受体-cAMP系统刺激心脏, 可刺激心肌细胞, 使心率加快, 收缩力增强, 传导速度增快,心输出量增加(Schlaichetal, 2005) 。该现象也已在鱼类、蟹类等其它生物的研究中得以证实, Campbell等(2007)研究结果表明鱼类心率提高能直接导致单位时间的心输出量增加, 血液循环速度加快, 使鱼类可应对较高的机体代谢水平。De Wachter等(1996)在研究不同温度对螃蟹心率、每搏输出量、动脉血管的流量中发现, 当温度从12°C升至20°C时, 心率、每搏输出量、动脉血管的流量显著增加。
与扇贝心率提升对应的是动脉血液加速度提高,继而血液循环速率提升。相对于血流加速度的显著增加, 在 15—25°C之间, 栉孔扇贝 PS、ED、Max-IBF和Min-IBF均基本保持稳定, 表明尽管血液输送总量增加, 但仍保持相对稳定的动力学状态; 虾夷扇贝在该温度段内血液动力学稳定状况相对较差, 收缩期峰值血流速度仅在 20—25°C下保持稳定, 舒张期血流速率在 25°C时已有显著升高, 最高血流量也出现下降趋势, 表明其血液动力学已出现异常迹象, 扇贝机体可能已进入高温胁迫应激状态。
3.3 温度变化对两种扇贝血管机能的影响
RI指标能反映血管某一横断面血流弹性阻力状态, 可以对血管机能和是否出现异常进行定量评价,当血液或血管机能异常时, 血管阻力增加, 舒张期血流减少, RI值增大; 当RI值增大至0.8以上时, 可以断定血液或血管已受到损害(胡庆鹰等, 2009)。S/D值已广泛应用于胎儿动脉状态的监测, 当 S/D≥3时,表明脐动脉血管出现异常(刘瑛等, 2005; 李仲瑞等,2012)。本实验结果表明, 栉孔扇贝和虾夷扇贝的 RI和 S/D值随着温度的升高而增大, 但变动范围较小,RI值在0.6以下, 变动范围0.1以内, S/D值变动范围在0.3—0.5, 结合其它循环生理指标可确定测得的RI和S/D值应处于扇贝的正常范围内, 扇贝血管没有器质性损伤, 血液循环机能正常。但指示扇贝血管出现异常的RI和S/D阈值是多少、脊椎动物的正常值范围是否适用于扇贝还需要开展进一步实验进行界定。
4 结论
一般来说, 生活在寒冷区域的无脊椎动物其新陈代谢速率较温暖区域的偏低, 其生态学意义是最大程度减少身体的能量损耗, 有助于其适应低温环境。栉孔扇贝为暖温型种类, 主要分布于我国黄渤海到东海沿岸以及日本(北海道)以南和朝鲜沿海(王祯瑞, 2002a), 适温范围为4—26°C, 20°C左右为其最适生长温度(王玲玲, 2006); 虾夷扇贝则为典型的冷水性种类, 自然分布区较栉孔扇贝更偏北, 主要分布在我国黄海北部和日本北部沿海、俄罗斯远东海及朝鲜半岛海域(王祯瑞, 2002b), 适温范围为 0—25°C,15°C为其最适生长温度(常亚青等, 2007)。两种扇贝的耐温性在循环系统生理特征上明显体现。虾夷扇贝HR、ABF和 PS均低于栉孔扇贝, 而 Max-IBF和Min-IBF均高于栉孔扇贝, 虾夷扇贝的血流阻力也要低于栉孔扇贝, 表明虾夷扇贝在较低的心脏和血流搏动节律下保持了高效的血液流通, 从而以相对较少的能量消耗维持了其机体代谢对血液循环的需求,这也与其冷水性的生态习性相适应。
王玲玲, 2006. 栉孔扇贝秋季苗种的培育及生长发育和摄食生理生态的初步研究. 青岛: 中国海洋大学硕士学位论文,13—15
王祯瑞, 2002a. 中国动物志 无脊椎动物 第三十一卷 软体动物门 双壳纲 珍珠贝亚目. 北京: 科学出版社, 175—177
王祯瑞, 2002b. 中国动物志 无脊椎动物 第三十一卷 软体动物门 双壳纲 珍珠贝亚目. 北京: 科学出版社, 244—245
刘 瑛, 郑忠宝, 呼新华, 2005. 彩色多普勒血流图监测胎儿脐动脉血流S/D比值异常的价值. 兵团医学, (3): 44—45
李仲瑞, 陶春梅, 2012. 脐血流 S/D值监测与评价. 中国现代医生, 50(14): 133—134
杨秀平, 肖向红, 2002. 血液生理. 见: 杨秀平主编. 动物生理学. 北京: 高等教育出版社, 72—82
胡庆鹰, 崔 炜, 吴格日勒等, 2009. 彩色多普勒超声检查肾动脉阻力指数、搏动指数的研究进展. 中国医药导报,6(23): 76—77
高 菲, 2005. 环境胁迫对滤食性贝类生理生态学特征的影响.青岛: 中国科学院海洋研究所硕士学位论文, 10—16
常亚青, 陈晓霞, 丁 君等, 2007. 虾夷扇贝(Patinopecten yessoensis) 5个群体的遗传多样性. 生态学报, 27(3):1145—1152
Bakhmet I N, Khalaman V V, 2006. Heart rate variation patterns in some representatives of Bivalvia. Biology Bulletin, 33(3):276—280
Braby C E, Somero G N, 2006. Following the heart: temperature and salinity effects on heart rate in native and invasive species of blue mussels (genus Mytilus). Journal of Experimental Biology, 209(13): 2554—2566
Burnett N P, Seabra R, de Pirro M et al,2013. An improved noninvasive method for measuring heartbeat of intertidal animals. Limnology and Oceanography: Methods, 11(2):91—100
Campbell H A, Fraser K P P, Peck L S et al, 2007. Life in the fast lane: the free-ranging activity, heart rate and metabolism of an Antarctic fish tracked in temperate waters. Journal of Experimental Marine Biology and Ecology, 349(1):142—151
Chen M Y, Yang H S, Xu B et al, 2008. Catecholaminergic responses to environmental stress in the hemolymph of Zhikong scallop Chlamys farreri. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology,309A(6): 289—296
De Wachter B, McMahon B R, 1996. Temperature effects on heart performance and regional hemolymph flow in the crab Cancer magister. Comparative Biochemistry and Physiology Part A: Physiology, 114(1): 27—33
Dietz T H, Tomkins R U, 1980. The effect of temperature on heart rate of the freshwater mussel, Ligumia subrostrata.Comparative Biochemistry and Physiology Part A:Physiology, 67(2): 269—271
Haefner Jr P A, Sheppard B, Barto J et al, 1996. Application of ultrasound technology to molluscan physiology:Noninvasive monitoring of cardiac rate in the blue mussel,Mytilus edulis Linnaeus, 1758. Journal of Shellfish Research,15(3): 685—688
Harrison P T C, 1977a. Laboratory induced changes in the heart rate of Lymnaea stagnalis (L.). Comparative Biochemistry and Physiology Part A: Physiology, 58(1): 43—46
Harrison P T C, 1977b. Seasonal changes in the heart rate of the freshwater pulmonate Lymnaea stagnalis (L.). Comparative Biochemistry and Physiology Part A: Physiology, 58(1):37—41
Kholodkevich S V, Kuznetsova T V, Trusevich V V et al, 2009.Peculiarities of valve movement and of cardiac activity of the bivalve mollusc Mytilus galloprovincialis at various stress actions. Journal of Evolutionary Biochemistry and Physiology, 45(4): 524—526
Lacoste A, Jalabert F, Malham S K et al, 2001a. Stress and stress-induced neuroendocrine changes increase the susceptibility of juvenile oysters (Crassostrea gigas) to Vibrio splendidus. Applied and Environmental Microbiology,67(5): 2304—2309
Lacoste A, Malham S K, Cueff A et al, 2001b. Stress-induced catecholamine changes in the hemolymph of the oyster Crassostrea gigas. General and Comparative Endocrinology,122(2): 181—188
Nicholson S, 2002. Ecophysiological aspects of cardiac activity in the subtropical mussel Perna viridis (L.) (Bivalvia:Mytilidae). Journal of Experimental Marine Biology and Ecology, 267(2): 207—222
Novelo N D. Tiersch T R, 2012. A review of the use of ultrasonography in fish reproduction. North American Journal of Aquaculture, 74(2): 169—181
Pandolfo T J, Cope W G, Arellano C, 2009. Heart rate as a sublethal indicator of thermal stress in juvenile freshwater mussels. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 154(3): 347—352
Schlaich M P, Kaye D M, Lambert E et al, 2005. Angiotensin II and norepinephrine release: interaction and effects on the heart. Journal of Hypertension, 23(5): 1077—1082
Trueman E, 1967. Activity and heart rate of bivalve molluscs in their natural habitat. Nature, 214(5090): 832—833

