初夏南黄海浮游动物功能群丰度年际变化*
时永强 孙 松 李超伦 张光涛
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室 青岛 266071; 2. 中国科学院大学 北京 100049;3. 中国水产科学研究院黄海水产研究所 农业部海洋渔业可持续发展重点实验室 青岛 266071;4. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266000)
在全球很多区域都能够找到大量证据证实生态系统对气候变化产生了生态响应(Walther et al, 2002),其中海洋浮游生态系统对气候变化尤为敏感(Edwards et al, 2004)。由于浮游动物具有世代短、随波逐流及对环境变化敏感等特点, 许多研究利用浮游动物的长期变化来反映气候变化(Beaugrand et al,2002; Hays et al, 2005)。浮游动物在海洋生态系统食物网中起到承上启下的作用, 其数量及种类的变化会影响鱼类等高营养层次生物(Beaugrand et al,2003)。因此研究浮游动物对环境变化的响应, 对了解海洋生态系统是否发生稳态转换、评价生态系统是否健康、制定海洋管理政策等均具有非常重要的意义(Perry et al, 2004)。
受气候变化和人类活动影响, 近几十年来黄海海温持续上升(Lin et al, 2005; Belkin, 2009; Huang et al, 2012), 并且溶解氧、N、P、Si营养盐浓度等环境因子发生巨大变化(Lin et al, 2005; Fu et al, 2012), 另外赤潮发生频率和范围、鱼类资源量、大型水母暴发频率和规模等也发生持续变化(赵宪勇, 2006; Zhang et al, 2007; Zhou et al, 2008; Dong et al, 2010), 以上都说明黄海环境发生了很大改变。但浮游动物在不同时期的年际变化及其对环境变化的响应在南黄海却鲜有报道, 仅见长江口海域浮游动物优势种对气候变暖的响应(李云等, 2009; Zhang et al, 2010; Xu et al,2011, 2014), 及北黄海浮游动物群落结构和南黄海浮游动物优势种数量分布的年间比较等研究(杨青等,2012; 陈峻峰等, 2013; 邹艺伟等, 2013)。
将浮游动物按照其在海洋生态系统中不同的作用和地位, 划分到不同类群中, 这些功能相同或相似的种类组成的同一类群即是浮游动物功能群。利用功能群的方法可以有效简化食物网, 易于模拟和较全面了解浮游动物群落时空变化(Sun et al, 2010)。本文根据南黄海1959年和2000—2009年6月份的航次调查数据, 结合环境变化资料, 将浮游动物以功能群的形式来研究分析不同浮游动物功能群丰度的年际变化, 以期为黄海浮游动物长期变化研究提供参考资料。
1 材料与方法
1.1 研究海域及样品来源
浮游动物样品来自1959年、2000年—2003年、2007年和 2009年的 6月在黄海海域(34°—37°N, 120°—124°E)进行的大面调查, 其中有6个站位在所有调查航次中均进行了采样, 为保证站位统一性, 本研究选取这6个相同站位来进行比较分析, 采样站位的位置见图1。黄海不同区域具有不同的水文环境。根据调查站位与黄海冷水团位置之间的关系, 可将6个站位划分到3个研究区域中: WY、MY、EY, 三者分别代表西部浅水区、中部锋面区和东部冷水团区(图1)。

图1 研究区域及采样站位分布图Fig.1 Map of the study area and locations of sampling stations
温度和盐度均在每个调查站位现场测定。1959年调查中, 在0m层以下的各个标准水层及底层的海水温度利用颠倒温度表进行测量, 海水盐度数据根据现场测定的海水氯度值间接计算获得。在2000年之后的调查中, 利用Sea-Bird CTD装置(2000—2003年型号为SBE-19, 2007年和2009年型号为SBE-25)现场测量水体温度和盐度的垂直剖面。本研究中, 海水的表层温度和表层盐度均选在5m水层处测定, 而海水的底层温度和盐度均在能达到的最深水层处测定。利用大型浮游生物网(网口面积0.5m2, 网孔直径505μm)采集浮游动物样品, 在每个站位从近海底到水面垂直拖网, 拖网速度约为1m/s。样品采集后, 立即用5%的甲醛海水溶液固定并保存带回。
1.2 样品鉴定及功能群划分
在实验室, 对样品中浮游动物进行鉴定, 对不同种类浮游动物的体长测定参照 Uye(1982)。大型浮游动物, 如磷虾类、毛颚类等, 在解剖镜下全部计数,并测量相应体长。其余样品进行分样处理后(1/2—1/5), 在解剖镜下尽可能鉴定到种, 全部计数并测量体长。
根据其在食物网中具有的不同功能和作用, 黄海浮游动物可以划分到 6个功能群: 大型甲壳类(giant crustaceans)、大型桡足类(large copepods)、小型桡足类(small copepods)、毛颚类(chaetognaths)、水母类(medusae)和海樽类(salps)(Sun et al, 2010)。前三个功能群是鱼类的主要食物来源, 根据其体长大小划分, 分别包含体长为>5mm、2—5mm和<2mm的饵料浮游动物个体。由于小型桡足类功能群在大型浮游生物网中的捕获率较低(王荣等, 2003), 不能真实反映其丰度, 因此本研究只进行其它五个功能群的分析和讨论。毛颚类功能群在食物网中具有两种作用:作为肉食性浮游动物, 毛颚类与鱼类竞争摄食次级生产者; 同时毛颚类也是鱼类的一个饵料来源。水母类功能群仅包括通过浮游生物网采集的小型水母,它们摄食鱼卵、仔鱼及其它浮游动物。海樽类功能群与其它浮游动物存在竞争关系, 主要摄食浮游植物,但高营养层次的海洋生物却不能有效地利用海樽类作为食物来源。各浮游动物功能群在各站位的丰度均以ind/m2表示。
本研究中的调查年份并不连续, 但为方便描述,我们用 2000—2009年来代表本研究中调查采样的2000—2003年、2007年和 2009年, 进而进行 1959年和 2000—2009年两个时期的浮游动物功能群丰度的年际比较。
2 结果
2.1 环境条件
在黄海 3个研究区域分别分析环境条件的年际变化。虽然2000—2009年间6月份南黄海表层海水温度存在一定波动, 但大体上均高于 1959年的表层水温(图 2a)。1959年各区域底层温度与 2000—2009年相比年际差异不显著, 受黄海冷水团影响, WY区域底层温度要明显高于其它两个区域(图2b)。在WY和 MY区域, 1959年的表层盐度和底层盐度均低于2000—2009年的调查年份; 但在EY区域, 1959年的表、底层盐度相对较高, 均与 2000—2009年盐度最高值相近(图2c, 图2d)。受近岸淡水输入及外海黄海暖流水影响, 沿WY—MY—EY方向, 表、底层海水盐度逐渐升高。
2.2 浮游动物功能群丰度的年际变化
图 3展示了浮游动物功能群丰度在不同区域的年际变化。大型甲壳类功能群丰度较高, 1959年大型甲壳类高丰度值主要分布在WY和MY区域, 而2000—2009年调查年份高丰度主要发生在MY和EY区域,最大丰度发生在2001年EY区域。总体上看, 大型甲壳类丰度波动较大, 尤其在 EY区域波动幅度最大;大型甲壳类丰度在1959年和2000—2009年两个时期无明显差异, 最低丰度发生在 2003年。大型桡足类功能群丰度最高, 1959年大型桡足类在三个研究区域分布较均匀, 丰度范围是 912—1330ind/m2, 均显著低于 2000—2009年调查年份的三个区域(2035—24500ind/m2, P<0.05)。在 2000—2009年, 大型桡足类功能群分布同样相对较均匀, 最大丰度发生在2000年 EY区域。毛颚类功能群丰度较高, 在 1959年主要分布在WY和MY区域; 在2000—2009年, 主要分布在MY区域, 最大丰度发生在2003年MY区域。总体上看, 毛颚类功能群丰度波动较大, 尤其在MY区域波动幅度最大; 毛颚类丰度在 1959年和2000—2009年两个时期无明显差异, 最低丰度发生在2000年。水母类功能群在所有调查年份均较少出现, 主要分布在WY区域, 且丰度波动较大。1959年、2002年和2003年均只有一个站位出现小型水母, 且丰度很低, 而2009年虽然仅有一个站位采集到水母,但丰度较高(图 4a)。水母类功能群丰度在 2007年出现暴发式增加, 其平均丰度是 2001年(丰度次高年)平均丰度的4.8倍。海樽类功能群仅在1959年和2007年采集到, 1959年海樽类功能群由贝环纽鳃樽(Cyclosalpa bakeri)构成, 仅分布在 MY和 EY区域,丰度范围是 146—284ind/m2。在 2007年, 梭形纽鳃樽(Salpa fusiformis)在南黄海大面积暴发, 其丰度非常高, 是 1959年海樽类平均丰度的88.5倍, 主要分布在WY区域和EY区域。

图2 南黄海6月份温度(°C)和盐度的年际变化Fig.2 Interannual variations of sea temperature (°C) and salinity in the southern Yellow Sea in June
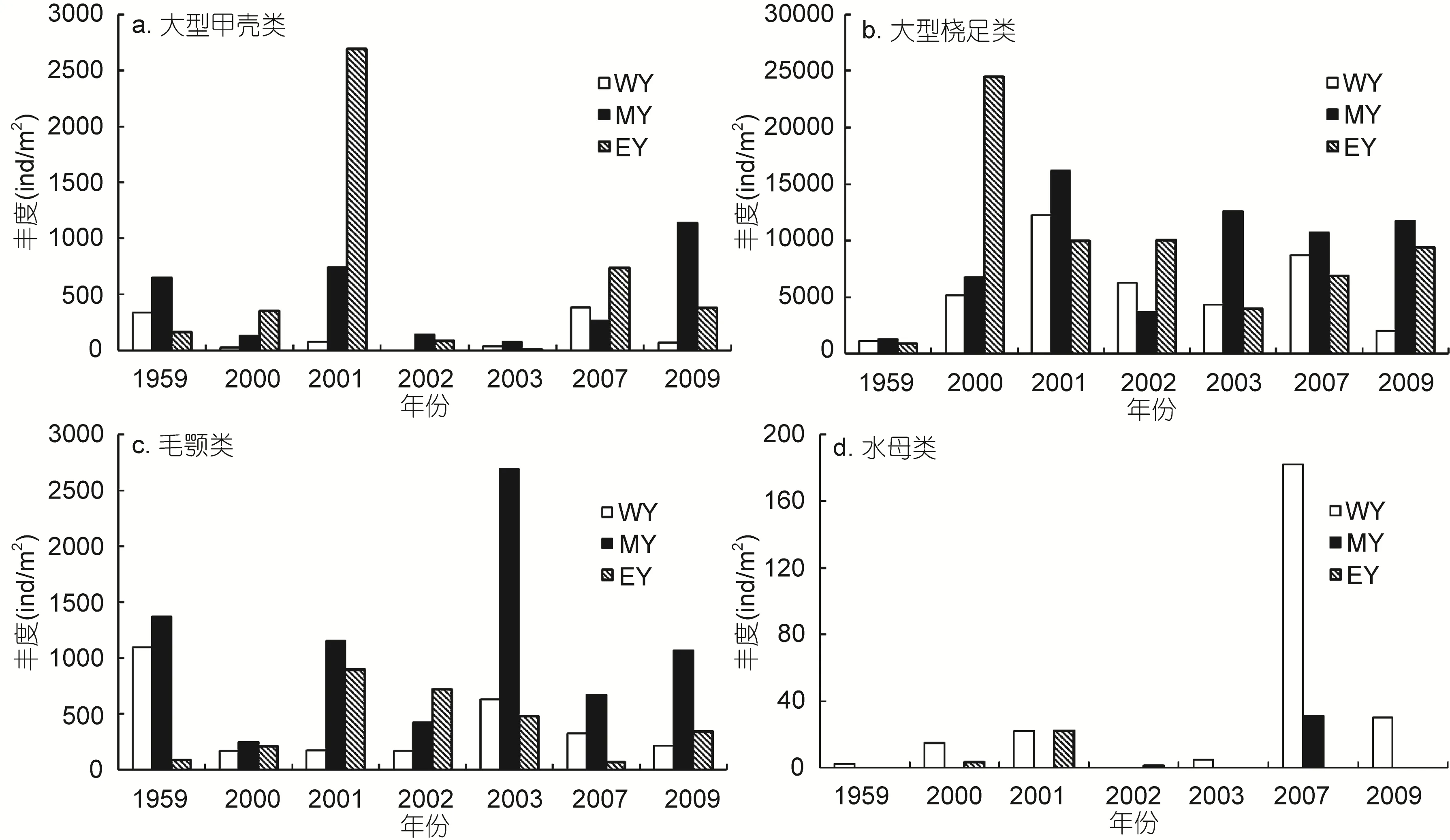
图3 南黄海6月份浮游动物功能群丰度(ind/m2)年际变化Fig.3 Interannual changes in abundance (ind/m2) of zooplankton functional groups in the southern Yellow Sea in June
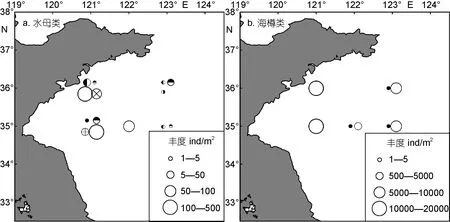
图4 南黄海水母类和海樽类功能群丰度的时空分布Fig.4 Temporal-spatial distributions of small jellyfish and salps functional groups in the southern Yellow Sea
3 讨论
3.1 黄海环境条件长期变化
Huang等(2012)从黄东海过去141年表层海水温度(SST)序列中识别出4个时期, 其中1945—1976年为具有降温趋势的暖期, 1977—2010年为有升温趋势的暖期, 且后者升温显著。根据卫星遥感数据, 黄渤海 SST在 1982—2006年间上升了 0.67°C(Belkin,2009), 黄海 36°N 断面实测数据显示, 黄海 SST在1976—2000年间的上升速率是0.094°C/年(Lin et al,2005)。综合来看, 与 1959年相比, 黄海表层水温在2000年之后有所升高(图 5)。本研究中, 2000—2009年6月调查站位的SST明显高于1959年6月(图2a),但图5中显示两个时期SST差异较小, 一方面原因是1959年SST相对较高, 导致两个时期相比SST增温较缓(图 5), 另一方面原因可能是黄海 6月和全年的SST年际变化趋势不一致, 并且研究区域不同也可能造成一定影响。黄海底层海水温度同样具有一定的年际变化, 但与SST相比, 其升温趋势较弱且周期性更强(Lin et al, 2005; Park et al, 2011)。黄海海水盐度在1976—2000年间轻微上升, 但趋势不显著(Lin et al,2005)。本研究中, 2000—2009年近岸区域海水盐度相对较高, 与渤海海水盐度年际上升趋势一致(Lin et al,2001)。总之, 与 1959年相比, 黄海海水的温度和盐度在2000—2009年均发生了一定变化。

图5 文献报道黄海表层水温及距平的变化趋势Fig.5 Variation trends of surface seawater temperature and anomaly in the Yellow Sea using published sources
人类活动会影响海洋生态系统, 尤其是在近岸区域(Halpern et al, 2008)。Hoagland 等(2008)指出黄海和东海在所有海洋大生态系统研究区域中具有最高的经济活力, 这也造成了严重的海洋环境退化。过度捕捞导致黄海 鳀 鱼(Engraulis japonicus)等鱼类资源量急剧下降(赵宪勇, 2006), 并且发生许多鱼类优势种体长减小、营养级降低等趋势(Zhang et al,2007)。沿岸经济的快速发展导致环境发生改变, 1976—2000年间, 黄海年平均溶解性无机氮浓度上升了2.86μmol/L, 同时溶解氧、磷酸盐和硅酸盐的浓度分别降低 56.74、0.10 和 3.77μmol/L (Lin et al, 2005), 而在2007—2008年, 黄海N、P和Si的营养盐浓度均发生显著增加(Fu et al, 2012)。在近岸海域, 伴随营养盐增加, 浮游植物数量增加, 硅藻在浮游植物群落中比例降低, 而甲藻比例升高, 从数量和范围上有害赤潮的发生均有巨大升高(Zhou et al, 2008; Fu et al,2012)。另外, 在中国海域, 近十几年来水母发生大面积暴发(Dong et al, 2010)。以上都说明了在本研究的两个调查时期间, 黄海环境已经发生了巨大改变。
3.2 浮游动物功能群丰度的年际变化
与 1959年相比, 在长江口海域, 浮游动物暖温种如中华哲水蚤(Calanus sinicus)、太平洋磷虾(Euphausia pacifica)、强壮箭虫(Sagitta crassa)的分布和丰度在2002年之后均降低(李云等, 2009; Xu et al,2011, 2014), 而在北黄海, 浮游动物暖温种和暖水种丰度在 2009—2012年均升高(杨青等, 2012; 邹艺伟等, 2013), 可能原因是海温升高导致长江口海域暖温种分布向北退缩, 丰度降低, 并且物候提前(Xu et al,2011), 并导致北黄海暖温种丰度增加, 暖水种北移(杨青等, 2012)。本研究中, 南黄海各浮游动物功能群在1959年和2000—2009年两个时期的丰度年际变化存在一定差异。
大型甲壳类功能群丰度虽然比大型桡足类功能群低, 但前者个体较大, 生物量较高, 是鱼类的重要饵料(孟田湘, 2003)。大型甲壳类的优势种是太平洋磷虾和细足法(Themisto gracilipes), 主要分布在黄海中部区域(中国科学院海洋研究所浮游生物组,1977)。太平洋磷虾斑块分布较明显(Sun et al, 2011),正是由于在 2001年 s3站位采集到大量太平洋磷虾,导致2001年大型甲壳类丰度在EY区域非常高。在长江口海域, 5月份太平洋磷虾在2002—2012年丰度显著低于 1959年(Xu et al, 2014); 在南黄海中部,1959年5月份太平洋磷虾丰度与1998年相当, 但显著低于2010年(陈峻峰等, 2013)。本研究中大型甲壳类丰度在2000—2009年6月年际波动较大, 与1959年相比无明显差异, 说明南黄海大型甲壳类在两个时期丰度变化较小。
大型桡足类功能群中中华哲水蚤占据绝对优势地位。受表层海水温度上升影响, 在长江口海域与1959年相比, 中华哲水蚤在2005年的春季丰度高峰发生时间和峰值消退时间均提前近一个月(Xu et al,2011)。在黄海东部, 中华哲水蚤在20世纪90年代5月份的丰度显著高于其80年代5月份丰度(Kang et al,2007); 而在黄海中部, 5月份中华哲水蚤在1959年丰度和1982年相近, 高于1998年, 但显著低于2010年丰度(陈峻峰等, 2013)。以上研究说明中华哲水蚤对环境变化具有较敏感响应。本研究中, 大型桡足类丰度在1959年要显著低于2000—2009年, 而在后一时期虽然海温存在波动, 但其丰度年际差异较小(Shi et al, 2015), 因此海水温度上升对中华哲水蚤种群发展的促进作用可能并不是影响其丰度高低的主要决定因素, 营养盐浓度升高导致浮游植物增多促进上行作用及过度捕捞导致鱼类资源急剧下降从而降低捕食效应这两种因素更能解释大型桡足类功能群在2000—2009年的高丰度(Kang et al, 2007)。
毛颚类功能群的优势种是强壮箭虫和拿卡箭虫(Sagitta nagae)。强壮箭虫是较喜低温的暖温种, 对环境变暖具有一定响应, 如 1959年冬季强壮箭虫在长江口丰度和出现率均较高, 而在 2002年冬季强壮箭虫几乎在长江口海域没有分布(李云等, 2009)。在黄海中部, 5月份强壮箭虫在1959年丰度要低于1982年, 而明显高于1998年和2010年(陈峻峰等, 2013)。本研究中, 毛颚类功能群丰度在 2003年最高, 原因是在该年采集到了大量拿卡箭虫。如果去除拿卡箭虫丰度, 毛颚类功能群在 1959年丰度要高于 2000—2009年, 可能原因是强壮箭虫对海水温度变暖产生响应, 在南黄海丰度降低, 而在北黄海丰度增加(邹艺伟等, 2013)。
水母类功能群在调查中出现率较低, 且丰度很低。至少从20世纪70年代初开始, 在全球许多海域均出现胶质浮游动物水母类数量的增加甚至是暴发现象(Purcell et al, 2007; Condon et al, 2013)。除大型水母近年来在黄海暴发外(Dong et al, 2010), 小型水母也出现数量增多现象, 如胶州湾小型水母的丰度在 2001—2009年比在 1991—2000年增加了近 5倍(Sun et al, 2012)。本研究中, 小型水母的出现率和丰度在2000—2009年期间有所升高, 可能是温度升高、富营养化、沿岸建设改变等原因导致水母类增加(Purcell et al, 2007; Sun et al, 2012)。水母类功能群在2007年丰度最高, 可能与当年水温相对较高有关(Shi et al, 2015)。
海樽类功能群仅在1959年和2007年采集到, 且种类不同, 分别是贝环纽鳃樽和梭形纽鳃樽。贝环纽鳃樽是黄海冷水团指示种(中国科学院海洋研究所浮游生物组, 1977), 但除了 1959年全国海洋综合调查以外, 近年来仅在北黄海有过零星报道(陈介康, 1978;朱延忠, 2008), 是否因为海温升高, 其分布范围北移还需要进一步验证。梭形纽鳃樽是通过暖流入侵进入黄海的, 由于 2006—2007年具有较高水温, 梭形纽鳃樽在 2007年冬春季的黄海一直保有种群, 并在春夏季暴发(Liu et al, 2012)。
浮游动物的生物量和丰度在2000—2001年要高于 1959年(左涛, 2003), 从本研究结果来看, 大型桡足类功能群丰度的显著增加是造成两个时期浮游动物丰度和生物量差异的主要原因。受历史原因所限,本文仅获取并分析2000—2009年及1959年6月份南黄海大型浮游生物网采样资料, 今后仍需开展时期更广、季节更多的浮游动物群落变化研究, 以期较全面了解浮游动物群落年际变化及对环境变化的响应。
4 结语
本研究中, 南黄海各浮游动物功能群在 1959年和2000—2009年两个时期具有不同的年际变化。大型甲壳类丰度波动幅度较大, 在两个研究时期差异不明显; 而以中华哲水蚤为优势种的大型桡足类丰度在2000—2009年显著高于1959年, 可能与营养盐浓度升高和鱼类过度捕捞有关; 受海温升高影响, 毛颚类中强壮箭虫丰度在 2000—2009年降低, 小型水母类在 2000—2009年丰度和出现率均升高, 而海樽类种群也在两个时期发生了明显变化。各浮游动物功能群中不同物种及中型浮游生物网中的小型桡足类功能群丰度年际变化及对环境变化响应的研究工作,需要今后进一步开展。
致谢 感谢老一辈科研工作者及本课题组吉鹏老师等人的现场采样工作, 感谢“北斗号”考察船全体工作人员在采样过程中给予的无私帮助, 感谢杨波老师对浮游动物样品的鉴定。谨致谢忱。
王 荣, 王 克, 2003. 两种浮游生物网捕获性能的现场测试.水产学报, 27(增刊): 98—102
中国科学院海洋研究所浮游生物组, 1977. 中国近海浮游生物的研究. 见: 全国海洋综合调查报告第八册. 天津: 海洋综合调查办公室出版, 1—159
左 涛, 2003. 东、黄海浮游动物群落结构研究. 青岛: 中国科学院海洋研究所博士学位论文, 64—65
朱延忠, 2008. 夏、冬季北黄海大中型浮游动物群落生态学研究. 青岛: 中国海洋大学硕士学位论文, 18—25
李 云, 徐兆礼, 高 倩, 2009. 长江口强壮箭虫和肥胖箭虫的丰度变化对环境变暖的响应. 生态学报, 29(9):4773—4780
杨 青, 王真良, 樊景凤等, 2012. 北黄海秋、冬季浮游动物多样性及年间变化. 生态学报, 32(21): 6747—6754
邹艺伟, 杨 青, 李全宝等, 2013. 北黄海浮游动物群落结构及年间比较. 海洋环境科学, 32(5): 683—687
陈介康, 1978. 在黄海北部发现的两种纽鳃樽. 动物学杂志, 2:13—16
陈峻峰, 左 涛, 王秀霞, 2013. 南黄海浮游动物主要种类数量分布年间比较. 海洋学报, 35(6): 195—203
孟田湘, 2003. 黄 海中南部 鳀 鱼各发育阶段对浮游动物的摄食.海洋水产研究, 24(3): 1—9
赵宪勇, 2006. 黄海鳀鱼种群动力学特征及其资源可持续利用.青岛: 中国海洋大学博士学位论文, 9—18
Beaugrand G, Brander K M, Lindley J A et al, 2003. Plankton effect on cod recruitment in the North Sea. Nature,426(6967): 661—664
Beaugrand G, Reid P C, Ibañez F et al, 2002. Reorganization of North Atlantic marine copepod biodiversity and climate.Science, 296(5573): 1692—1694
Belkin I M, 2009. Rapid warming of Large Marine Ecosystems.Progress in Oceanography, 81(1—4): 207—213
Condon R H, Duarte C M, Pitt K A et al, 2013. Recurrent jellyfish blooms are a consequence of global oscillations.Proceedings of the National Academy of Sciences of the United States of America, 110(3): 1000—1005
Dong Z J, Liu D Y, Keesing J K, 2010. Jellyfish blooms in China:Dominant species, causes and consequences. Marine Pollution Bulletin, 60(7): 954—963
Edwards M, Richardson A J, 2004. Impact of climate change on marine pelagic phenology and trophic mismatch. Nature,430(7002): 881—884
Fu M Z, Wang Z L, Pu X M et al, 2012. Changes of nutrient concentrations and N:P:Si ratios and their possible impacts on the Huanghai Sea ecosystem. Acta Oceanologica Sinica,31(4): 101—112
Halpern B S, Walbridge S, Selkoe K A et al, 2008. A global map of human impact on marine ecosystems. Science, 319(5865):948—952
Hays G C, Richardson A J, Robinson C, 2005. Climate change and marine plankton. Trends in Ecology & Evolution, 20(6):337—344
Hoagland P, Jin D, 2008. Accounting for marine economic activities in large marine ecosystems. Ocean & Coastal Management, 51(3): 246—258
Huang D J, Ni X B, Tang Q S et al, 2012. Spatial and temporal variability of sea surface temperature in the Yellow Sea and East China Sea over the past 141 years. In: Wang S Y ed.Modern Climatology. In Tech, 213—234
Kang J H, Kim W S, Jeong H J et al, 2007. Why did the copepod Calanus sinicus increase during the 1990s in the Yellow Sea?Marine Environmental Research, 63(1): 82—90
Lin C, Ning X, Su J et al, 2005. Environmental changes and the responses of the ecosystems of the Yellow Sea during 1976—2000. Journal of Marine Systems, 55(3—4): 223—234
Lin C L, Su J L, Xu B R et al, 2001. Long-term variations of temperature and salinity of the Bohai Sea and their influence on its ecosystem. Progress in Oceanography, 49(1—4):7—19
Liu Y Q, Sun S, Zhang G T, 2012. Seasonal variation in abundance, diel vertical migration and body size of pelagic tunicate Salpa fusiformis in the Southern Yellow Sea.Chinese Journal of Oceanology and Limnology, 30(1):92—104
Park S, Chu P C, Lee J H, 2011. Interannual-to-interdecadal variability of the Yellow Sea Cold Water Mass in 1967—2008: Characteristics and seasonal forcings. Journal of Marine Systems, 87(3—4): 177—193
Perry R, Batchelder H, Mackas D L et al, 2004. Identifying global synchronies in marine zooplankton populations:issues and opportunities. ICES Journal of Marine Science,61(4): 445—456
Purcell J E, Uye S I, Lo W T, 2007. Anthropogenic causes of jellyfish blooms and their direct consequences for humans: a review. Marine Ecology Progress Series, 350: 153—174
Shi Y Q, Sun S, Zhang G T et al, 2015. Distribution pattern of zooplankton functional groups in the Yellow Sea in June: a possible cause for geographical separation of giant jellyfish species. Hydrobiologia, 754(1): 43—58
Sun S, Huo Y Z, Yang B, 2010. Zooplankton functional groups on the continental shelf of the yellow sea. Deep-Sea Research Part II, 57(11—12): 1006—1016
Sun S, Li Y H, Sun X X, 2012. Changes in the small-jellyfish community in recent decades in Jiaozhou Bay, China.Chinese Journal of Oceanology and Limnology, 30(4):507—518
Sun S, Tao Z C, Li C L et al, 2011. Spatial distribution and population structure of Euphausia pacifica in the Yellow Sea(2006—2007). Journal of Plankton Research, 33(6):873—889
Uye S I, 1982. Length-weight relationships of important zooplankton from the Inland Sea of Japan. Journal of the Oceanographical Society of Japan, 38(3): 149—158
Walther G-R, Post E, Convey P et al, 2002. Ecological responses to recent climate change. Nature, 416(6879): 389—395
Xu Z L, Ma Z L, Wu Y M, 2011. Peaked abundance of Calanus sinicus earlier shifted in the Changjiang River (Yangtze River) Estuary: a comparable study between 1959, 2002 and 2005. Acta Oceanologica Sinica, 30(3): 84—91
Xu Z L, Zhang D, 2014. Dramatic declines in Euphausia pacifica abundance in the East China Sea: response to recent regional climate change. Zoological Science, 31(3): 135—142
Zhang B, Tang Q S, Jin X S, 2007. Decadal-scale variations of trophic levels at high trophic levels in the Yellow Sea and the Bohai Sea ecosystem. Journal of Marine Systems,67(3—4): 304—311
Zhang G T, Sun S, Xu Z L et al, 2010. Unexpected dominance of the subtropical copepod Temora turbinata in the temperate Changjiang river estuary and its possible causes. Zoological Studies, 49(4): 492—503
Zhou M J, Shen Z L, Yu R C, 2008. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River. Continental Shelf Research,28(12): 1483—1489

