MTDH、miR-26a与肿瘤关系的研究进展
MTDH、miR-26a与肿瘤关系的研究进展
杨晨晨1综述卢晓梅2审校
(1新疆医科大学, 乌鲁木齐830011;2新疆医科大学临床医学研究院, 乌鲁木齐830054)
中图分类号:R73-34文献标识码:A
doi:10.3969/j.issn.1009-5551.2015.01.032
目前,肿瘤相关基因的研究仍然是肿瘤研究的热点与难点。临床研究表明,肿瘤细胞信号通路中的特定基因的扩增/突变/表达状态与靶向、化疗药物的有效性密切相关。肿瘤分子标记物的检测有助于发现新发肿瘤,临床上检测特定基因的异常改变情况,能针对性地为每位患者量身定做一套最适合的治疗方案,从而最大程度地提高治疗的有效率,减少药物的毒副作用,避免用药不当贻误治疗时机。同时,分子标记物的检测可以对相关肿瘤预后进行评价。找到1个或多个与某个肿瘤相关的基因,有助于肿瘤的早期诊断、治疗方案的选择及判断预后。肿瘤转移是恶性肿瘤中普遍存在的现象,同时也是治疗失败和导致患者死亡的主要原因之一。肿瘤的转移是癌细胞与宿主细胞相互作用的复杂过程,由一系列复杂的基因调控系统所组成。因此,几年来对于肿瘤分子生物学的研究重点逐渐转至肿瘤转移基因与抑制肿瘤转移基因,并对这些基因的调控因子和转移过程中的作用机制进行研究,期望通过揭示肿瘤转移在基因水平的本质,为改进肿瘤的诊断方法和治疗手段提供依据。MTDH基因又称星形细胞提升基因-1(astrocyte elevated gine-1,AEG-1)、LYRIC是2002年首次克隆出来的新基因。MTDH基因定位在人类8号染色体上(8q22),由于其能帮助肿瘤细胞紧贴上远距离的血管,因此对于癌症的扩散和转移意义重大[1]。微小RNA(MicroRNAs,miRNAs)是一类由22~23个核苷酸组成的具有调控功能的非编码小分子RNA,miRNAs通过与mRNA的3’-UTRs结合而发挥调控作用[2]。有的miRNAs通常在肿瘤中表达下调,发挥着抑癌基因的作用,而有的miRNAs则起着癌基因的作用[3-4]。研究表明,miR-26a抑制鼻咽癌、乳腺癌、肝癌细胞的增殖[5-7],但却促进胶质瘤细胞的增殖[8-9]。miR-26a可能在不同的肿瘤和不同的组织学类型中发挥着不同的作用。在Target Scan Human查到miR-26a的下游靶基因是MTDH。本文就MTDH与miR-26a在恶性肿瘤中的作用以及MTDH与miR-26a关系作一综述。
1MTDH与在恶性肿瘤中作用的研究进展
1.1MTDH基因的结构与细胞定位MTDH最初在人胚胎初级星形胶质细胞中被发现,位于与多种恶性肿瘤发生密切相关的人类8号染色体(8q22)上,其启动区无TATA或CAAT,富含GC和多个SPI基序[10]。MTDH由 12 个外显子和 11个内含子组成[11]。MTDH作为一种紧密连接蛋白,其同源物在鼠体内也被克隆,并被命名为LYRIC(3D3/Lyric)。MTDH 的cDNA,包括poly-A 尾,由3 611个碱基组成,其开放阅读框架220~1 968 bp,编码582个氨基酸,分子量64 ku,等电点是 9.33。MTDH在胞膜、胞质(如内质网、核周)、胞核及特定区域核膜、核仁、核质中都有分布[12-13]。MTDH的多种亚细胞定位,可能与不同条件下、不同细胞中发挥的作用不同有关[14-15]。
1.2MTDH与信号通路MTDH可激活多个致癌性的信号转导通路,在介导MTDH的多效功能中发挥作用。
1.2.1PI3K/AKT信号通路PI3K/AKT是参与由MTDH介导的肿瘤发生的1条途径。PI3K/AKT 信号通路不仅由MTDH 激活,而且可以调节MTDH的表达。Lee等[16]报道,MTDH表达不仅激活PI3K/AKT通路和c-Myc,其本身可激活PI3K/AKT和诱导c-Myc基因的表达,并在神经母细胞瘤激活c-Myc基因的表达,从而导致神经母细胞瘤的发生。人脑胶质瘤细胞中,AKT活化是VEGF的启动子,同时在MTDH介导的HIF1-α上调中发挥作用[17]。PI3K/AKT信号调节多种生长调节转录因子,如叉头框(FOXO)蛋白和NF-κB。在前列腺癌细胞中,下调MTDH抑制AKT的活化,导致叉头框(FOXO)3a和P27的活性增强,最终导致细胞凋亡[18]。在食管癌细胞,由MTDH激活AKT,导致细胞周期蛋白D1(cyclin D1) 的上调和 P27的下调[19]。此外,MTDH 的下调抑制NF-κB 和激活蛋白-1(AP-1)的级联活性,而mRNA和蛋白质表达水平的NF-κB和AP-1调节的基因 IL-6、IL-8和基质金属蛋白酶9(MMP-9)显著下降。 PC-3和 DU145细胞的侵袭能力也大幅降低。PI3K/AKT的激活导致与MDR1 mRNA有关的多核糖体增加而导致的化学耐药[20]。因此,PI3K/AKT活化介导的MTDH,但是由MTDH激活该途径的机制仍有待确定。
1.2.2MTDH 与NF-κB信号通路NF-κB信号通路是被确定的另一条激活MTDH的信号通路。在HeLa细胞和人恶性胶质瘤细胞中,采用诱导MTDH表达的肿瘤坏死因子-α (TNF-α)进行干预,MTDH 转至核内表达,与NF-κB的p65亚基发生反应,并且促进NF-κB 诱导的基因表达。在人前单核细胞,LPS通过NF-κB活化MTDH的表达。另一方面,MTDH自身活化NF-κB,抑制MTDH的活性,可以抑制LPS诱导的促炎性细胞因子如TNF-α和PGE 2的产生。MTDH在细菌感染中发挥潜在的免疫作用,MTDH可能在肿瘤的炎症机制中起关键作用[21]。Lee 等[22]报道,在神经胶质瘤细胞中,MTDH 与p65 直接发生作用,充当NF-κB的共同激活物,但是TNF-α 减少了NF-κB 依赖性的EAAT2的表达。提示NF-κB可能是MTDH介导的EAAT2 抑制的1条信号通路。TNF-α介导的NF-κB抑制并不是普遍现象,TNF-α 还是NF-κB表达的正向调节剂,但是其机制并不是十分清楚。MTDH 作为桥梁分子可促进NF-κB与CBP之间的相互作用,因此充当共活化剂的作用,从而诱导NF-κB 依赖性的基因活化。Emdad等[23]报道,MTDH 激活NF-κB,能促进肿瘤细胞的侵袭和迁移,从而间接有助于肿瘤血管的形成。Zhang等[24]报道,MTDH通过降低Caspase 3 的裂解,激活NF-κB信号通路,增强了HeLa细胞的自噬能力,从而导致宫颈癌细胞的化疗耐药,因此MTDH可能被用作治疗靶标,以克服宫颈癌的化疗耐药。
1.2.3丝裂原活化蛋白激酶(MAPK)和Wnt信号通路除了NF-κB和AKT途径,MTDH还激活MAP激酶途径,特别是ME/ERK和p38蛋白激酶途径,抑制任何一条路径可导致MTDH诱导的致癌作用的终止。在肝细胞癌中,MTDH通过对激活Raf/MEK/MAPK与Wnt基因/β-catenin的途径相关联[25]。在人肝癌细胞HepG3细胞中,MTDH过表达能活化包括ERK 和p38的MAP激酶活性。激酶磷酸化糖原合酶激酶(GSK3β)可增加β-catenin蛋白的稳定性及核易位。LEF-1是与β-catenin相互作用的转录因子,在细胞核内表达。MTDH的过表达也增加了LEF-1的表达水平。MAPK途径的特异性抑制剂能够抑制致癌作用,阻碍基底膜浸润和癌症的锚定非依赖性生长[25]。抑制MTDH可减少磷酸化的AKT和GSK-3β,降低β-catenin、淋巴增强结合因子1(LEF1)和细胞周期素D1的水平[26]。提示MTDH可能参与Wnt/β-catenin介导的肿瘤发生。MTDH的靶向抑制可以为癌症提供一种新的治疗策略。最近一项研究表明,上调MTDH可提高弥漫性大B细胞淋巴瘤(DLBCL)细胞系中β-catenin总蛋白的表达水平,促进β-catenin直接或间接易位至胞核,MTDH的下调能减少β-catenin总蛋白及胞质β-catenin蛋白水平,并减少胞核中β-catenin的表达,提示MTDH对DLBCL的发展中的作用是通过Wnt基因/β-catenin信号通路调节介导的[2]。
1.3MTDH的临床意义MTDH的异常表达可以促进肿瘤的增殖、侵袭、化疗抗性、血管生成和转移,是肿瘤标记物之一,在很多肿瘤中,MTDH作为一个独立的生物标志物与肿瘤的高度侵袭性转移有关,同时MTDH的高表达提示该肿瘤预后较差。 MTDH蛋白在细胞核或细胞质定位可以预测癌症的过程和预后。
1.3.1MTDH与食管癌食管癌是世界上最普遍的恶性肿瘤之一。食管癌在全球范围内的发生率和死亡率分别位于恶性肿瘤的第8位和第6位[27],是中国的四大恶性肿瘤,也是我国死亡率较高的消化道恶性肿瘤之一[28]。食管癌分为食管鳞状细胞癌(ESCC)和腺癌(ECA)2种类型。Yu等[29]发现了MTDH的表达显著上调食管癌细胞系及食管癌标本在转录和翻译水平的表达。免疫组化分析显示,47.6%68/168(47.6%)的食管癌石蜡组织中MTDH 高表达。统计分析表明MTDH的上调是与食管癌患者的临床分期(P=0.001)、TNM分期(P值分别为 0.002、0.034和0.021)及组织分化程度(P=0.035)有关。而MTDH高表达的患者存活率更短(P<0.001)。多因素分析显示,MTDH 表达可能是食管鳞状细胞癌存活的一个独立的预后指标。与其他研究所不同的是,该项研究显示,男性食管癌患者MTDH的表达显著高于女性患者,差异有统计学意义(P=0.041),男性特异性MTDH过表达分子机制和这一观察结果的潜在影响仍有待进一步研究。
1.3.2MTDH与头颈部鳞状细胞癌头颈部鳞状细胞癌(HNSCC)是头颈部恶性肿瘤最为常见的一个类型,是全球第六大常见恶性肿瘤。这类肿瘤的恶性程度高,晚期存活率较低,预后不佳。Wang等[30]报道,MTDH的高表达与区域淋巴结转移和较差的5年生存率密切相关。HNSCC细胞系中MTDH的下调减少了HNSCC 细胞系的集落形成、迁移和侵袭能力。相对于正常组织,MTDH在HNSCC组织中高表达,miR-375在HNSCC组织中低表达(P=0.015和P=0.008)。转染si-MTDH后,头颈部鳞癌细胞的增殖显著受到抑制,MTDH可能是头颈部鳞癌的癌基因[31]。
1.3.3MTDH与乳腺癌乳腺癌是第2种最常见的癌症,是导致美国妇女死亡的首要原因[32-33]。中国不是乳腺癌的高发国家,但不宜乐观。Li等[34]首先提出MTDH是一种致癌的Ha-ras基因的靶基因,在含有癌细胞的原发性乳腺癌组织以及转移性的区域中检测到MTDH的高表达,统计分析表明MTDH的表达与临床分期(P=0.001)、T分期(P=0.004)、N分期(P=0.026)和M分期有关(P=0.001)。MTDH高表达的患者总生存时间更短,而MTDH低表达者生存状态较好。MTDH 主要在细胞质中表达,而转移肿瘤显示核染色的比例很高。另有研究报道,MTDH高表达显著与高核级、雌激素受体(ER)和孕激素受体(PR)的阴性表达、Ki67的高水平有关,同时也与低生存率(P=0.000 1)、远处转移低生存率相关(P=0.009)。在淋巴结阴性患者中,MTDH的高表达预后极不理想。多因素分析显示,MTDH的表达是低生存率 (HR 3.45,95% CI为1.69~6.84,P=0.001 0)和低远处转移生存率(HR 2.39,95%CI为1.08~5.01,P=0.031 9)的影响因素。MTDH表达导致浸润性乳腺癌预后不良[35]。Su等[36]采用免疫组化方法分析249例乳腺癌组织中MTDH的表达,包括29 例导管增生(UDH)、14例非典型性导管增生(ADH)、37 例原位导管癌(DCIS)、162例浸润性导管癌和7例正常乳腺组织。在UDH、ADH、DCIS和浸润性导管癌组织中,MTDH的阳性表达率分别为24.14%、28.57%、72.97%和55.56%。在正常乳腺组织未检测到MTDH的过表达。MTDH在浸润性癌的表达率高于其在原位癌中的表达率,提示MTDH可能参与导管癌的发生。在DCIS患者,MTDH的表达与ER、PR和HER2的表达没有相关性,而与Ki-67的表达(P=0.008)与组织学分级有关(P=0.035)。 在浸润性乳腺癌患者中,MTDH的表达与患者的年龄(P=0.042)、Ki-67状态(P=0.036)、ER(P=0.018)、p53(P=0.001)密切相关。提示MTDH在乳腺癌不同组织类型中起到不同的作用。
1.3.4MTDH与舌鳞状细胞癌舌鳞状细胞癌(TSCC)是最常见的口腔癌类型,占口腔鳞癌的41%,TSCC肿瘤的细胞增殖和淋巴结转移率很高。Ke等[37]采用免疫组织化学法(IHC)检测93例舌鳞癌石蜡包埋组织MTDH蛋白表达,并选取4对舌鳞癌同一病人癌旁组织作为对照。免疫组化结果显示,MTDH在舌鳞癌组织中的阳性率(48.39%,45/93)明显高于正常舌组织(10.00%,3/30)(P<0.001)。同时,MTDH的蛋白水平与分化程度(P<0.001)、临床分期(P<0.001)、T分期(P=0.007)和N分期(P=0.012)相关。此外,具有较高的MTDH表达的患者总生存时间更短。多变量分析(Cox回归)结果也显示,MTDH的表达是舌鳞癌(P=0.043)的独立预后指标。研究结果表明,MTDH的表达与癌变舌鳞癌的发生、发展有关,可能是一种新的、有价值的预测舌鳞癌患者的预后评估指标。Deng等[38]研究报道,舌鳞状细胞癌 Epha7和 MTDH蛋白表达阳性率分别为55.6%和60%,均明显高于癌旁正常上皮组织[χ2(Epha7和 MTDH)分别为4.14、5.25,P均<0.05]。组织学分级Ⅰ~Ⅱ、临床分期Ⅰ~Ⅱ期及无颈部淋巴结转移病例Epha7和 MTDH表达阳性率明显低于组织学分级Ⅲ~Ⅳ级、临床分期Ⅲ~Ⅳ期及颈部淋巴结转移病例(P<0.05或P<0.01)。提示Epha7和 MTDH表达水平在舌鳞状细胞癌发生、发展中可能起重要作用,Epha7和 MTDH过表达者提示预后不良。
1.3.5MTDH与肝细胞癌一些研究分析了MTDH与肝癌的临床相关性。Yoo等[39]首次发现MTDH在原代大鼠肝细胞和肝癌细胞系HepG3、QGY-7703、SNU-423、Hep3B、Huh7,SK-Hep-1中的表达。MTDH在原代大鼠肝细胞中的表达低于人肝癌细胞中的表达。MTDH在QGY-7703细胞的表达明显高于在HepG3细胞的表达。这些结果由免疫组化组织芯片(TMA)证实,包括86例原发性肝癌、23例转移性肝癌和9例癌旁正常组织。在9例癌旁正常组织中MTDH低表达,在肝癌组织中MTDH 明显高表达。Zhu等[40]进行的免疫组化结果显示,MTDH主要被定位于细胞膜和细胞质。MTDH在肿瘤组织的表达显著高于癌旁组织,MTDH的高表达率为54.2%(175/ 323),进一步研究显示, MTDH的表达与微血管侵犯(P<0.001)、肿瘤分化程度(P=0.002)、TNM分期(P=0.001)有关。结果表明,MTDH的表达提示有肿瘤的微血管侵犯,分化差,TNM分期Ⅱ和Ⅲ。但MTDH的表达与其他相关临床病理特征如年龄、性别、肝硬化、血清α-甲胎蛋白、肿瘤直径、肿瘤包膜或巴塞罗那分期(BCLC)无关。Gong等[41]研究表明,与正常组织比较,MTDH在HBV相关HCC组织中表达升高。提示在HBV肝炎向HBV相关HCC转变中,MTDH的表达逐渐增高。此外,统计分析显示,在HBV相关的HCC患者,MTDH与美国肿瘤联合委员AJCC,第7版)分期(P=0.020)、T分期(P=0.007)、N分期(P=0.044)、血管侵犯(P=0.006)和组织分化程度(P=0.020)有关。此外,患者的高MTDH水平使患者的生存时间缩短(P=0.001)。
1.4MTDH的恶性生物学行为
1.4.1MTDH在肿瘤增殖和侵袭中的作用正常细胞向癌细胞生长经历控制独立生长、永生化改造,最终获取侵袭和转移能力。MTDH是肿瘤的生物标记物,MTDH的病理生理作用促进细胞的生长和增殖,锚定非依赖性生长变更、迁移、侵袭、化疗、血管生成和体内肿瘤发生和转移。在非小细胞肺癌中,下调MTDH的表达通过细胞周期停滞、抑制迁移和侵袭,体外减少锚定非依赖性和依赖性生长并进一步抑制肿瘤发生、生长和转移。MTDH的过表达增加细胞的侵袭。MTDH表达逆转前转移肌动蛋白细胞骨架重构和抑制EMT,支持了MTDH对癌细胞增殖和转移的关键作用[42]。Zhang等[43]采用3(4,5-二甲基-2-基-2,5-二苯基溴化(MTT)检测MTDH对乳腺癌细胞MCF-7的增殖和侵袭的生物学作用,结果显示MTDH的过表达促进乳腺癌细胞的增殖和侵袭能力,并上调HER2/neu基因,其提供了一种潜在的靶向乳腺癌治疗的方法。
1.4.2MTDH与化疗耐药化疗耐药是侵袭性癌症的重要标志。MTDH有助于对各种化学治疗剂包括5-氟尿嘧啶(5-FU)、多柔比星、紫杉醇、顺铂和4-羟基环磷酰胺(4-HC)发生化疗耐药。在SiHa细胞、HeLa细胞、宫颈癌CasKi和C33A细胞,MTDH表达水平与顺铂的化疗耐药相关。MTDH在HeLa细胞可增加自噬,可能与其降低裂解胱天蛋白酶-3的活性和EER/ NF-κB途径的激活有关。MTDH可能被用作治疗靶标,以克服宫颈癌的化疗耐药[44]。Yoo等[45]阐明MTDH诱导耐药的分子机制,MTDH增加多药耐药基因1(MDR1)蛋白表达,从而增加了外排,降低阿霉素的积累,促进阿霉素耐药。抑制MDR1的小干扰RNA或化学试剂,或抑制MTDH的1个或2个基因的组合,显著增加体外阿霉素的敏感性。在裸鼠移植瘤的研究中,慢病毒表达MTDH的短发夹RNA与阿霉素的联合,较单用MTDH的短发夹RNA或阿霉素能显著性地抑制人肝癌细胞的生长。研究尽管显示MTDH不影响MDR1基因的转录,但其有利于MDR1 mRNA与核糖体关联,从而提高翻译。MTDH也抑制泛素化和MDR1蛋白质的随后的蛋白酶体介导的降解。MTDH的抑制可能更有效地利用于肝癌的化疗。
1.4.3MTDH与肿瘤的转移恶性肿瘤细胞从原发部位,经淋巴道、血管或体腔等途径,到达其他部位继续生长,称肿瘤转移。研究表明[46],在转染MTDH逆转录病毒shRNA表达载体的骨肉瘤细胞系U2OS和SOSP-M中,转移倾向、细胞增殖都显著降低。转染MTDH逆转录病毒shRNA后,U2OS和SOSP-M细胞的侵袭和迁移能力明显降低。此外,下调MTDH后,上皮-间质转化(EMT)也减少,MTDH的过度表达显著与骨肉瘤的转移相关。 研究证实[47],MTDH通过调节EMT促进骨肉瘤发生转移。在头颈部鳞癌中,体外实验表明,MTDH表达可增强头颈部鳞状细胞的迁移和侵袭能力。MTDH诱导EMT,由2个调节形态学变化和介导的生物分子的E-钙粘蛋白和波形蛋白的表达。此外,MTDH介导的AKT活化,所有的上述效应几乎完全通过AKT的抑制阻断。研究结果表明,MTDH可能通过AKT信号通路介导的EMT促进头颈部鳞状细胞的转移[47]。
2miR-26a在恶性肿瘤中的作用研究进展
2.1miR-26a的结构Hsa-miR-26a(miR-26a)首先从Hela细胞克隆得到,在多种组织泛表达,其表达无组织特异性。miR-26a-1、miR-26a-2、miR-26b 是Hsa-miR-26a 家族中的3种亚型,分别位于3、12和2号染色体。miR-26a-1和miR-26a-2的成熟体miRNA 具有相同的序列,与miR-26b成熟体miRNA有2个核苷酸不同(图1)。在一系列细胞核内和胞浆内酶的作用下,带有茎-环结构miR-26被加工成成熟miR-26(图2)[48]。成熟miR-26为21~22个核苷酸长,为6~7的种子区域核苷酸。miR-26的种子区的序列为结合靶mRNA的区域,miR-26通过与mRNA的3’-UTRs结合而发挥调控作用。由于miR-26可以抑制靶基因的翻译和减少靶基因编码蛋白的表达水平,所以miRNA有许多调节肿瘤发生及肿瘤的靶基因。miR-26a的表达失调参与了多种肿瘤的发生发展和侵袭转移,如肺癌、甲状腺癌、子宫平滑肌肉瘤、乳腺癌和结肠癌等。
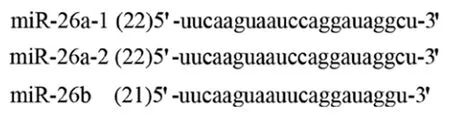
图1 成熟体miR-26a的序列
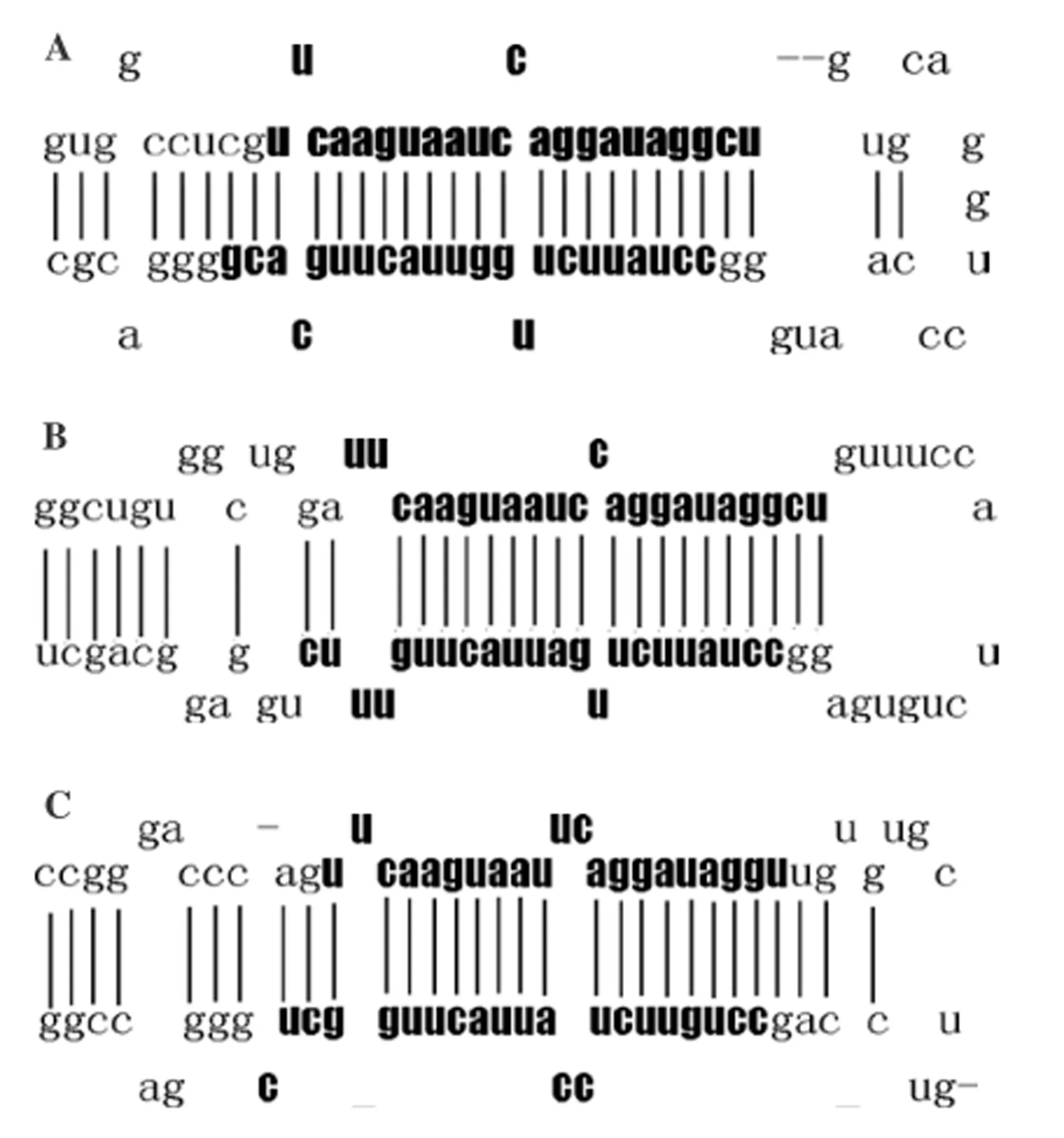
A:pre-miR-26a-1;B:pre-miR-26a-2;C:pre-miR-26b
2.2miR-26a与肿瘤的关系50%以上的miRNAs定位在肿瘤相关的基因组区域(cancer associated genomic regions,CAGR),包括LOH区、染色体扩增区及脆性位点等,其表达水平在许多肿瘤中发生改变,可能起到原癌基因或肿瘤抑制基因的作用,因此也将此类miRNA称作oncomirs。到目前为止,已发现多个发挥原癌基因或肿瘤抑制基因作用的miRNAs,如let-7、miR-21、miR-17-92 cluster、miR-143、miR-145、miR-372和miR-375等,它们通过调控下游靶基因的转录和翻译参与了肿瘤的演进过程。miR-26a在多种组织泛表达,无组织特异性.但对于其具体功能还知之甚少。而令人费解的是,miR-26a在不同肿瘤的发病机制中扮演了截然相反的双重角色。在淋巴瘤、乳腺癌以及肝癌中,miR-26a在癌组织中表达降低,并发挥抑癌基因的作用;而在胶质瘤中,miR-26a却表达增高,扮演癌基因的角色。miR-26a抑制急性髓细胞样白血病细胞的增殖,却促进急性T淋巴细胞白血病细胞的增殖。这些有争议的结论表明,miR-26a可能在不同的肿瘤和不同的组织学类型中发挥着不同的作用,其功能的复杂程度是毋庸置疑的。
2.2.1miR-26a在肿瘤中的抑癌基因作用在膀胱癌、乳腺癌、口腔鳞状细胞癌、间变癌、伯基特淋巴瘤、肝癌和横纹肌肉瘤中miR-26的表达降低,并且被认为是一种抑制miRNA,起到抑制肿瘤的作用,miR-26a在这些肿瘤中充当抑癌基因的角色。Zhao等[49]报道,miR-26a在前列腺癌组织和细胞中的表达低于正常前列腺组织和细胞,另外稳定的转染miR-26a的慢病毒能够抑制前列腺癌细胞的增殖、转移、上皮间质转化和诱导细胞阻滞在G1期。Wnt5a是miR-26a的生物信息学分析潜在的靶基因。荧光素酶检测和Western blot分析确定了Wnt5a是miR-26a的新的直接靶基因,miR-26a可以靶向作用于Wnt5a而抑制前列腺癌。一项关于胆囊癌的研究发现, miR-26a在胆囊癌组织中是下调的,miR-26a的表达与肿瘤的组织学分级相关联,miR-26a能显著抑制胆囊癌细胞增殖[50]。此外,该研究证实了HMGA是miR-26a的直接目标。HMGA2 mRNA和miR-26a呈负相关。此外,HMGA2拮抗剂能阻碍miR-26a对胆囊癌细胞增殖的抑制,结果表明miR-26a的表达通过靶向HMGA2促进胆囊癌增殖,miR-26a可作为胆囊癌的预后因子和治疗靶点。Song等[51]发现miR-26a在骨肉瘤组织和细胞系中的表达水平明显低于正常对照。miR-26a的表达下调与骨肉瘤的不良临床分期和远处转移有关。多因素分析表明,miR-26a的这种损失是影响骨肉瘤总生存的独立预后因素。此外,miR-26a的表达抑制骨肉瘤细胞侵袭和迁移。miR-26a通过靶向其3'-UTR抑制Enhancer of zeste homolog 2 (EZH2)的表达。此外,EZH2上调并miR-26a的表达呈负相关。证明miR-26a的表达下调与肿瘤侵袭性和肿瘤转移有关,miR-26a的关联通过靶向EZH2基因在骨肉瘤抑制细胞迁移和侵袭。miR-26a的是骨肉瘤患者一个独立的预后标志物。Jia等[52]关于舌鳞状细胞癌的研究显示,舌鳞状细胞癌miR-26a和长链非编码RNA(long noncoding RNA,lncRNA) MEG3基因表达较正常的舌组织中大大减少,miR-26a的低表达水平和MEG3是舌鳞癌预后差的独立预后因素。在人舌鳞癌细胞株SCC-15和CAL27中,miR-26a的抑制可能导致MEG3的上调,减少的miR-26a和MEG3可能存在链接关系。此外miR-26a和MEG3的过表达抑制SCC-15和CAL27的增殖和细胞周期进程,促进细胞凋亡。miR-26a和MEG3可能在舌鳞癌发病中起重要的抗肿瘤作用。
2.2.2miR-26a在肿瘤中的癌基因作用在神经胶质瘤和卵巢癌中miR-26高表达,促进了肿瘤细胞的生长和增殖,充当癌基因的作用。miR-26a的过度表达促进卵巢癌增殖和克隆形成。miR-26a通过抑制ER-α的转录后修饰来促进卵巢癌(OC)细胞生长。此外,抑制的miR-26a阻碍了裸鼠注射OC细胞的肿瘤形成。异常表达的miR-26a可以有助于OC的发展[53]。Qian等[54]报道,miR-26a在神经胶质瘤细胞中能促进肿瘤细胞的生长和细胞集落以及血管生成,而下调miR-26a的表达则起到相反的作用。在神经胶质瘤细胞miR-26a直接靶向抑制素(PHB)水平,与miR-26a的表达呈负相关,并与胶质瘤等级密切相关。该结果揭示miR-26a调节PHB,在体内和体外促进神经胶质瘤的进展,为神经胶质瘤基础的治疗有帮助。
2.3miR-26a的下游靶基因及相互调节关系一系列研究表明,EZH2、PTEN、MCL-1 和MTDH是潜在的miR-26的下游靶基因。但miR-26与其靶基因在不同肿瘤中的作用仍然不清楚,需要进行进一步调查。
2.3.1miR-26a与MTDHZhang等[55]首次报道了miR-26a在乳腺癌标本和细胞系中下调,miR-26a的瞬时转染促进乳腺癌细胞系MCF7细胞的细胞凋亡。MTDH和EZH2被识别为miR-26a的2个直接的靶标,MTDH和EZH2在乳腺癌显著上调。外源性的miR-26a异种移植物MCF7细胞能减少MTDH和EZH2的表达。此外,MTDH下调导致细胞凋亡,MTDH能逆转miR-26a在MCF7细胞凋亡的作用。研究结果表明miR-26a的功能通过靶向MTDH和EZH2的拮抗人乳腺癌的发生。
2.3.2miR-26a与MCL-1Gao等[56]研究表明,在乳腺癌细胞和临床标本中,miR-26a可下调细胞增殖、细胞集落的形成、迁移及细胞凋亡。MCL-1是Bcl-2家族的抗凋亡成员,是miR-26a 的下游靶因。乳腺癌细胞系miR-26a与MCL-1呈负相关关系。该研究进一步探讨了MCL-1参与miR-26a增加紫杉醇对乳腺癌细胞的敏感性的作用,miR-26a通过调控MCL-1对细胞增殖和乳腺癌转移产生影响。
2.3.3miR-26a与PTENLiu 等[2]报道了miR-26a对肺癌细胞的转移潜力的影响。在淋巴结转移肿瘤组织,miR-26a的表达水平高于原发肺癌组织,miR-26a的异位表达可显著提高肺癌细胞的迁移和侵袭能力。进一步机理研究揭示了miR-26a可增加AKT的磷酸化和NF-κB的转录激活,miR-26a能增强肺癌细胞转移潜能,通过调制转移相关基因的表达,并通过抑制PTEN基因激活AKT信号通路,表明miR-26a可能是治疗转移性肺癌的一种潜在的治疗候选者。
2.3.4miR-26a与EZH2Yu等[57]一项关于鼻咽癌的研究表明, miR-26a的表达可抑制鼻咽癌细胞的迁移和侵袭能力;使用小鼠模型研究显示miR-26a在体外抑制鼻咽癌的转移。miR-26a降低了EZH2在体外和体内的表达水平,提示miR-26a的鼻咽癌的抗转移作用是通过调节EZH2介导的。Dang 等[58]研究报道,miR-26a在A549人肺癌细胞系可显著抑制细胞增殖的表达,阻止体外G1/S期过渡,诱导细胞凋亡,并抑制细胞侵袭和转移。用miR-26a的抑制剂转染A549细胞后,抑制miR-26a能促进细胞迁移和侵袭。miR-26a抑制EZH2和下游靶基因,包括DAB2IP和RUNX3的增强的表达,表明EZH2是miR-26a的一个下游靶基因。miR-26a的使用可作为一种抗致癌基因在人肺癌的分子机制中起重要作用,并且可能被用于肺癌的治疗。
综上所述,MTDH、miR-26a在肿瘤的发生发展及肿瘤转移中起到不同的作用,并且 MTDH及miR-26a在乳腺癌中存在上下游靶基因的调控关系,但是在食管癌中的存在的调控关系仍需进一步研究。
参考文献:
[1]Ge XL,Lv X, Feng LL.Metadherin Contributes to the pathogenesis of diffuse large B-cell lymphoma[J]. PloS One,2012,7(6): e39449.
[2]Liu B,Wu X,Liu B,et al.MiR-26a enhances metastasis potential of lung cancer cells via AKT pathway by targeting PTEN[J].Biochim Biophys Acta, 2012,1822(11):1692-1704.
[3]Medina PP,Nolde M,Slack FJ.OncomiR addiction in an in vivo model of microRNA-21-induced pre-B-cell lymphoma[J]. Nature,2010,467: 86-90.
[4]Garofalo M,Croce CM.microRNAs:Master regulators as potential therapeutics in cancer[J]. Annu Rev Pharmacol Toxicol,2011,51:25-43.
[5]Lu J,He ML,Wang L,et al.MiR-26a inhibits cell growth and tumorigenesis of nasopharyngeal carcinoma through repression of EZH2[J].Cancer Res,2011,71(1):225-233.
[6]Kota J,Chivukula RR,O’Donnell KA,et al.Therapeutic microRNA delivery suppresses tumorigenesis in a routine liver cancer model[J].Cell,2009,137(6):1005-1017.
[7]Zhang B,Liu XX,He JR,et al.Pathologicallydecreased miR-26a antagonizes apoptosis and facilitates carcinogenesis by targeting MTDH and EZH2 in breast cancer[J].Carcinogenesis,2011,32(1):2-9.
[8]HuseJT,Brennan C,Hambardzumyan D,et al.The PTEN-regulating microRNA MiR-26a is amplified in high-grade glioma and facilitates gliomagenesis in vivo[J].Genes Dev,2009,23(11):1327-1337.
[9]Kim H,Huang W,Jiang X,et al.Integrative genome analysis reveals an Oncomir/oncogene cluster regulating glioblastoma survivorship[J].Proc Natl Acad Sci USA,2010,107(5):2183-2188.
[10]AnttiIa V,Stefansson H,KaljeJa M,et al.Genome-wide association study of migraine implicates a common susceptibility variant on 8q22.1[J].Nat Genet,20l0,42(10):869-873.
[11]Yoo BK, Emdad L,Lee SG, et al.Astrocyte Elevated Gene-1 (AEG-1): a multifunctional regulatorof normal and abnormal physiology[J].Pharmacol Ther, 2011,130(1): 1-8.
[12]Meng X, Zhu D, Yang S, et al. Cytoplasmicmetadherin(MTDH) provides survival advantage under conditions of stress by acting as RNA-binding protein[J].J Biol Chem,2012,287:4485-4491.
[13]Liao WT,Guo L,Zhong Y,et al.Astrocyte elevated gene-1 (AEG-1) is a marker for aggressive salivary ghnd carcinoma[J].J Transl Med,2011,9:205.
[14]Yoo BK,Emdad L,Su ZZ,et al.Astrocyte elevated gene.regulates hepatoellular carcinoma development and progression[J].J Clin Invest,2009,119:465-477.
[15]Thirkettle HJ,Giding J,Warren AY,et al.LYRIC/AEG-1 is targeted to different subcellular compartments by ubiquitiny1ation and intrinsic nuclear localization signals[J].Clin Cancer Res,2009,15:3003-3013.
[16] Lee SG, Jeon HY, Su ZZ, et al.Astrocyte Elevated Gene-1 contributes to the pathogenesis of neuroblastoma[J].Oncogene,2009,28:2476-2484.
[17] Emdad L, Lee SG, Su ZZ, et al.Astrocyte elevated gene-1(AEG-1) functions as an oncogene and regulates angiogenesis[J].Proc Natl Acad Sci USA,2009,106:21300-21305.
[18] Kikuno N,Shiina H,Urakami S,et al.Knockdown of astrocyte-elevated gene-1 inhibits prostate cancer progression through upregulation of FOXO3a activity[J].Oncogene,2007,26:7647-7655.
[19]Isozaki Y, Hoshino I, Akutsu Y, et al. Usefulness of microRNA-375 as a prognostic and therapeutic tool in esophageal squamous cell carcinoma[J].Int J Oncol,2014, [Epub ahead of print]
[20]Yoo BK,Chen D,Su ZZ,et al.Molecular mechanism of chemoresistance by astrocyte elevated gene-1[J]. Cancer Res,2010,70(8):3249-3258.
[21]Khuda I,Koide N,Noman ASM,et al.Astrocyte elevated gene-1 (AEG-1) is induced by lipopolysaccharide as toll-like receptor 4 (TLR4) ligand and regulates TLR4 signaling[J].Immunology, 2009, 128(1 Suppl):e700-706.
[22]Lee SG, Kim K, Timothy P.Oncogene AEG-1 promotes glioma-induced neurodegeneration by increasing glutamate excitotoxicity[J].Cancer Res, 2011,71(20):6514-6523.
[23] Emdada L,Leeb SG, Zhong Z.Astrocyte elevated gene-1 (AEG-1) functions as an oncogene and regulates angiogenesis[J]. PNAS, 2009, 106(50):21300-21305.
[24] Zhang J, Zhang Y, Liu S, et al.Metadherin confers chemoresistance of cervical cancer cells by inducing autophagy and activating ERK/NF-κB pathway[J].Tumour Biol,2013,34(4):2433-2440.
[25]Yoo BK, Emdad L, Su ZZ,et al.Astrocyte elevated gene-1 regulates hepatocellular carcinoma development and progression[J].J Clin Invest,2009,119:465-477.
[26]Jianbo X,Hui W,Yulong H,et al.Astrocyte-elevated gene-1 overexpression is associated with poor prognosis in gastric cancer[J]. Med Oncol, 2011,28(2):455-462.
[27]Hao JJ, Gong T, Zhang Y,et al.Characterization of gene rearrangements resulted from genomic structural aberrations in human esophageal squamous cell carcinoma KYSE150 cells[J]. Gene,2013,513(1):196-201.
[28]Hjortland GO, Meza-Zepeda LA, Beiske K,et al.Genome wide single cell analysis of chemotherapy resistant metastatic cells in a case of gastroesophageal adenocarcinoma[J]. BMC Cancer, 2011,20(11):455.
[29] Yu C,Chen K,Zheng H, et al.Overexpression of astrocyte elevated gene-1(AEG-1) is associated with esophageal squamous cell carcinoma (ESCC) progression and pathogenesis[J]. Carcinogenesis, 2009, 30:894-901.
[30] Wang YP, Liu IJ, Chiang CP, et al. Astrocyte elevated gene-1 is associated with metastasis in head and neck squamous cell carcinoma through p65 phosphorylation and upregulation of MMP1[J]. Mol Cancer,2013,12(1):109.
[31] Nohata N, Hanazawa T, Kikkawa N, et al. Tumor suppressive microRNA-375 regulates oncogene AEG-1/MTDH in head and neck squamous cell carcinoma (HNSCC)[J]. J Hum Genet, 2011, 56(8):595-601.
[32]Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer,2010, 127:2893-2917.
[33]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[34]Li J, Zhang N, Song LB, et al. Astrocyte elevated gene-1 is a novel prognostic marker for breast cancer progression and overall patient survival[J].Clin Cancer Res,2008, 14:3319-3326.
[35]Tokunaga E,Nakashima Y,Yamashita N,et al.Overexpressionm of metadherin/MTDH is associated with an aggressive phenotype and a poor prognosis in invasive breast cancer[J].Breast Cancer, 2014,21(3):341-349.
[36]Su P, Zhang Q, Yang Q. Immunohistochemical analysis of Metadherin in proliferative and cancerous breast tissue[J]. Diagnost Pathol, 2010,5:38.
[37]Ke ZF, He S, Li S, et al. Expression characteristics of astrocyte elevated gene-1 (AEG-1) in tongue carcinoma and its correlation with poor prognosis[J]. Cancer Epidemiol, 2013 37(2):179-185.
[38]Deng N, Feng Y.Expression of EphA7 and MTDH and clinicopathological significance in the squamous cell cancer of the tongue[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2011,36(12):1195-1198.
[39]Yoo BK, Emdad L, Su ZZ, et al. Astrocyte elevated ene-1 regulates hepatocellular carcinoma development and progression[J]. J Clin Invest,2009, 119:465-477.
[40]Gong Z, Liu W, You N, et al. Prognostic significance of metadherin overexpression in hepatitis B virus-related hepatocellular carcinoma[J]. Oncol Rep, 2012,27:2073-2079.
[41]Zhu K, Dai Z, Pan Q, et al. Metadherin promotes hepatocellular carcinoma metastasis through induction of epithelial-mesenchymal transition[J]. Clin Cancer Res,2011, 17:7294-7302.
[42]Yao Y,Gu X,Liu H,et al.Metadherin regulates proliferation and metastasis via actin cytoskeletal remodelling in non-small cell lung cancer[J].Br J Cancer, 2014,111(2):355-364.
[43] Zhang X, Zhang N, Zhang MX. Astrocyte elevated gene-1 induces breast cancer proliferation and invasion through upregulating HER2/neu expression[J].Chin Med J (Engl), 2011,124(21):3546-3550.
[44] Zhang J, Zhang Y, Liu S, Zhang Q, et al.Metadherin confers chemoresistance of cervical cancer cells by inducing autophagy and activating ERK/NF-κB pathway[J].Tumour Biol, 2013,34(4):2433-2440.
[45] Yoo BK, Chen D, Su ZZ, et al. Molecular mechanism of chemoresistance by astrocyte elevated gene-1[J]. Cancer Res, 2010,70(8):3249-3258.
[46]Tang J, Shen L, Yang Q,et al.Overexpression of metadherin mediates metastasis of osteosarcoma by regulating epithelial-mesenchymal transition[J].Cell Prolif, 2014, 47(5):427-434.
[47]Yu C, Liu Y, Tan H,et al.Metadherin regulates metastasis of squamous cell carcinoma of the head and neck via AKT signalling pathway-mediated epithelial-mesenchymal transition[J]. Cancer Lett, 2014 ,343(2):258-267.
[48]Gao J,Liu QG.The role of miR-26 in tumors and normal tissues (Review)[J].Oncol Lett,2011,2: 1019-1023.
[49]Zhao S, Ye X, Xiao L,et al.MiR-26a inhibits prostate cancer progression by repression of Wnt5a[J].Tumour Biol, 2014,35(10):9725-9733.
[50]Zhou H, Guo W, Zhao Y .MicroRNA-26a acts as a tumor suppressor inhibiting gallbladder cancer cell proliferation by directly targeting HMGA2[J]. Int J Oncol, 2014,44(6):2050-2058.
[51] Song QC,Shi ZB,Zhang YT,et al.Downregulation of microRNA-26a is associated with metastatic potential and the poor prognosis of osteosarcoma patients[J].Oncol Rep, 2014,31(3):1263-1270.
[52]Jia LF, Wei SB, Gan YH,et al. Expression, regulation and roles of miR-26a and MEG3 in tongue squamous cell carcinoma[J].Int J Cancer, 2014,135(10):2282-2293.
[53] Shen W, Song M, Liu J,et al. MiR-26a promotes ovarian cancer proliferation and tumorigenesis[J].PLoS One, 2014,9(1):e86871.
[54]Qian X,Zhao P,Li W,et al.MicroRNA-26a promotes tumor growth and angiogenesis in glioma by directly targeting prohibitin[J].CNS Neurosci Ther, 2013,19(10):804-812.
[55]Zhang B, Liu XX, He JR, et al. Pathologically decreased miR-26a antagonizes apoptosis and facilitates carcinogenesis by targeting MTDH and EZH2 in breast cancer[J].Carcinogenesis,2011,32(1):2-9.
[56]Gao J,Li L,Wu M,et al.MiR-26a inhibits proliferation and migration of breast cancer through repression of MCL-1[J].PLoS One, 2013,8(6):e65138.
[57]Yu L,Lu J,Zhang B,et al.miR-26a inhibits invasion and metastasis of nasopharyngeal cancer by targeting EZH2[J].Oncol Lett,2013 ,5(4):1223-1228.
[58]Dang X, Ma A, Yang L,et al. MicroRNA-26a regulates tumorigenic properties of EZH2 in human lung carcinoma cells[J].Cancer Genet, 2012,205(3):113-123.
[收稿日期:2014-09-10]
(本文编辑张巧莲)
基金项目:新疆医科大学创新基金(XJC201228)
作者简介:李莉(1978- ),女,副教授,研究方向:医学图像处理及分析,从事大学生教育管理。
通信作者:尔西丁·买买提,男,教授,硕士生导师,研究方向:卫生统计学理论和方法研究,E-mail: 624799002@qq.com。
·医学教育·

