人胚胎三叉神经节细胞发育形态学测量
人胚胎三叉神经节细胞发育形态学测量
廖礼彬1, 姚雪萍2, 吐尔逊江·达地汗3, 古丽尼沙·克力木3
(新疆医科大学基础医学院1组织胚胎学教研室,2机能实验中心,3人体解剖学教研室, 乌鲁木齐830011)
摘要:目的观察人胚胎三叉神经节细胞随胎龄增长的变化发育规律。方法取19~32 w人胚胎三叉神经节,光镜观察,进行细胞计数,图像分析仪测量三叉神经节细胞面积、周长、直径。结果随着胎龄增长三叉神经节细胞数目无明显变化,直径随胎龄增长而增大,面积和周长均随胎龄增大而明显增大。结论人胚胎三叉神经节细胞形态发育在7~8个月(32 w)时达成年人水平;但细胞数目随胎龄增长无明显变化。
关键词:三叉神经节细胞; 测量; 人胚胎
中图分类号:R322.8文献标识码:A
doi:10.3969/j.issn.1009-5551.2015.01.013
[收稿日期:2014-07-14]
The Morphometry on development of trigeminal ganglion cells in human embryo
LIAO Libin1, YAO Xueping2, Tuerxunjiang Dadihan3, Gulnisa Kerem3
(3TheHistologyandEmbryologyDepartmentofPreclinicalCollege,2TheMechanismLab
CenterDepartment,3TheHumanAnatomyDepartment,
XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo observe the development of human embryonic trigeminal ganglion cells with fetal development. MethodEmbryonic trigeminal ganglion aged from 19 to 32 weeks were observed by light microscopy; the cells were counted, and image analysis instrument was used to measure the area, perimeter and diameter of trigeminal ganglion cells. ResultsWith the development of fetus, the number of trigeminal ganglion cells showed no significant changes, but they grew in diameter while the area and perimeter of cells increased significantly. ConclusionThe morphology development of trigeminal ganglion cells in human embryo achieved adults′ level at 7-8 months (32 weeks), but the number of cells showed no significant change with the development of fetus.
Key words: trigeminal ganglion cells; measurement; human embryo
神经系统是人体各系统中发育较早的一个系统,人胚胎第3周在脊索的诱导下神经外胚层形成神经板,再由神经板分化为神经元。关于神经元的发生过程做过大量研究,如不同动物的脊神经的计数及胞体大小测量等;也有研究报道三叉神经节方面的形态研究主要是在形态结构及定位方面[1-3]。国外学者观察了猫三叉神经节内不同神经细胞的结构特征,并分别对豚鼠、兔、猫、猴和人的三叉神经节进行了比较观察[4-6]。但三叉神经节发育尤其人胚胎三叉神发育方面的资料较少,Wu等[7]对小鼠三叉神经节细胞生后发育进行观察,但这些观察都没有进行详细的定量研究, 也未见有关人胚胎三叉神经节发育方面的报道。因此,本研究除从三叉神经节细胞形态方面进行观察外, 着重观察人胚胎三叉神经节细胞随胎龄增长的变化发育规律。
1材料和方法
1.1实验材料从新疆医科大学第二附属医院医院收集非疾致死的流产胎儿共7例,男性3例,女性4例,胎龄19~40 w,通过新疆医科大学第一附属医院伦理委员会审核,标本提供者已签署知情同意书。
1.2实验方法和步骤
1.2.1标本固定在获取标本后4 h内,手术刀片切开胸腔,充分暴露心脏,小心切开心包腔,找到升主动脉根部,连续向根部推注生理盐水300~500 mL行心脏冲洗,再注入10%福尔马林1 000 mL,用眼科剪在右心房处剪一小切口,让固定液沿体循环途径行灌流固定,当头部和四肢变硬饱满后,即固定好。将标本保存在新鲜配置的10%福尔马林溶液中进行后固定,干燥处避光保存。
可分两个层次进行,首先要建立健全水行政执法信息统计系统,全面掌握我国水事违法案基本情况,为“两法衔接”机制建设提供技术支撑。建议国务院水行政主管部门加快建立国家层级的水行政执法信息统计系统,各流域管理机构、省(自治区、直辖市)建立本区域范围的执法信息统计系统,实现水利系统内部水行政执法信息共享,同时为刑事司法机关查阅相关信息提供便利。其次,按照国家 “行政执法与刑事司法衔接信息共享平台”的要求,将“水行政执法统计信息”纳入共享平台中,实现各级水行政执法机关、公安机关和检察机关的相互监督制约,及时发现涉嫌水事违法犯罪线索,加大打击犯罪力度。
1.2.2组织切片待完全固定后,取胎头并PBS漂洗干净,沿胎头耳廓上方1 cm处环形去掉头皮、颅盖骨,暴露端脑,摘取双侧大脑半球及间脑。在外科显微镜下去掉部分中脑后,确定左侧三叉神经根、三叉神经节及三大分支眼神经、上颌神经、下颌神经的位置,分别在眶上裂处切断眼神经,在圆孔处切断上颌神经,在卵圆孔处切断下颌神经,在脑桥基底部切断三叉神经根,小心完整剥离左侧三叉神经根、节分支,修整组织后,置于新鲜配置的10%福尔马林溶液中。梯度酒精脱水,石蜡包埋,全程连续冠状切片,片厚4 μm,HE染色后中性树胶将切片标本封固,每张切片标记排序。
1.3细胞计数与测量
1.3.1细胞计数单位以可见清晰核仁的神经细胞为计数单位,在HE染色片上三叉神经节细胞核与细胞质对比明显,与周围卫星细胞和成纤维细胞易区分,胞体轮廓界限清晰,减少了细胞漏计或重计的概率。
1.3.2三叉神经节细胞计数计数三叉神经细胞时,每个胎龄组隔3张取1张完整的切片。光镜下(×400)利用Motic images Advanced 3.2 图像处理分析软件沿三叉神经半月节弧形方向进行测量,计算出每个视野中神经节细胞的数目,同时记录每个神经节所观察视野的总数,测量每个视野的面积,求出每个视野体积=视野的面积×切片厚度;最后计算出1个视野体积中三叉神经节细胞平均密度=所有视野神经节细胞的数目总和/观察视野的总数,按公式N=V/vD 粗略计算出神经节细胞数目(N:神经节细胞数;V:神经节体积;v:1个视野体积;D:1个视野体积中的神经细胞平均密度)。将N代入Abercrombie[8]的校正公式,得出实际应有的神经细胞数目。
1.3.3三叉神经节细胞直径、面积与周长的测量每个胎龄组隔3张取1张完整的切片,每张切片按“S”形取样法,每张切片计数20个视野;光镜下(×400)利用 Motic images Advanced 3.2 图像处理分析软件,选择软件菜单中“线段”选项,调试好“物镜”、“单位”和“精度”;通过核仁测量神经细胞胞体最长直径为长径,经核仁垂直长径者为短径;选择软件菜单中“多边形”选项,其他选项与直径测量相同;沿细胞外侧缘做多边形曲线勾勒出细胞的整个轮廓,形成一个闭合的边缘;闭合边缘内部分即细胞的面积。周长测量方法同面积。
1.4统计学处理采用SPSS17.0 统计软件包对数据进行处理,细胞计数采用相关分析,其余测量所得数据以均数±标准差(±s)表示,对各胎龄段细胞直径、周长及面积进行单因素方差分析,检验水准α=0.05。
2结果
2.1三叉神经节细胞的光镜观察镜下可见神经节细胞散在分布在神经纤维之间,团块状或者成群分布;细胞界限清晰,胞体卵圆形或圆形,大小不等,胞质在19~25 w胎龄期嗜酸性,呈粉红色(图1a、b)。27 w时胞质呈淡蓝紫色,尼氏颗粒渐明显(图1c)。32 w后,细胞核为1个,居中,近似圆形,其内染色质颗粒较少,呈空泡状,核仁明显,基本居中,呈紫红色(图1d)。各胎龄组细胞大小随胎龄增长而增大。
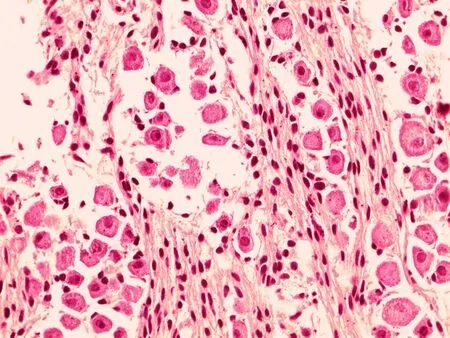
a: 19 w三叉神经节细胞形态
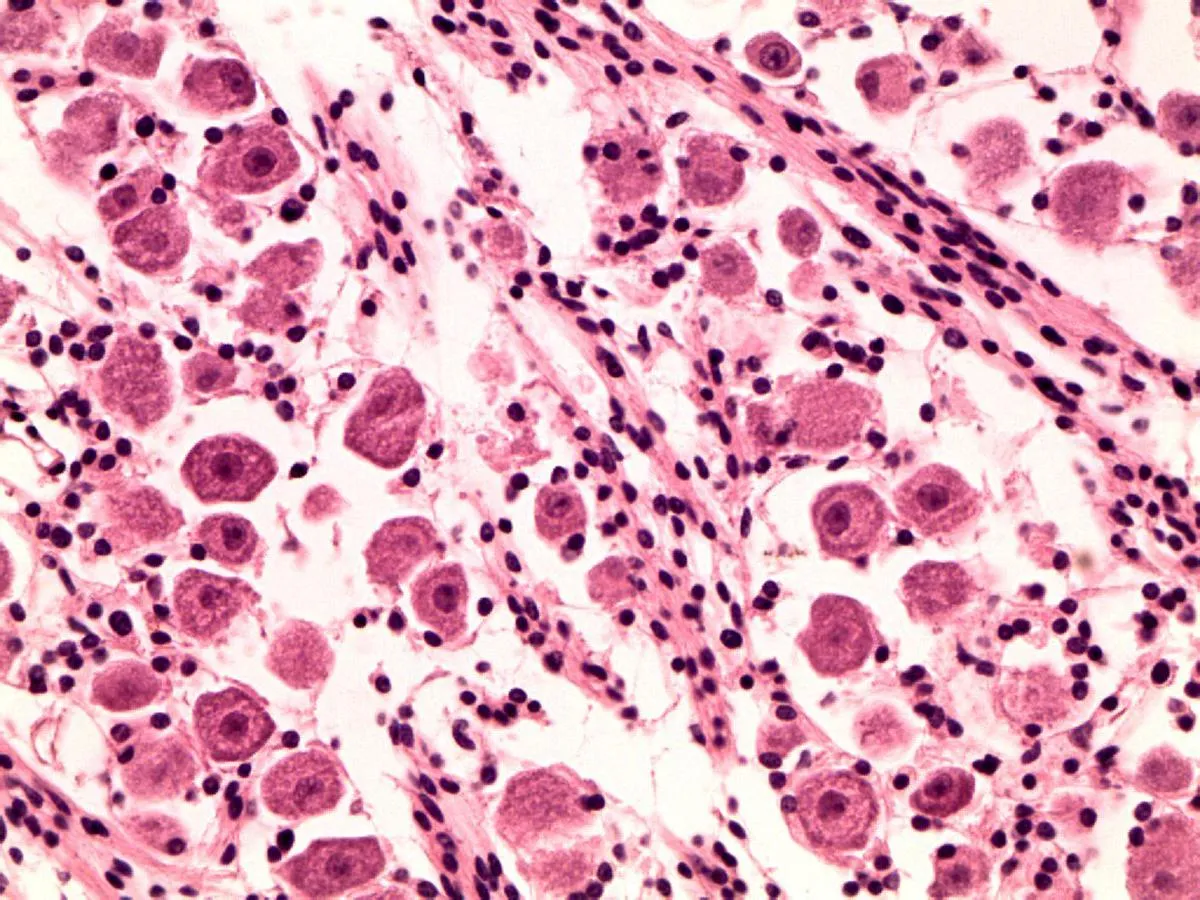
b: 25 w三叉神经节细胞形态
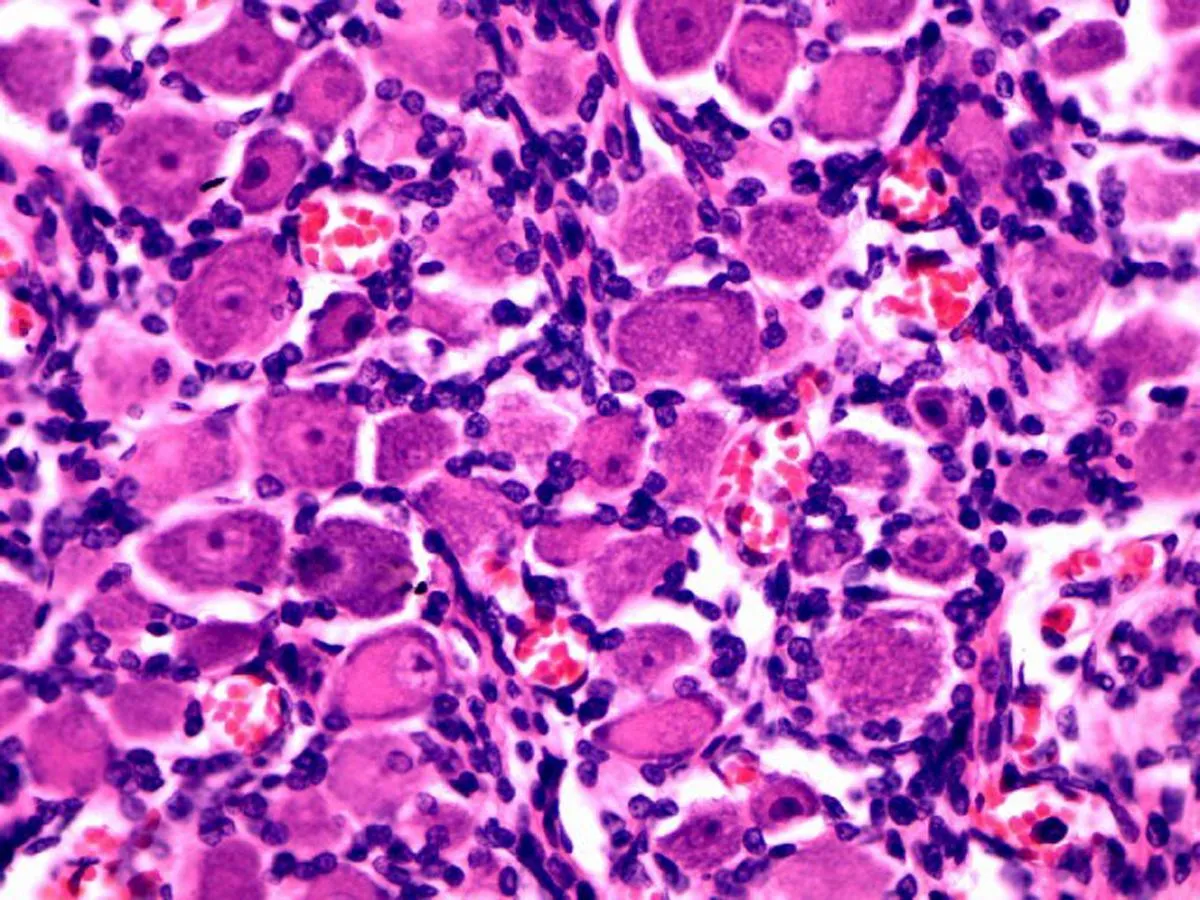
c: 27 w三叉神经节细胞形态
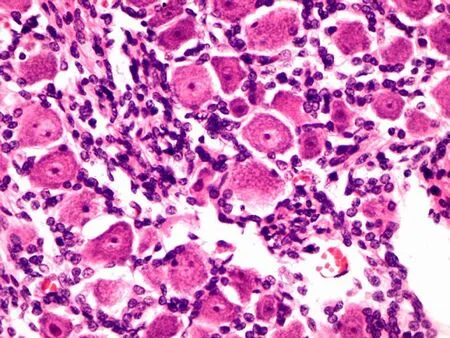
d: 32 w三叉神经节细胞形态
图1不同胎龄三叉神经节细胞光镜图(HE×400)
表1 不同胎龄组人胚胎三叉神经节神经细胞数目/个( ±s)

表1 不同胎龄组人胚胎三叉神经节神经细胞数目/个( ±s)
胎龄/w左侧右侧两侧平均1923841±11624071±10823956±1122024769±20424317±31424543±2592525078±16923981±20924529±1892724785±11825134±15224959±1353225420±32125943±28725681±304
表2 不同胎龄组人胚胎三叉神经节细胞直径比较( ±s)
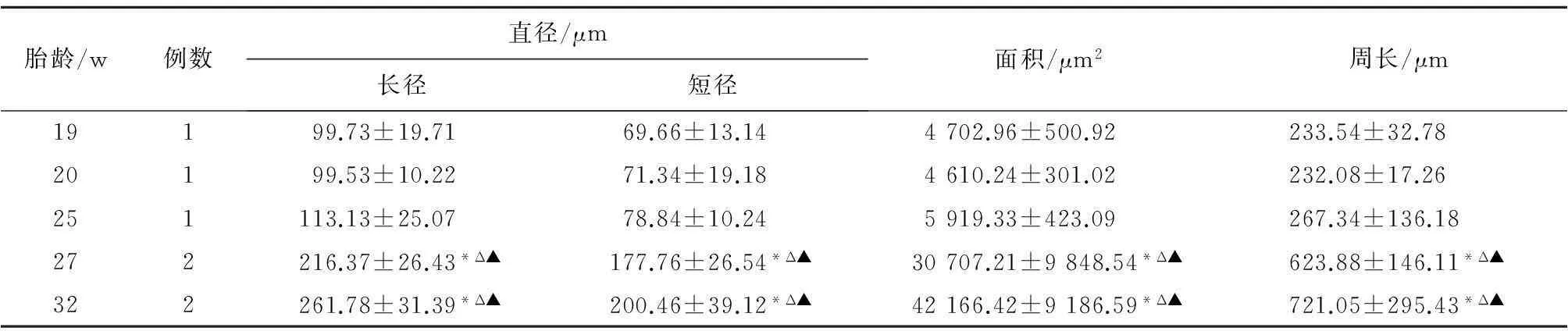
表2 不同胎龄组人胚胎三叉神经节细胞直径比较( ±s)
胎龄/w例数直径/μm长径短径面积/μm2周长/μm19199.73±19.7169.66±13.144702.96±500.92233.54±32.7820199.53±10.2271.34±19.184610.24±301.02232.08±17.26251113.13±25.0778.84±10.245919.33±423.09267.34±136.18272216.37±26.43*Δ▲177.76±26.54*Δ▲30707.21±9848.54*Δ▲623.88±146.11*Δ▲322261.78±31.39*Δ▲200.46±39.12*Δ▲42166.42±9186.59*Δ▲721.05±295.43*Δ▲
注:与19 w比较,*P<0.05; 与20 w比较,ΔP<0.05; 与25 w比较,▲P<0.05。
3讨论
神经元是机体所有细胞中最令人感兴趣和与众不同的特殊细胞。除了嗅神经元、海马的齿状回及少数特异脑区的神经元外,哺乳动物在胚胎发育的高峰期之后不再出现增殖和分裂。脑脊神经节内神经元的胞体主要成群地聚于神经节的周缘部分, 少量也散布在神经节中央神经纤维之间。每个神经元胞体有卫星细胞形成的囊包绕, 胞体发出的单个突起穿出卫星细胞囊, 再分叉为中央支和周围支, 构成神经节中的神经纤维束。
从20世纪开始就有学者对不同动物各种脑脊神经节细胞数目与直径进行观察和研究,从种类上看,对于同一种动物单个脑神经节比单个脊神经节的神经细胞数目要多,大白鼠三叉神经节细胞数目明显比颈、胸等脊神经数目要多[9-10]。从神经节分类看,则高级动物的同一种神经节的细胞数目较多, 如兔的三叉神经节数目为72 452个,而小鼠仅为13 864~15 212个[11-13],提示动物越高级,神经系统就越发达,神经节数目越多。另外有可能与神经分布区的大小有关。
本研究主要系统地通过光镜观察和分析软件对利用人类胚胎三叉神经节细胞大小、数量进行测量,从多角度、多途径、全方位对三叉神经节细胞发育进行研究。结果发现19~32 w胎龄胎儿两侧神经元数目并无明显差别,且随胎龄增长神经细胞数目变化不明显。与其他动物神经节比较,人三叉神经节细胞数目应该比兔、猫等个体较大动物多,但结果相反。可能因为所研究的动物都是成年的,而本研究采用的是胚胎期的标本,处于发育过程中。在此过程中,最初生成的神经元的数目远比以后存留的数目多,未能与靶细胞建立连接的神经元在一定时间内死亡,神经细胞数目决定于神经上皮细胞的分裂增殖及成神经细胞的迁移和死亡;其数目一般经历一个由少到多、由多到少的变化过程;开始神经元细胞的增加是由于上皮细胞的分裂增殖和成神经细胞的迁入所致;之后的减少是由于没有能建立正常联系的神经细胞死亡的结果[14]。这些变化主要发生在胚胎时期。本研究观察的是胚胎期神经细胞,但未发现此规律。本研究过程中细胞数目或许正在经历一个缓慢的由少到多的变化期,处在一个相对的稳定期,还未经历到迅速增长期。
Puri等[15]报道同一物种同一神经节(小鼠腰神经节)存在差别,这很可能与研究者运用了不同的测量方法有关;但最突出一个特点是同一神经节神经元胞体的大小有一较大变化范围,说明其胞体大小不一致。本研究也发现了相似的现象,人胚胎三叉神经节细胞直径大小在90~230 μm范围内变化。分析其原因有2个:(1)因为胚胎发育过程整个细胞胞体都在逐渐增加,本研究对象是一个动态连续的胎龄组,随胎龄增大,直径、面积及周长逐渐增大,在发育至25 w时出现一个迅速增长期。(2)对同一个神经节来说,细胞胞体的大小本身就有大、小之分。
总之,本研究发现三叉神经节细胞直径随胎龄增长而增大,面积和周长随胎龄增长而明显增大,尤其以25~32 w增长明显,说明此时期为三叉神经节细胞发育的一关键时期,但细胞数目无明显变化。
参考文献:
[1]吴励,古丽尼沙·克力木.人胚胎三叉神经节细胞的光镜和电镜观察[J].现代生物进展,2009,9(5):881-883.
[2]古丽尼沙·克力木.逆行追踪法对鱼类三叉神经节细胞的定位研究[J].现代生物医学进展, 2009,9(5):852-853,870.
[3]Kerem G, Yoshimoto M, Yamamoto N, et al. Somatotopic organization of the trigeminal ganglion cells in a cichlid fish, oreochromis (tilapia) niloticus[J].Brain Behv Evol,2005,65(2):109-126.
[4]Monteiro SM, Oliveira E, Fontaínhas-Fernandes A, et al. Structure of the branchial epithelium in the teleost Oreochromis niloticus [J].Morphol,2010,271(5):621-633.
[5 ]Huang F, He H, Fan W, et al.Orofacial inflammatory pain affects the expression of MT1 and NADPH-d in rat caudal spinaltrigeminal nucleus and trigeminal ganglion[J].Neural Regen Res,2013 ,8(32):2991-3002.
[6]Cady RJ, Hirst JJ, Durham PL. Dietary grape seed polyphenols repress neuron and glia activation in trigeminal ganglion and trigeminal nucleus caudalis [J].Mol Pain,2010,10(6):91.
[7]Wu L, Zhang H, Liao L, et al. Trigeminal ganglion morphology in human fetus[J].Microsc Res Tech,2013,76(6):598-605.
[8]Kongismark BW,Murply EA.Neruonal populations in the human brain[J]. Nature,1970,228(5278):1335-1336.
[9]吴励,古力尼沙·克力木.人胚胎三叉神经节神经元的躯体定位[J].解剖学杂志,2009,32(5):663-665.
[10] Pan A, Choy M, Prober DA, et al. Robo2 determines subtype-specific axonal projections of trigeminal sensory neurons[J]. Schier Development,2012,139(3):591-600.
[11]Cady RL,Hawkins JL,Durham PL, et al.Inclusion of Cocoa as a dietary supplement represses neuron and glia activation in trigeminal nucleus caudalis in response to chronic trigeminal nerve stimulation[J].Headache,2011,51(1):61-67.
[12]Takeda M,Takahashi M,Nasu M, et al. Peripheral inflammation suppresses inward rectifying potassium currents of satellite glial cells in the trigeminal ganglia[J].Pain,2011,152(9): 2147-2156.
[13]Kim BG, Dai HN, McAtee M, et al.Labeling of dendritic spines with the carbocyanine dye DiI for confocal microscopic imaging in lightly fixed cortical slices[J]. Neurosci Methods, 2007,62:237-243.
[14]高英茂,李和.组织学与胚胎学[M].2版,人民卫生出版社,2010:400-413.
[15]Puri J, Bellinger LL, Kramer PR, et al. Estrogen in cycling rats alters gene expression in the temporomandibular joint, trigeminal ganglia and trigeminal subnucleus caudalis upper cervical cord junction[J].Cell Physiol,2011,226(12):3169-3180.
(本文编辑杨晨晨)


