松花粉安全性毒理学研究
松花粉安全性毒理学研究
陆梅,严峰,罗海燕,王国斌,沈华,李蕾
(江苏吉贝尔药业有限公司,江苏 镇江 212009)
摘要:目的检验松花粉作为保健食品的安全性。方法按原卫生部发布的《保健食品功能学评价程序和检验方法规范(2003年版)》中安全性毒理学评价程序和检验方法规范进行检测。结果急性毒性实验表明该产品为无毒级;遗传毒性实验表明松花粉未见遗传毒性作用;大鼠30 d喂养实验表明未见异常。结论松花粉能够安全服用。
关键词:松花粉;急性毒性;遗传毒性;安全性
作者简介:陆梅,女,研究方向:药理学,E-mail:lmei1968@163.com
中图分类号:R285.1文献标识码:A
Toxicological research on the edible safety of pine pollen
LUMei,YANFeng,LUOHai-yan,WANGGuo-bin,SHENHua,LILei
(JiangsuJibeierPharmaceuticalCo.,Ltd.,Zhenjiang212009,China)
Abstract:ObjectiveTo evaluate the edible safety of pine pollen as health food.MethodsAccording to Health Food Function Evaluation Procedure and Inspection Method Specification,released by Ministry of Public Health,the safety and toxicology were tested as health food.ResultsAcute toxicity experiment showed that the product was a non-toxic level;Genetic toxicity experiment showed that pine pollen did not see the genetic toxic effect;30 days feeding experiments of rats showed no exception.ConclusionPine pollen can safely take.
Key words:Pine pollen;Acute toxicity;Genetic toxicity;Edible safety
松花粉是马尾松和油松的干燥花粉,在传统医药学中具有悠久的应用历史。《神农本草经》将松花粉列为“上品”。现代研究表明,松花粉中含有22种氨基酸(其中含有8种人体必需的氨基酸)、14种维生素、30余种矿物元素和上百种活性酶,此外还含有核酸、纤维素、不饱和脂肪酸、黄酮类物质、胆碱、磷脂等[1,2]。松花粉在我国有着悠久的应用历史,《中国药典》2005年版记载:“松花粉燥湿,收敛止血。用于湿疹、黄水疮、皮肤糜烂,脓水淋漓,外伤出血、尿布性皮炎[3]。近年来,随着人们对松花粉的研究不断深入,松花粉逐渐成为人们日常营养保健的佳品[4,5]。为研究松花粉作为保健食品及普通食品的安全性,对其进行了安全性毒理学研究。
1材料与方法[6]
1.1样品松花粉购自云南惠尔生物科技有限公司。经江苏省药品检验所刘午霞教授鉴定为松花粉。受试样品以蒸馏水制备成一定的浓度供实验用。
1.2试验动物清洁级SD大鼠,ICR种小鼠,由上海斯莱克实验动物有限责任公司提供,实验动物生产许可证号:SCXK(沪)2013-0016,使用许可证号:SYXK(沪)2009-0068。
1.3急性毒性试验雌、雄小鼠各10只(18~22 g)。采用最大耐受剂量法,剂量为10.0 g·kg-1,灌胃容量0.4 mL·(20 g)-1。小鼠禁食不禁水16 h后一次性灌胃给予受试物,观察14 d,记录动物的中毒表现及死亡情况。
1.4遗传毒性试验
1.4.1Ames试验采用常规平板掺入法,TA97a、TA98、TA100、TA102标准菌株和S9由上海市疾病预防控制中心提供。将松花粉样品配制成8、40、200、1 000、5 000 μg/皿进行试验,
1.4.2小鼠骨髓微核试验随机选小鼠50只,雌、雄小鼠各半(25~30 g),随机分为5组,每组雌、雄各5只。样品设2 500 mg·kg-1(低剂量)、5 000 mg·kg-1(中剂量)和10 000 mg·kg-1(高剂量)3个剂量组及阴性对照组(蒸馏水)和阳性对照(环磷酰胺,40 mg·kg-1)组。以0.4 mL·(20 g)-12次灌胃(间隔24 h),第二次灌胃后6 h取胸骨制片镜检。
1.4.3小鼠精子畸形试验选雄性小鼠25只(25~35 g),按体重随机分为5组。阴性对照组(蒸馏水)、样品设每天2 500 mg·kg-1(低剂量)、5 000 mg·kg-1(中剂量)和10 000 mg·kg-1(高剂量)3个剂量组,阳性对照(环磷酰胺,40 mg·kg-1)组。连续5 d灌胃给药[灌胃容量0.4 mL·(20 g)-1],每天1次,于第35天取双侧附睾制片镜检。
1.530 d喂养试验SD大鼠80只,雌、雄各半。大鼠按体重随机分为4组,每组20只,雌、雄各10只。受试物掺入饲料给予,动物单笼饲养,自由摄食摄水。另设:样品低、中、高三个剂量组,低剂量组:每天3.0 g·kg-1(相当于推荐剂量的50倍),即1 kg饲料含松花粉30.0 g;中剂量组:每天4.5 g·kg-1(相当于推荐剂量的75倍),即1 kg饲料含松花粉45.0 g;高剂量组:每天6.0 g·kg-1(相当于推荐剂量的100倍),即1 kg饲料含松花粉60.0 g。正常对照组:给予全价营养配合饲料;高剂量组调整饲料中蛋白质含量至与对照组相当。连续观察30 d。每天观察动物一般情况、体重生长状况、饲料消耗及利用率;实验结束采血进行血液学检查、血液生化学检查、脏器重量及病理组织学检查。
1.6实验数据分析和处理实验所得数据用SAS 6.12软件中的单因素方差分析进行多组间的比较。
2结果
2.1急性毒性试验实验期间,动物均未见中毒症状,14 d内动物无死亡。雌、雄小鼠经口MTD大于10.0 g·kg-1,属实际无毒级。
2.2遗传毒性试验
2.2.1Ames试验各剂量组(无论是否加入S9 混合液)回变菌落数均未超过自发回变数的2倍,并且未见剂量-反应关系。而各阳性对照组均显示强烈的诱变作用。表明在试验剂量范围内Ames试验结果为阴性,未见致突变作用。松花粉Ames试验结果见表1和表2。
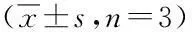
表1 松花粉第一次Ames试验结果
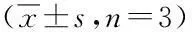
表2 松花粉第二次Ames试验结果
阳性对照:不加用S9:TA97a 500.0 μg/皿米帕林;TA98 6.0 μg/皿柔红霉素; TA100及TA102 1.0 μL/皿甲基磺酸甲酯;加用S9:TA97a、TA98、TA100 10.0 μg/皿2-氨基芴;TA102 50.0 μg/皿 1,8-二羟基蒽醌。
2.2.2小鼠骨髓微核试验各剂量组小鼠嗜多染红细胞(PCE)微核出现率、PCE/成熟红细胞(RBC)与阴性对照组均无显著性差异(P>0.05),而阳性对照组与阴性对照组相比差异具有显著性(P<0.05)。试验结果表明,小鼠骨髓微核试验结果为阴性,受试样品在本次试验剂量下未见致突变作用,结果见表3。
2.2.3小鼠精子畸形试验结果显示3个剂量组的精子畸形率分别为2.14%、2.26%、2.20%,与阴性对照组的精子畸形率相近(2.10%),无显著性(P>0.05)。而阳性对照组(环磷酰胺组)精子畸形率为5.02%,与阴性对照组的差异有显著性(P<0.05)。表明小鼠精子畸形试验结果为阴性,结果见表4。

表3 松花粉对骨髓细胞微核发生率的影响 ± s)

表4 松花粉对小鼠精子畸形率的影响
2.330 d喂养试验
2.3.1一般情况试验期间,各组动物反应敏捷,毛色正常,行动灵活,生长发育良好,未见行为异常,无明显中毒反应,无死亡发生。
2.3.230 d喂养动物体重情况各剂量组动物增重与对照组比较差异无显著性(P>0.05),结果见表5。
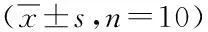
表5 松花粉30 d喂养试验对大鼠体重(g)的影响
2.3.3食物利用率以大鼠增重克数/100 g饲料计,各剂量组动物食物利用率与同性别对照组差异无显著性(P>0.05),结果见表6和表7。
2.3.4血液学检查见表8,试验各剂量组与对照组比较差异无显著性(P>0.05)。
表6 松花粉30 d喂养试验对大鼠食物利用率的影响 ± s, n=10)
表7 松花粉对大鼠各周食物利用率的影响 ± s, n=10)

表8 松花粉30 d喂养试验大鼠血液学检查结果 ± s, n=10)
续表8:

组别血红蛋白(g·L-1)红细胞(1012·L-1)白细胞(109·L-1)中性粒细胞(%)碱性粒细胞(%)酸性粒细胞(%)淋巴细胞(%)单核细胞(%)♂对照组134.2±12.37.76±0.9510.8±2.0017.3±4.50.9±0.61.4±0.577.9±5.32.5±0.7♂低剂量组141.8±9.98.89±0.6311.7±0.5818.4±3.91.3±0.51.7±0.576.3±4.92.3±0.8♂中剂量组139.2±15.77.66±1.0812.4±1.3919.1±3.51.1±0.61.6±0.775.6±3.92.6±0.8♂高剂量组147.4±17.37.91±0.6211.0±1.9616.9±3.10.9±0.71.4±0.578.7±4.72.1±0.9
2.3.5血液生化学检查结果见表9。

表9 松花粉30 d喂养试验大鼠血清生化测定结果 ± s, n=10)
注:与对照组比较,*P<0.05
由试验结果可见,雄性大鼠中剂量组的谷草转氨酶(AST)、雌性大鼠低剂量组的胆固醇(T-CHE)与对照组比较差异有显著性(P<0.05),但上述数值均在本实验室历史检测对照范围内,且无剂量反应关系,因此可以认为没有生物学意义。其余各指标与对照组比较差异未见显著性(P>0.05)。
2.3.6脏体比松花粉对大鼠脏器绝对重量及脏体比差异无显著性。组织病理学检查:大体解剖时,对照组及松花粉低、中、高3个剂量组大鼠脾、肝、肾、十二指肠、胃、卵巢、睾丸在体观察未见有意义的病理改变,镜下检查对照组和高剂量组间比较未见明显的病理差异,组织病理学检查结果均在正常范围内
3讨论
松花粉含有丰富的营养成分和生物活性物质,资源非常丰富。松花粉对人体的生理调节功能也很广泛,具有抗疲劳、延缓衰老、增强消化、保肝护肝、治疗前列腺疾病、美容以及心血管疾病的维护等[7,8],是不可多得的保健佳品,当前的松花粉产品大多是营养保健品,应加大开发力度,开发松花粉药品以及食品。此次通过对松花粉系统的毒性研究,表明了松花粉无论作为药品、保健食品还是普通食品都是安全的,这将为松花粉资源的进一步开发提供有力的支持。
参考文献:
[1]田志环.松花粉与人体健康[J].解放军保健医学杂志,2007,9(4):255-256.
[2]刘建文.珍贵的金色粉末松花粉[J].中国保健营养,2006,6:68-69.
[3]国家药典委员会.中华人民共和国药典2005年版(一部)[S].北京:化学工业出版社,2005:143.
[4]李娜. 松花粉营养成分及生物活性的研究进展[J]. 安徽农学通报,2008,14(13):125-127.
[5]孙素芬. 国内外对花粉应用的开发研究[J]. 北京农业科学,1992,10(6):38-41.
[6]中华人民共和国卫生部.保健食品检验与评价技术规范(2003年版)[S].中华人民共和国卫生部,2003:223.
[7]赵立新,喻陆. 松花粉抗衰老作用的实验研究[J]. 现代医学,2004,32(2):74-76.
[8]赵立新,喻陆.松花粉的作用机理及临床应用[J]. 吉林中医药,2004,24(1):49-51.

