提高硫酸氢氯吡格雷片内在质量
提高硫酸氢氯吡格雷片内在质量
谢寅鹤,吴大颖,杜彬,尹淑慧
(山东鲁抗医药股份有限公司研发中心,山东 济宁 272100)
摘要:目的比较硫酸氢氯吡格雷片在研药与原研药在四种溶出介质中的溶出曲线,计算f2相似因子,从而提高在研硫酸氢氯吡格雷片内在质量。方法分别测定2种片剂在pH 1.2盐酸缓冲液、pH 6.8磷酸盐缓冲液、pH 4.5磷酸盐缓冲液和水中的溶出曲线,通过f2相似因子确定相似性。结果在四种溶出介质中的f2相似因子分别为71.4、51.8、86.8、60.1。结论在研药与原研药在四种溶出介质中的溶出曲线相似。
关键词:硫酸氢氯吡格雷片;溶出曲线;相似因子;内在质量
作者简介:谢寅鹤,女,研究方向:药物制剂,E-mail:xieyinhe135@163.com
中图分类号:R927.11文献标识码:A
Improve the quality of Clopidogrel Bisulfate Tablets
XIEYin-he,WUDa-ying,DUBin,YINShu-hui
(R&DCenterofShandongLukangPharmaceuticalGroupLimitedCompany,Jining272100,China)
Abstract:ObjectiveTo improve the quality of generics of Clopidogrel Bisulfate Tablets,the stripping curves of brand name drug and generics of Clopidogrel Bisulfate Tablets in four different mediums were compared,then calculate the f2 factor.MethodsThe stripping curves of the two tablets in pH 1.2 hydrochloric acid-potassium chloride buffer solution,pH 6.8 phosphate buffer,pH 4.5 phosphate buffer and water were tested respectively,the similarity was investigated according to the f2 factor.ResultsThe f2 factors between two tablets in four different mediums were 71.4,51.8,86.8 and 60.1,respectively.ConclusionThere were significant similarity between the stripping curves of brand name drug and generics in four different mediums
Key words:Clopidogrel Bisulfate Tablets;Stripping Curves;Similarity factor;Quality
2012年11月国家食品药品监督管理局药品注册司根据《国家药品安全“十二五”规划》的要求制定仿制药质量一致性评价工作方案,该工作方案要求仿制药与被仿制药质量一致。对于口服固体制剂一致性评价方案除了要求该制剂各项基础指标与被仿制药一致外,最重要的是多种介质下的溶出曲线要与被仿制药一致。日本自 1998 年就开始实施“药品品质再评价工程”[1]陆续出版了日本参比制剂目录和橙皮书,其中详细罗列了所收载制剂的四条标准溶出曲线。现顺应这一要求,也为了提高在研药品的内在质量,我公司研制的硫酸氢氯吡咯雷片在处方工艺研究阶段采用不同溶出介质测定溶出度,并作不同溶出介质中的溶出曲线与被仿制药进行对比,以提高在研药的内在质量。
1仪器与试药
1.1仪器天津天大天发RCZ-8M溶出仪、RZQ-8D自动取样收集系统、UV-2450紫外分光光度计、KDQX-120超声波清洗仪。
1.2试药法国赛诺菲安万特商品波立维(规格:75 mg,批号:1A607)由杭州赛诺菲安万特制药有限公司分装。自研硫酸氢氯吡格雷片(规格:75 mg,批号:121015)由山东鲁抗医药股份有限公司生产。硫酸氢氯吡格雷片对照品(批号:100819-201102,含量:99.5%)来自中国药品生物制品检定所。分析纯盐酸、磷酸二氢钾、无水磷酸氢二钠。
2实验方法
2.1方法适用性试验4种溶出介质分别配制一系列不同浓度的硫酸氢氯吡格雷溶液,在240 nm条件下测吸光光度值,做每种介质中吸光光度值与浓度的标准曲线,计算R2值。通过试验得出在四种溶出介质中R2值分别为0.999 7、0.999 0、0.999 6、0.998 9,表明线性关系良好。根据验证结果,各辅料在240 nm处无吸收且溶出液在8 h内稳定,该方法适用于本品溶出度试验。
2.2参照日本《仿制药生物等效性试验指导原则》[2]中的溶出度研究内容,根据药物酸碱性而设定相应 pH。溶出介质配制方法如下:
①pH 1.2 盐酸缓冲液:精密量取浓盐酸18.0 mL,加水稀释至1 000 mL,摇匀即为0.2 mol·L-1盐酸,取85.0 mL 0.2 mol·L-1盐酸溶液加水稀释至200 mL,摇匀,即得。
②pH 4.5磷酸盐缓冲液:精密称取磷酸二氢钾6.80 g,加水溶解并稀释至1 000 mL,即得。
③pH 6.8磷酸盐缓冲液:取磷酸二氢钾1.7 g,无水磷酸氢二钠1.775 g,加水溶解并定容至1 000 mL,即得。
④溶出介质水:采用实验室蒸馏水,以上各介质配制pH 误差应控制在±0.05[3]。
2.3实验步骤及结果取1 000 mL溶出介质,溶出度测定第二法,转速50 rpm,37 ℃,RZQ-8D自动取样收集系统经5、10、15、20、30、45、60、90、120、180 min时取溶液5 mL(并补液),滤过,均稀释一倍后摇匀作为供试品溶液[4]。精密称取16.3 mg硫酸氢氯吡格雷对照品,于50 mL容量瓶中,加20 mL甲醇溶解,溶出液稀释并定容,该溶液稀释10倍后为对照品溶液。取上述两种溶液按照紫外—可见分光光度法,在240 nm处测定吸光度,计算每片溶出度。每次投药量6片,6片平均溶出度和相对标准偏差见下表1~4。

表1 pH 4.5磷酸盐缓冲液中累积溶出度及均一性

表2 水中累积溶出度及均一性

表3 pH 1.2盐酸缓冲液中累积溶出度及均一性

表4 pH 6.8磷酸盐缓冲液中累积溶出度及均一性
根据以上结果,作时间(min)与6片平均累积溶出量(%)的溶出曲线,结果见图1~4。

图1 原研与自制品在pH 4.5磷酸盐缓冲液中溶出曲线

图2 原研与自制品在水中溶出曲线
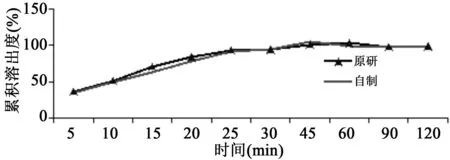
图3 原研与自制品在pH 1.2的盐酸缓冲液中溶出曲线

图4 原研与自制品在pH 6.8磷酸盐缓冲液中溶出曲线
根据口服固体制剂溶出度实验技术指导原则,采用非模型依赖的相似因子f2法比较原研药与自制药的体外溶出度差异,以考察其内在质量的相似性[5]。f2越大,表明两条曲线相似度越高。一般认为如果50≤f2≤100,则两种制剂溶出曲线相似。以上曲线的f2值计算结果见表5。根据表中结果及溶出曲线相似性的判断标准[6],两种制剂在4种溶出介质中的溶出行为相似。

表5 2种片剂在不同溶出介质中的 f 2值
3讨论
3.1测试硫酸氢氯吡咯雷片两种片剂在水中的溶出度时,原研和自制片剂45 min时的累积溶出度分别为91.20%和88.76%,而60 min时分别为85.53%和80.47%,较45 min时均有所降低,60 min后两者又缓慢上升。理论上随着时间的推移累积溶出度应该会越来越大,实际却稍有降低(原因有待进一步考证),但两者的溶出行为相似,溶出曲线相似。
3.2在pH 4.5的磷酸盐缓冲液中,6片原研药的溶出度相对标准偏差(RSD)在20 min之前均大于10%,可能与批与批之间的差异有关。但自制品的RSD均满足小于10%的要求。
3.3通过以上比较发现两种片剂在四种溶出介质中的溶出曲线具有很好的相似性,更好地确保了我厂研发的硫酸氢氯吡咯雷片内在质量与原研片的一致性。
参考文献:
[1]谢沐风.评“日本药品品质再评价工程”有感[J].药品技术审评论坛, 2005, 3:21-26.
[2]谢沐风.日本仿制药生物利用度指导原则(日本劳动厚生省颁布)[J].药品技术审评论坛, 2008, 3:30-40.
[3]Sorbera LA,Revel L,Rabasseda X,et al.TMX-67:treatment of gout and hyperuricemia xanthine oxidase inhibitor [J].Drugs Future,2001,26(1):32-38.
[4]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010:附录Ⅹ E.
[5]田莉,高晓黎.复方甘草酸苷片的溶出度研究[J].中国现代应用药学,2009,26(6):471-474.
[6]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-311.

