人β防御素4对神经母细胞瘤细胞增殖凋亡及Caspase-3蛋白表达的影响
人β防御素4对神经母细胞瘤细胞增殖凋亡及Caspase-3蛋白表达的影响*
曹玉红1张静怡2张光运3曹艳华4
(1. 第四军医大学西京医院儿科,陕西 西安 710032; 2. 西安交通大学医学院第一医院,陕西 西安 710061;
3.第四军医大学西京医院神经内科,陕西 西安 710032;4.济南军区总医院儿科,山东 济南250031)
【摘要】目的观察人β防御素4(HBD4)对神经母细胞瘤(NB)细胞的杀伤作用,探讨HBD4对NB细胞增殖、凋亡及Caspase-3蛋白表达的影响。方法将HBD4作用于NB细胞,根据HBD4终浓度将NB细胞分为A、B、C 3组,浓度分别为5、10、20 mg·L-1;HBD4作用时间分别为12、24、48h。噻唑蓝(MTT)法测定HBD4对NB细胞增殖的抑制作用,流式细胞仪检测HBD4作用于NB细胞后细胞凋亡情况;分光光度法检测HBD4对NB细胞Caspase-3蛋白表达的影响。结果MTT检测结果:NB细胞抑制率均随HBD4浓度的升高而升高(P<0.01),随HBD4作用时间的延长而升高(P<0.01),提示HBD4对NB细胞的抑制作用具有时间和剂量依赖性;流式细胞仪检测结果显示:A、B、C三组NB细胞凋亡率均高于对照组(P<0.01)。三组NB细胞凋亡率比较亦有显著差异(P<0.01),说明随药物浓度的增加,细胞凋亡率呈增高趋势; 分光光度法检测结果显示:A、B、C三组NB细胞Caspase-3含量均高于对照组(P<0.01)。三组NB细胞Caspase-3含量比较亦有显著差异(P<0.01),说明随药物浓度的增加,细胞Caspase-3含量呈增高趋势。结论HBD4对NB细胞增殖具有抑制作用;HBD4可诱导NB细胞凋亡;HBD4可能是通过激活Caspase-3诱导NB细胞凋亡。
【关键词】人β防御素4; 神经母细胞瘤; Caspase-3; 细胞凋亡
【中图分类号】R 329.2+8【文献标志码】A
基金项目:陕西省自然科学基金(2012JM4054); 陕西省科技攻关计划(2009K12-01)
通讯作者:张光运,E-mail: zhgyun@fmmu.edu.cn
收稿日期:( 2014-07-01; 编辑: 张文秀)
Influence of human β-defensin 4 on the proliferation, apoptosis and Caspase-3 protein expression of neuroblastoma cellsCAO Yuhong1, ZHANG Jinyi2, ZHANG Guangyun3,etal
(1.DepartmentofPediatrics,XijingHospital,TheFourthMilitaryMedicalUniversity,Xi'an710032,China;
2.TheFirstAffiliatedHospitalMedicineCollegeofXi'anJiaoTongUniversity,Xi'an710061,China;
3.DepartmentofNeurology,XijingHospital,TheFourthMilitaryMedicalUniversity,Xi'an710032,China;
4.DepartmentofPediatrics,GeneralHospitalofJinanMilitaryDistrict,Jinan250031,China)
Abstract【】ObjectiveTo examine cytotoxicity of human β defensin 4(HBD4)on neuroblastoma (NB) cell and explore the influence of human β-defensin 4 on proliferation, apoptosis and Caspase-3 protein expression of NB cells. MethodsIn this research, NB cells were treated with HBD4. According to final concentration of HBD4, NB cells were divided into 3 groups: A, B and C with the corresponding concentrations of 5, 10, and 20 mg.L-1, respectively. The reaction times were 12, 24 and 48h respectively. Methyhhiazolyldiphenyl- tetrazoliumbromide(MTT)assay was adopted to detect the inhibitory effect of HBD4 on NB cell proliferation. In addition, NB Cell apoptosis was assessed by flow cytometry and Caspase-3 activity was detected by spectrophotometry. ResultsMTT assay showed the inhibitory rate of NB cells treated with HBD4 increased with the increase of HBD4 concentration and the prolongation of acting time of HBD4(P<0.01), which indicated that HBD4 inhibited the proliferation of NB cells in a time and dose dependent manner. Flow cytometry assay showed that NB cell Apoptosis rates of group A, B and C were all higher than that of the control group(P<0.01), and there were statistically significant differences among the three groups(P<0.01), which suggested that the apoptosis rate increased with the increase of HBD4 concentration. In the third place, Spectrophotometry assay showed that Caspase-3 activity of group A, B and C were all higher than that of the control group(P<0.01), and the differences among the three groups were statistically significant(P<0.01), which suggested that the Caspase-3 activity increased with the increase of HBD4 concentration. ConclusionHBD4 inhibits the proliferation of NB cells by means of inducing cellular apoptosis via increasing Caspase-3 activity.

【Key words】Human β defensin 4; Neuroblastoma; Caspase-3; Apoptosis
神经母细胞瘤(NB)是儿童一种常见的恶性实体肿瘤,大部分患儿在就诊时已广泛转移,病死率极高。传统的放疗或化疗毒副作用大,对肿瘤细胞和正常细胞均有不同程度的杀伤作用,不可避免地造成多脏器损害。另外肿瘤细胞对多种抗癌药物产生抗药性,是肿瘤化疗失败的主要原因之一[1-4]。因此研究开发新一代毒副作用小、又能克服耐药性的抗肿瘤药物成为目前肿瘤防治研究的焦点。近几年研究发现,一些具有广谱杀菌活性的防御素,可以特异性杀伤某些肿瘤细胞,抑制肿瘤生长和增殖,但对正常人体细胞不造成破坏[5-12]。人β防御素4(HBD4)是2001年Jose-Ramon发现的一种新型β防御素。研究表明,HBD4对多种细菌具有杀伤作用,HBD4对人体各个系统的先天免疫尤其是粘膜和上皮的防御起非常重要的作用[13]。HBD4的抗肿瘤作用及其相关机制研究国内罕见报道。我们将HBD4作用于体外培养的NB细胞,观察HBD4对NB细胞增殖及凋亡作用的影响,并初步探讨其作用机制。
1材料与方法
1.1材料重组人β防御素4购自上海高创化学科技有限公司。细胞系:患儿,女,4岁,经病理证实为NB,Evans分期Ⅳ期,并全身骨髓转移,术中取新鲜肿瘤标本,体外细胞培养,制备细胞系,已传至45代。Caspase-3活性检测试剂盒购自碧云天生物技术有限公司。常规生化试剂为国产或进口分析纯产品。
1.2方法
1.2.1MTT法检测HBD4对NB细胞增殖的影响取对数生长期NB细胞,制成细胞悬液,以1×104个/孔,接种于96孔培养板,分别加入不同浓度HBD4,加DMEM培养液至200μL。实验组根据HBD4终浓度将NB细胞分为A、B、C 3组,浓度分别为5、10、20mg·L-1。对照组只加DMEM培养液。HBD4作用时间分别为12、24、48h,每一浓度对应的每个时间点均做4个复孔,置37℃、50mL·L-1二氧化碳(CO2)孵箱中培养,倒置相差显微镜下观察细胞形态。培养到相应时间后,每孔加入MTT溶液[2g·L-1磷酸盐缓冲液(PBS)]50μL,37℃孵育4h,弃上清,每孔加入二甲亚砜150μL,振荡10min,测每孔A490nm值,根据公式:抑制率=(对照组A490nm-观察组A490nm)/对照孔A490nm,计算抑制率。
1.2.2流式细胞仪检测HBD4对NB细胞凋亡的影响接种对数生长期NB细胞于6孔培养板,1×105个/孔,每孔2mL。实验组加入HBD4,使HBD4终浓度达到上述A、B、C 3个浓度,对照组设置同前,放人CO2孵箱中培养24h,胰酶消化,将细胞分别转移至圆底离心管内,PBS洗涤,加入2mL预冷的70%酒精,4℃固定30min,PBS洗涤,加入核糖核酸酶A于5001μL 1×PBS中,37℃孵育30min,PBS洗涤,加入碘化丙啶于500μL 1×PBS中,室温避光孵育30min,混匀,过300目筛网,置流式管中,进行细胞凋亡情况测定。
1.2.3分光光度法检测HBD4对凋亡相关蛋白Caspase-3表达的影响取对数生长期细胞,调整细胞浓度为4×106个/mL,接种于48孔培养板,每孔250μL。实验组及对照组设置同1.2.2,置于CO2培养箱培养24小时,600g 4℃离心5min收集细胞,小心吸除上清,同时确保尽量没有细胞被吸除,PBS洗涤一次。同前吸除上清后,加入50μL裂解液,重悬细胞,冰浴裂解15 min。之后4℃ 16000g离心10min,上清转移到预冷的离心管中。按照Caspase-3活性检测试剂盒说明书操作,加入AC-DEVD-pNA 10μL,上酶标仪405nm处检测caspase-3活性。
2结果
2.1HBD4对NB细胞增殖的影响MTT检测结果显示:不同浓度HBD4作用于NB细胞相同时间,抑制率均随浓度升高而升高(P<0.01);相同浓度HBD4分别作用于NB细胞12,24,48h,抑制率随时间延长而升高(P<0.01),提示HBD4对NB细胞的杀伤作用具有时间和剂量依赖性,见表1。
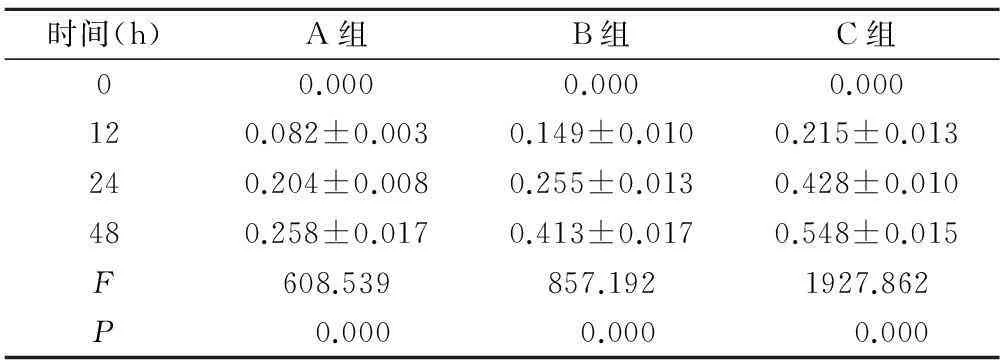
表1 不同浓度HBD4对NB细胞的抑制率比较
2.2HBD4对NB细胞凋亡的影响流式细胞仪检测结果显示:A、B、C三组NB细胞凋亡率分别为(12.275±0.685) %、(18.300±0.356)%、(26.150±0.656)%,对照组凋亡率为(1.575±0.299)%,三组细胞凋亡率均高于对照组(P<0.01)。三组NB细胞凋亡率比较亦有显著差异(P<0.01),说明随药物浓度的增加,细胞凋亡率呈增高趋势(表2)。
2.3HBD4对Caspase-3蛋白表达的影响A、B、C三组NB细胞Caspase-3 A值分别为0.155±0.013、0.245±0.013、0.328±0.010,对照组Caspase-3 A值为0.078±0.006,三组细胞凋亡率均高于对照组(P<0.01)。三组NB细胞Caspase-3含量比较亦有显著差异(P<0.01),说明随药物浓度的增加,细胞Caspase-3含量呈增高趋势(表2)。
表2HBD4对NB细胞凋亡率及Caspase-3表达的影响
Table 2Influence of HBD4 on NB cell apoptosis and expression of caspase-3
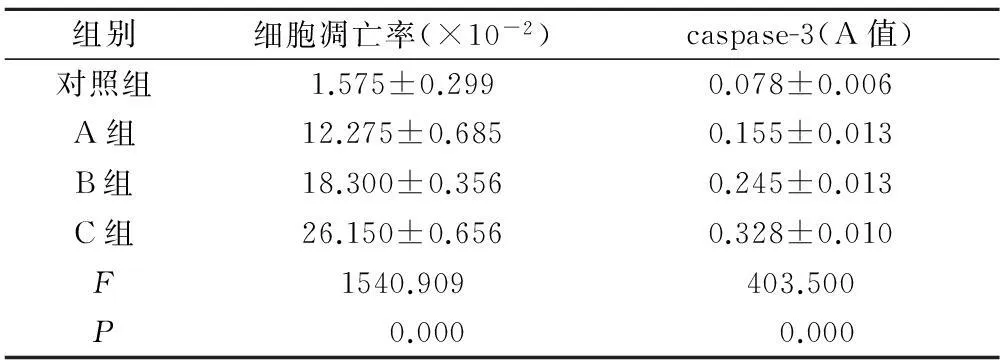
组别细胞凋亡率(×10-2)caspase-3(A值)对照组1.575±0.2990.078±0.006A组12.275±0.6850.155±0.013B组18.300±0.3560.245±0.013C组26.150±0.6560.328±0.010F1540.909403.500P0.0000.000
3讨论
国内外研究发现,防御素对白血病、淋巴瘤及多种实体瘤细胞如:肝癌、肾癌、前列腺癌、膀胱癌细胞等具有杀伤作用[5-13]。防御素对肿瘤细胞的杀伤活性大于非肿瘤细胞, 因此在相同剂量下, 防御素只能杀死肿瘤细胞, 对正常细胞无杀伤作用;体内防御素水平可能成为判断某些肿瘤发生、疗效及预后的生物指标。目前关于HBD4对NB细胞的杀伤作用及机制的研究国内外鲜见报道。本研究采用HBD4为研究药物,观察HBD4对NB细胞生长的影响,结果表明:HBD4对NB细胞有杀伤作用,并且其杀伤作用具有时间和剂量依赖性。这为NB患儿提供了一种新的治疗方法。
尽管对防御素细胞毒作用的确切机制还不十分清楚, 但目前研究发现,防御素的抗肿瘤作用机制主要包括以下几个方面:①对细胞膜的攻击作用:肿瘤细胞表面较正常细胞带有较多的负电荷, 通过静电作用吸引大量含正电荷的防御素黏附于肿瘤细胞表面, 使肿瘤细胞膜的正常屏障破坏。细胞膜上的电压依赖性离子通道形成, 导致细胞膜通透性增加, 胞内物质泄漏, 导致细胞死亡。②对肿瘤细胞骨架的断裂作用。③对线粒体的损伤作用。④对染色体的破坏作用。⑤诱导肿瘤细胞凋亡等[14]。
凋亡途径包括外在(细胞质) 和内在(线粒体)途径。外在途径是通过肿瘤坏死因子受体超家族成员的Fas死亡受体触发引起; 内在途径是刺激引起细胞色素C从线粒体释放并激活死亡信号,而Caspase蛋白酶家族,在这个过程中起了重要作用,其中尤以Caspase-3被认为与真核细胞的凋亡密切相关,受到国内外学者的广泛研究和关注。其机制主要是参与了凋亡信号的转导和使DNA修复分子、细胞外基质蛋白、骨架蛋白等关键蛋白的失活等,而达到诱导细胞凋亡的作用[15]。已证明,高浓度的人中性粒细胞防御素1(HNP1)在体外对多种肿瘤细胞具有细胞毒性作用,可直接诱导肿瘤细胞凋亡[10]。由HNP1诱导的肿瘤细胞凋亡涉及这两种途径: 一方面, HNP1能促进淋巴细胞释放出TNFA, 通过受体介导的细胞凋亡机制导致肿瘤细胞死亡; 另一方面, HNP1还可通过线粒体途径介导肿瘤细胞凋亡。人β防御素1能抑制前列腺癌DU145 和PC3细胞生长,引起肿瘤细胞的快速溶解以及半胱天冬酶介导的前列腺癌细胞凋亡[9]。
4结论
HBD4对NB细胞增殖具有抑制作用;HBD4可诱导NB细胞凋亡,而且HBD4可能是通过激活Caspase-3诱导NB细胞凋亡。
【参考文献】
[1]Sung KW. Treatment of high-risk neuroblastoma [J]. Korean J Pediatr, 2012, 55 (4): 115-120.
[2]Li K, Dong K, Gao J,etal. Neuroblastoma management in Chinese children [J]. J Invest Surg, 2012, 25(2):86-92.
[3]李仲荣. 神经母细胞瘤的临床诊断与治疗[J].实用儿科临床杂志,2012,27(23):1781-1784.
[4]Matthay KK, George RE, Yu AL. Promising therapeutic targets in neuroblastoma [J]. Clin Cancer Res, 2012, 18(10):2740-2753.
[5]Shuyi Y, Feng W, Jing T,etal. Human beta-defensin-3 (hBD-3) upregulated by LPS via epidermal growth factor receptor (EGFR) signaling pathways to enhance lymphatic invasion of oral squamous cell carcinoma [J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2011, 112(5):616-625.
[6]Zhuravel E, Shestakova T, Efanova O,etal.Human beta-defensin-2 controls cell cycle in malignant epithelial cells: in vitro study[J]. Exp Oncol, 2011, 33(3):114-120.
[7]Winter J, Pantelis A, Reich R,etal. Human beta-defensin-1, -2, and -3 exhibit opposite effects on oral squamous cell carcinoma cell proliferation [J]. Cancer Invest, 2011, 29(3): 196-201.
[8]Yuhong Cao, Guang Yun Zhang,Sheng Quan Cheng,etal. Antitumor Activity of Human β Defensin 4 in Vitro [J]. Journal Of US-China Medical Science,2011,8(3):134-142.
[9]Bullard RS, Gibson W, Bose SK,etal. Functional analysis of the host defense peptide Human Beta Defensin-1: new insight into its potential role in cancer [J]. Mol Immunol, 2008, 45(3):839-848.
[10] Li D, Qin Q, Wang XY,etal. Intratumoral expression of mature human neutrophil peptide-1 potentiates the therapeutic effect of doxorubicin in a mouse 4T1 breast cancer model [J]. Oncol Rep, 2014, 31(3):1287-1295.
[11] Zhao L,Lu W. Defensins in innate immunity [J]. Curr Opin Hematol, 2014, 21(1):37-42.
[12] Li D, Wang W, Shi HS,etal. Gene therapy with Beta-defensin 2 induces antitumor immunity and enhances local antitumor effects [J]. Hum Gene Ther, 2014, 25(1):63-72.
[13] García JR, Krause A, Schulz S,etal. Human beta-defensin 4: a novel inducible peptide with a specific salt-sensitive spectrum of antimicrobial activity[J]. Faseb J, 2001, 15(10): 1819 -1821.
[14] 彭效祥,赵荣兰. 防御素抗肿瘤的研究进展[J].中国肿瘤生物治疗杂志,2010, 17(6): 687-691.
[15] 龙慧,李景和. TGF-β与Caspase 在肿瘤细胞凋亡中的作用[J]. 现代生物医学进展, 2009, 9(13):2576-2578.

