子痫前期患者子宫蜕膜自然杀伤细胞的表型研究
子痫前期患者子宫蜕膜自然杀伤细胞的表型研究
姜妮娜
(青岛市胶州中心医院, 山东 青岛 266300)
【摘要】目的观察先兆子痫患者子宫蜕膜自然杀伤细胞(dNK细胞)的表型。方法选取2012年12月至2013年5月在我院产科住院的30例子痫前期患者作为病例组,随机选取同期在我院产前检查正常的晚期妊娠妇女30例作为正常对照组。收集孕晚期子宫蜕膜组织,机械研磨加梯度离心法提取蜕膜内单核细胞,流式细胞技术(FCM)筛选出dNK细胞,并检测dNK细胞表面CD56及CD16的表达情况。结果病例组与正常对照组CD56bright CD16- CD3- dNK细胞的数量均明显多于CD56dim CD16+ CD3- dNK细胞(P<0.05),病例组与正常对照CD56bright CD16- CD3- dNK细胞所占比例无显著差异(P>0.05),CD56dim CD16+ CD3- dNK 细胞所占比例也无显著差异(P>0.05)。结论先兆子痫患者与正常孕妇孕晚期子宫蜕膜内dNK细胞表型没有明显不同,均以CD56bright CD16- CD3-亚型为主。
【关键词】子痫前期; 子宫蜕膜; 自然杀伤细胞; 细胞表型; 母-胎界面
【中图分类号】R 714.24+5【文献标志码】A
收稿日期:( 2014-02-10; 编辑: 张文秀)
Study on phenotype of decidual NK cells in preeclampsia patientsJIANG Nina
(DepartmentofObstetrics,JiaozhouCentralHospitalofQingdao,Qingdao266300,Shandong,China)
Abstract【】ObjectiveTo investigate the phenotype of uterine decidual natural killer cells(dNK cells) in preeclampsia patients. Methods30 women with preeclampsia were selected as case group. 30 normal pregnant women were selected as normal control group. The decidual tissues were sampled immediately after caesarean section. The mononuclear cells were extracted from the tissues by means of mechanic grinding and gradient centrifugation. The technique of flow cytometry was used for dNK cell sorting and the expression of CD56 and CD16 on the surface of cells was also examined. ResultsIn case group and normal control group, the proportions of CD56bright CD16- CD3- dNK cells were significantly higher than those of CD56dim CD16+ CD3- dNK cells(P<0.05). Neither the CD56bright CD16- CD3- subtype nor the CD56dim CD16+CD3- subtype had statistical difference between case group and normal control group(P>0.05). ConclusionThe phenotypes of dNK cells from the women with preeclampsia and from healthy pregnant women are both dominated by CD56bright CD16- CD3- subtype, without significant difference.
【Key words】Preeclampsia; Uterine decidua; Natural killer cells; Cell phenotype; Maternal-feta linter face
子痫前期是孕妇妊娠期特有的严重并发症之一。在我国人群中发病率高达9.4%,直接影响母儿结局,危害母婴健康,但其发病原因和机制尚不清晰。研究表明,该病的发生与母体免疫系统功能混乱有关[1-2]。母-胎界面的局部免疫微环境在妊娠的发生和维持以及临产的发动中发挥重要作用。子宫蜕膜自然杀伤细胞(decidual natural killer cells, dNK cells)是母-胎界面最主要的免疫细胞[3],在局部发挥重要的免疫调节作用,主要包括两种表型:CD56brightCD16-CD3-和CD56dimCD16+CD3-,两者的平衡是正常妊娠的重要因素,已知正常妊娠者体内的dNK细胞以CD56brightCD16-CD3-亚型为主[4]。子痫前期患者的蜕膜局部免疫微环境变化可能导致免疫耐受失衡而影响妊娠,Wilczynski等[5]称子痫前期患者dNK表型存在变化,CD56dimCD16+CD3-亚型增加,而周等[6]称dNK细胞表型并未改变。顾及到母-胎界面在妊娠中各种因素,本研究主要对子痫前期患者孕晚期子宫蜕膜内dNK细胞进行了表型研究。
1资料与方法
1.1临床资料选择2012年12月至2013年5月在我院住院的子痫前期患者30例作为病例组,所有患者无其他妊娠合并症及并发症,随机选取同期在我院产前检查正常的晚期妊娠妇女30例作为正常对照组。两组孕妇无血缘关系,平均年龄、孕周、孕产次均无统计学差异(P>0.05)。所有受试者既往没有高血压及肝脏疾病史,没有糖尿病等其他免疫性疾病史,没有肾脏疾病、器官移植、免疫治疗及输血史,没有传染病病史,月经规则,末次月经清楚。正常晚期妊娠及子痫前期的诊断参照第7版《妇产科学》[7]。
1.2主要试剂、仪器RPMI-1640培养基和胎牛血清(FBS)购自美国Hyclone公司,人淋巴细胞分离液(Ficoll)和双抗(青霉素、链霉素)购自上海华精生物有限公司,荧光素标记的小鼠抗人单克隆抗体( CD3-PE-Cy5、CD16-FITC和CD56-PE) 购自BD Pharmigen 公司,小鼠IgG1- PE- Cy5、IgG1-FITC和IgG1- PE购自R&D 公司,苔盼蓝购自上海碧云天生物技术有限公司,流式细胞检测仪为BD FACE Calibur公司产品。
1.3方法
1.3.1标本采集和单细胞悬液制备在知情同意的情况下,所有研究对象施行剖宫产手术,胎盘、胎膜娩出后,立即用眼科剪剪取胎盘附着部位宫壁的蜕膜组织约5 g,用磷酸盐缓冲液(PBS)反复冲洗所取蜕膜组织,以洗去组织中的血液、胎粪、胎脂等物质,然后将其置于盛有RPMI-1640完全培养液(含胎牛血清10%、青霉素100 U/L和链霉素100 mg/L)的平皿中,用眼科剪反复剪碎至直径1 mm 左右,用研磨棒轻轻研磨,放在200目不锈钢网上过滤,收集细胞悬液。将Ficoll 平铺于15 mL无菌离心管中,再将收集的细胞悬液按照1:1的比例平铺于Ficoll上(形成清楚的分界面),4℃、2000 r/min离心15 min,然后吸取中间的云雾样絮状物层并置于另一支无菌离心管中。PBS洗涤2次(4℃、1500 r/min离心5 min),最后1次离心弃上清后,加入RPMI-1640完全培养液轻轻吹打混合均匀,调整细胞浓度约为1×108/L,即得单细胞悬液。取少许细胞悬液,苔盼蓝拒染法检测细胞活力> 90%。
1.3.2dNK细胞表型检测每份标本取2管蜕膜单细胞悬液各100 μL,分别标记为1号和2号,1号管中均加入单克隆抗体小鼠抗人CD3-PE-Cy5、CD16-FITC和CD56-PE各15 μL,2号管中均加入小鼠IgG1- PE- Cy5、IgG1-FITC和IgG1- PE各15 μL作为同型对照,充分混匀,4℃避光孵育30 min,1500 r/min 离心5 min,弃上清,PBS洗涤2次,每管内加入200 μL PBS重悬细胞。用流式细胞仪进行检测。
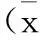
2结果
经流式细胞技术分选,荧光抗体标记CD56表达阳性、CD3表达阴性(CD56+CD3-)的细胞为dNK细胞。根据dNK细胞表面CD56表达水平的高低及是否表达CD16,将其分为CD56brightCD16-CD3-dNK细胞和CD56dimCD16+CD3-dNK细胞。
2.1病例组和正常对照组中dNK细胞亚群的分布及比较病例组中子痫前期患者dNK细胞以CD56brightCD16-CD3-亚型为主,其数量明显多于CD56dimCD16+CD3-亚型,差异有统计学意义(P<0.05);正常对照组中dNK细胞也以CD56brightCD16-CD3-亚型为主,其数量明显多于CD56dimCD16+CD3-亚型,差异有统计学意义(P<0.05),见表1。
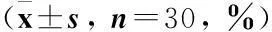
Tab.1The comparison of CD56brightCD16-CD3-dNK cells and CD56dimCD16+CD3-dNK cells
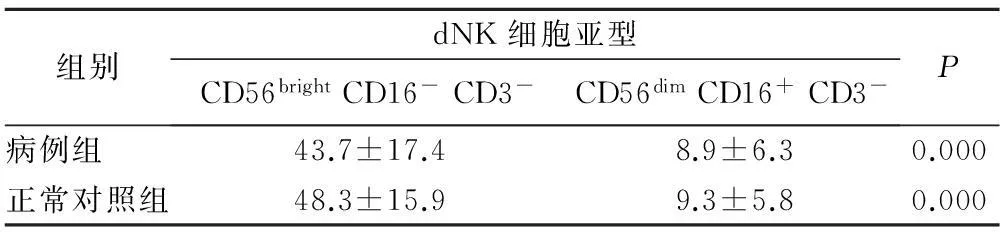
组别dNK细胞亚型CD56brightCD16-CD3-CD56dimCD16+CD3-P病例组43.7±17.48.9±6.30.000正常对照组48.3±15.99.3±5.80.000
2.2病例组与正常对照组之间dNK细胞各亚型的比较分别对病例组与对照组之间的CD56brightCD16-CD3-dNK细胞和CD56dim CD16+ CD3- dNK细胞进行比较,两者之间差异均无统计学意义(P>0.05),见表2。

Tab.2The comparison of dNK cell subtypes

dNK细胞免疫表型组别病例组正常对照组PCD56brightCD16-CD3-43.7±17.448.3±15.90.290CD56dimCD16+CD3-8.9±6.39.3±5.80.799
3讨论
从免疫学角度看,妊娠这种特殊的生理现象类似于器官移植,但在正常情况下,胚胎作为半同种异体移植物却不被母体子宫排斥,与复杂而精细的免疫学调节机制密切相关,尤其是子宫局部免疫微环境的调控。子宫蜕膜是最直接与胚胎接触的母体组织,即母-胎界面。子宫蜕膜组织中含一定量的免疫细胞,如自然杀伤细胞、巨噬细胞、树突状细胞、少量T细胞和B细胞等,其中NK细胞的数量最多,其比例随着妊娠的发展而改变,在早期妊娠中约占蜕膜淋巴细胞的50%~90%,晚期妊娠时约占30%~40%[8],在妊娠期间发挥重要的免疫学作用[9]。NK细胞具有自然杀伤作用,属于非特异性免疫,以非MHC (主要组织相容性复合体) 限制形式杀伤各种靶细胞。研究报道,在孕期激素作用下,出现大量dNK细胞[10]。CD56brightCD16-CD3-dNK细胞 和CD56dimCD16+CD3-dNK细胞在基因表达及功能上也存在很大差异。CD56brightCD16-CD3-dNK细胞是分泌型细胞,一方面通过产生各种细胞因子和血管源性分子等生物活性物质参与妊娠的免疫耐受[11]、子宫螺旋动脉的构建[12]以及绒毛外滋养细胞(EVT)的浸润及胎盘的发育形成[13],另一方面通过细胞表面表达抑制受体,传递抑制信号,抑制NK细胞的激活,保护胚胎免受母体免疫系统的排斥,进而利于妊娠的发生和维持[14]。CD56dimCD16+CD3-dNK细胞内含有大量的穿孔素、颗粒酶等杀伤性物质,主要发挥细胞毒性杀伤作用,通过直接释放预存的杀伤性物质或通过抗体依赖性细胞毒性作用(ADCC)来杀伤靶细胞[15]。正常妊娠与dNK细胞的免疫抑制作用有关,以对胚胎的营养作用为主,在保证胚胎生长发育中具有重要作用[16]。不明原因习惯性流产、胚胎停止发育等妊娠早期并发症与子宫蜕膜NK细胞表型和功能密切相关,一些产科常见的妊娠晚期并发症如子痫前期、子痫、胎儿生长受限等,可能也与免疫异常有关[17]。本研究从子痫前期患者母-胎界面免疫出发,为从免疫学角度研究子痫前期的发病机制奠定基础。
子痫前期的发病机制尚未明确。关于病理性妊娠的大量研究表明,子宫局部免疫微环境的异常是导致妊娠失败的主要原因之一[18],明确此处的微循环特点对认识疾病的发生机制及预防治疗有着重要的意义。本实验在对母-胎界面dNK细胞进行研究时发现,子痫前期患者孕晚期dNK细胞的表型没有发生明显改变,与正常妊娠晚期一样,以具有免疫抑制作用的亚群CD56brightCD16-CD3-dNK细胞为主,子痫前期患者与正常孕妇CD56brightCD16-CD3-dNK细胞和CD56dimCD16+CD3-dNK细胞所占比例均无明显差异,这与周[19]等的报道相一致。但是,即使是同一表型的细胞,在功能上也不一定完全一致。dNK细胞表面表达杀伤细胞活化性受体(killer activating receptors, KARs)和杀伤细胞抑制性受体(killer inhibiting receptors, KIRs)两种受体,其与相应配体相互作用后,通过上调/下调dNK细胞的功能,从而产生不同的生物学效应。Hanna等[20]报道活化的dNK细胞能通过分泌NK细胞来源的生长因子和化学因子促进滋养细胞浸润、蜕膜血管形成从而防止子痫前期的发生,而Hiby等[21]认为抑制dNK细胞可能增加子痫前期患病风险。除此之外,dNK细胞本身的反应性也会影响其生物学效应。故我们推测子痫前期的发生可能是由CD56brightCD16-CD3-dNK细胞功能异常引起,有必要对dNK细胞功能进行进一步深入研究。
4结论
妊娠是一个极其复杂的生理过程,dNK细胞与正常妊娠的维持密切相关,在母-胎界面免疫耐受过程中发挥重要作用,子痫前期患者与正常孕妇妊娠晚期dNK细胞的表型都是以CD56brightCD16-CD3-亚型为主,推测可能dNK细胞自身功能异常与本病发生有关。
【参考文献】
[1]Boukerrou M, Bresson S, Collinet P,etal. Factors associated with uterine artery Doppler anomalies in patients with preeclampsia[J]. Hypertens Pregnancy, 2009, 28(2): 178-189.
[2]蒋萌, 林建华. 子痫前期及其高危因素对围产儿结局的不良影响[J]. 现代妇产科进展, 2013, 22(5): 360-363.
[3]王伟, 王景, 翁静. 蜕膜自然杀伤细胞在人早孕期基蜕膜和壁蜕膜的分布比较[J]. 首都医科大学学报, 2011, 32(2): 259-262.
[4]Saito S, Nakashima A, Myojo-Higuma S,etal. The balance between cytotoxic NK cells and regulatory NK cells in human pregnancy[J]. J Reprod Immunol, 2008, 77(1): 14-22.
[5]Wilczyński JR, Tchórzewski H, Banasik M,etal. Lymphocyte subset distribution and cytokine secretion in third trimester decidua in normal pregnancy and preeclampsia[J]. Eur J Obstet Gynecol Reprod Biol, 2003, 109(1): 8-15.
[6]周建军, 胡娅莉, 郝莎, 等. 子痫前期患者母-胎界面子宫自然杀伤细胞免疫表型及辅助性T淋巴细胞1、2免疫状态的研究[J]. 中华妇产科杂志, 2007, 42(4): 244- 248.
[7]乐杰. 妇产科学[M]. 第7版, 北京: 人民卫生出版社, 2008: 92-94.
[8]Karimi K, Arck PC. Natural Killer cells: keepers of pregnancy in the turnstile of the environment[J]. Brain Behav Immun, 2010, 24(3): 339-347.
[9]Saito S, Shima T, Nakashima A,etal. Regulatory T cells and regulatory NK cells play essential roles for maintenance of pregnancy[J]. Nihon Rinsho Meneki Gakkai Kaishi, 2012, 35(5): 424-428.
[10] 黄荣云, 张羽, 赵洋, 等.NK 细胞与妊娠期免疫耐受的维持[J]. 吉林医药学院学报, 2013, 34(4): 283-286.
[11] Le Bouteiller P, Siewiera J,Casart Y,etal. The human decidual NK-cell response to virus infection: what can we learn from circulating NK lymphocytes? [J]. J Reprod Immunol, 2011, 88(2): 170-175.
[12] Manaster I, Mandelboim O. The unique properties of human NK cells in the uterine mucosa[J]. Placenta, 2008, 29(Suppl A): S60-S66.
[13] Hu Y, Dutz JP, MacCalman CD,etal. Decidual NK cells alter in vitro first trimester extravillous cytotrophoblast migration: a role for IFN-gamma[J]. J Immunol, 2006, 177(12): 8522-8530.
[14] 肖敏, 凌斌, 陈峥峥, 等. 早孕外周血及蜕膜中NK细胞表型及T淋巴细胞亚群的变化[J]. 细胞与分子免疫学杂志, 2008, 24(3): 285-287.
[15] Dambaeva SV, Durning M, Rozner AE,etal. Immunophenotype and cytokine profiles of rhesus monkey CD56bright and CD56dim decidual natural killer cells[J]. Biol Reprod, 2012, 86(1): 1-10.
[16] Laskarin G, Redzovic A, Rubesa Z,etal. Decidual natural killer cell tuning by autologous dendritic cells[J]. Am J Reprod Immunol, 2008, 59(5): 433-445.
[17] 曹霞, 王莲莲, 罗娜. 复发性自然流产育龄期妇女母-胎界面中细胞因子表达分析[J]. 细胞与分子免疫学杂志, 2011, 27(3): 311-312.
[18] 毛东伟, 杨东霞, 段志宇, 等. 先兆子痫胎盘的基因表达谱研究[ J]. 中国病理生理杂志, 2009, 25(9): 1806-1809.
[19] 周娟, 肖小敏.妊娠期高血压疾病患者子宫蜕膜NK细胞表型分析[J]. 中国病理生理杂志, 2011, 27(1): 183- 186.
[20] Hanna J, Goldman-Wohl D, Hamani Y,etal. Decidual NK cells regulate key developmental processes at the human fetal-maternal interface[J]. Nat Med, 2006, 12(9): 1065-1074.
[21] Hiby SE, Walker JJ, O'shaughnessy KM,etal. Combinations of maternal KIR and fetal HLA-C genes influence the risk of preeclampsia and reproductive success[J]. J Exp Med, 2004, 200(8): 957-965.

