大孔吸附树脂分离纯化苦豆草总生物碱的工艺研究
大孔吸附树脂分离纯化苦豆草总生物碱的工艺研究
王秀芬,冷晓红,郭鸿雁
(宁夏职业技术学院,银川750021)
摘要:目的 采用大孔树脂分离纯化苦豆草总生物碱,优选最佳工艺条件。方法以苦豆草总生物碱的吸附量及解吸率为评价指标,比较DF01、D101等8种型号大孔树脂对苦豆草总生物碱的分离纯化性能,选出最佳树脂并优选纯化工艺。结果D101型大孔树脂对苦豆草总生物碱具有较好的吸附分离性能,在实验条件下对苦豆草总生物碱的吸附量和解吸率可达到9.2 mg·mL-1和90%以上。结论该优选工艺可为苦豆草总生物碱纯化的产业化生产提供依据。
关键词:苦豆草;总生物碱;大孔吸附树脂;纯化
doi:10.3969/j.issn.1004-2407.2015.06.005
中图分类号:R284文献标志码:A
基金项目:科技部国家支撑项目(编号:2011BA105B04)
收稿日期:(2015-03-10)
Study on the total alkaloids separation and purification fromSophoraalopecuroidesL. using macroporous resin
WANG Xiufen,LENG Xiaohong,GUO Hongyan(Ningxia Polytechnic Vocational College, Yinchuan 750021,China)
Abstract:ObjectiveTo find out the suitable process conditions for separation and purification of total alkaloids of Sophora alopecuroides L. by using macroporous resin. MethodsThe separation and purification performance of 8 types of macroporous resins,such as DF01 and D101 was compared.The adsorption capacity and desorption rate of the total alkaloids of Sophora alopecuroides L.,were used as an evaluation index. ResultsUnder the experimental conditions,the separation and adsorption performance of D101 was better than other types of macroporous resins,for which the adsorption capacity and desorption rate of the total alkaloids was reached to 9.2 mg·mL-1 and more than 90%, respectively. ConclusionThis result provides the basis for the industrial purification of the total alkaloids from Sophora alopecuroidesL.
Key words:SophoraalopecuroidesL.;total alkaloids;macroporous adsorption resin;purification
苦豆草为豆科槐属植物苦豆子SophoraalopecuroidesL.的干燥地上部分,是西北地区道地的沙生植物,具有清热利湿、抗菌消炎的作用[1]。苦豆草总生物碱含20多种单体,其中主要含有槐定碱、氧化苦参碱、氧化槐果碱、苦参碱、槐果碱和苦豆碱[2],具有镇静、抗心律失常、抑菌、抗病毒、抗肿瘤等药理作用。各类苦豆子生物碱制剂如妇炎栓、苦参素胶囊、苦参素注射液和苦豆子总碱直肠栓已应用于临床。药理学研究表明,苦豆子中多种已经确定的疗效作用仍有较大发展空间[3],尤其是其中所含的苦参碱和槐定碱具有显著的抗癌作用[4-5]。因此,分离纯化苦豆草总生物碱具有重要意义。
有机溶剂萃取法是生物碱类纯化的经典技术,但溶剂萃取法所用提取溶剂多为甲苯、氯仿等有机溶剂,生产中防护不当会危害人体健康、造成环境污染,且在苦豆草总生物碱中存在有机溶剂残留。大孔树脂吸附分离技术具有吸附快、解吸易、对环境无污染等优势,已被广泛用于中草药有效成分的分离纯化[6-7]。本实验通过比较不同型号大孔树脂对苦豆草总生物碱的分离纯化,筛选出最佳大孔树脂,采用乙醇-水(30∶70)和(70∶30)的配比梯度洗脱液进行洗脱,中试生产采用三柱并联,实现中试规模单次上样量1 000 L,为产业化生产提供理论依据。
1仪器与试药
1.1仪器TU1810型紫外分光光度计(北京普析通用仪器有限公司);1220型高效液相色谱仪(美国安捷伦公司);GZX-9030MBE型恒温鼓风干燥箱(上海博讯实业有限公司);FA214型电子天平(上海海恒机电仪表有限公司);LD-S-101型低速离心机(北京时代北利离心机有限公司);SHL-30型水浴振荡器(北京亿安天成科技有限公司)。
1.2试药苦参碱、氧化苦参碱、氧化槐果碱、槐定碱对照品购于中国药品生物制品检定研究院;槐果碱、苦豆碱购于宁夏紫荆花药业有限公司,质量分数≥99.0%;苦豆草提取液(实验室采用酶解后酸水提取[8],相对密度1.0~1.1);甲醇、乙腈为色谱纯;其他化学试剂均为分析纯。
1.3材料实验级D101树脂(上海天莲树脂有限公司);实验级AB-8树脂(上海天莲树脂有限公司);实验级树脂DF01、NKA-12、DA301、BS-67-3、D2026、X-5(蚌埠市辽源树脂生物科技有限公司)。
2方法与结果
2.1分析测定方法
2.1.1苦豆草总生物碱含量测定(采用紫外分光光度法)苦豆草总生物碱中槐定碱的含量最高,参考相关文献[9],采用溴麝香草酚蓝比色法以槐定碱为指标成分测定苦豆草中总生物碱含量。
2.1.1.1标准曲线的制作称取槐定碱对照品5 mg,精密称定,置于5 mL量瓶中,加无水乙醇溶解并稀释至刻度,摇匀即得。吸取槐定碱标准溶液0,10,20,30,40,50,60,70,80,90和100 μL,分别置于25 mL的磨口锥形瓶中,挥尽乙醇,加溴麝香草酚蓝pH 7.6缓冲液6.00 mL、三氯甲烷6.00 mL,密塞,剧烈振摇2 min提取,静置2 h,分出三氯甲烷层,以未加槐定碱标准溶液管为空白,于410 nm处测定提取液的吸光度,以三氯甲烷提取液质量浓度C对吸光度A进行回归,得回归方程:A=0.013 3C-0.013 4,r=0.999 6。
2.1.1.2样品含量测定精密吸取苦豆草提取液1 mL,加无水乙醇溶解并定容至10 mL,吸取0.2 mL置于25 mL的磨口锥形瓶中,挥尽乙醇,加溴麝香草酚蓝pH 7.6缓冲液6.0 mL、三氯甲烷6.0 mL,密塞,剧烈振摇2 min,提取,静置2 h,分出三氯甲烷层,以对应的提取溶剂1 mL加溴麝香草酚蓝pH 7.6缓冲液6.0 mL和三氯甲烷6.0 mL同比操作,为空白液,于410 nm处测定提取液的吸光度A,从制作的标准曲线中查得相应的生物碱质量浓度,并计算苦豆草总生物碱的含量(以槐定碱计)。
2.2树脂筛选
2.2.1实验器材树脂柱:Φ1.5×30 cm玻璃柱8根(定制);吸附液:苦豆草酸水提取浓缩液,按照紫外分光光度法测总生物碱的含量3.46 mg·mL-1(以槐定碱计),用50 g·L-1的氢氧化钠溶液调成碱性(pH约为9),4 500r·min-1离心分离,去沉淀,取上清液,再次采用紫外分光光度法测总生物碱含量3.28 mg·mL-1(以槐定碱计);洗脱液:体积分数为70%的乙醇。
2.2.2实验过程提取液→通过大孔树脂吸附→解吸→收集洗脱液→回收洗脱剂→药液
2.2.2.1大孔吸附树脂的预处理大孔树脂分别用乙醇浸泡24 h以上,使其充分溶胀,用乙醇洗至洗脱液与水混合(1∶2)不呈白色浑浊为止,再用纯化水洗至无醇味,20 mL·L-1的盐酸溶液浸泡3 h,水洗至中性,50 g·L-1的氢氧化钠溶液浸泡3 h,水洗至中性,备用。
2.2.2.2 吸附将充分溶胀的8种树脂,各量取15 mL,分别装入8根玻璃柱中,分别取吸附液100 mL,以平均5 BV·h-1的流速通过吸附液。对各柱流出液分别取样,以备测定。
2.2.2.3解吸取6倍树脂柱体积的洗脱液,以平均1 BV·h-1的流速,解吸8根吸附量确定的树脂柱。对解吸液分别取样,以备测定。
2.2.3实验结果采用紫外分光光度法测定各样品吸附流出液和解吸流出液的苦豆草总生物碱含量,各柱吸附流出液和解吸流出液均为等量。计算公式如下:
吸附量(mg·mL-1)=(吸附液质量浓度-流出液质量浓度)×吸附液体积/湿树脂体积(mL)
解吸率=解吸出总生物碱量/吸附总生物碱量×100%
实验结果见表1。
表1树脂筛选
Tab.1 Resin screening

树脂粒径/mm比表面/m2·g-1孔径/nm吸附量/mg·mL-1洗脱量/mg解吸率/%DF010.3~10.00400~420130~1408.33113.2690.61AB-80.3~1.25480~520130~1409.01124.7992.32NKA-120.3~1.00570~590150~1567.21100.8693.31D1010.3~1.25500~55090~1009.20128.3493.09DA3010.3~1.2530~35100~1207.86108.0991.70BS-67-30.3~1.00400~450130~1408.92120.4489.99D20260.3~1.2040~5090~1109.13123.2789.33X-50.3~1.25500~600290~3008.59119.2892.56
从表1可以看出,取相同吸附液量,采用动态吸附,D101大孔树脂吸附量与解吸率最强,树脂的性能良好。因此选用D101型大孔吸附树脂分离纯化苦豆草总生物碱。
2.3吸附条件优化
2.3.1动态吸附最大上样量考察量取经预处理的D101树脂15 mL,装入玻璃柱中,取苦豆草酸水提取吸附液(生物碱含量3.28 mg·mL-1,以槐定碱计),以平均5 BV·h-1的流速,树脂柱自上而下通过吸附液,收集流出液,每15 mL收集1份,测定其苦豆草总生物碱含量。实验结果表明,当吸附液体积达4 BV时,流出液中出现少量苦豆草总生物碱,开始泄露;吸附液至5 BV时,流出液中苦豆草总生物碱含量逐步增大,泄露明显,吸附接近泄露点;当上样达到10 BV时,流出液中苦豆草总生物碱含量增加不明显,吸附达到饱和。考虑到生产工艺中要避免造成总生物碱的泄漏,确定使用单柱吸附时,苦豆草酸水提取吸附液(生物碱含量3.28 mg·mL-1,以槐定碱计)最大上样量为5 BV,使用串联树脂柱吸附时,苦豆草酸水提取吸附液(生物碱含量3.28 mg·mL-1,以槐定碱计)最大上样量为10 BV。
2.3.2径高比的考察取4根玻璃柱分别按径高比1∶5,1∶6,1∶7和1∶8湿法装入D101大孔吸附树脂,分别加入苦豆草酸水提取吸附液(生物碱含量3.28 mg·mL-1,以槐定碱计)100 mL,预吸附1 h,流速为5 BV·h-1,吸附完毕后,用100 mL体积分数为70%的乙醇洗脱,流速为1 BV·h-1。依次吸取流出液和洗脱液,采用紫外分光光度法测定苦豆草总生物碱的含量,并计算吸附量及解吸率。实验结果见表2。
表2径高比的考察
Tab.2 Investigation of the column diameter ratio
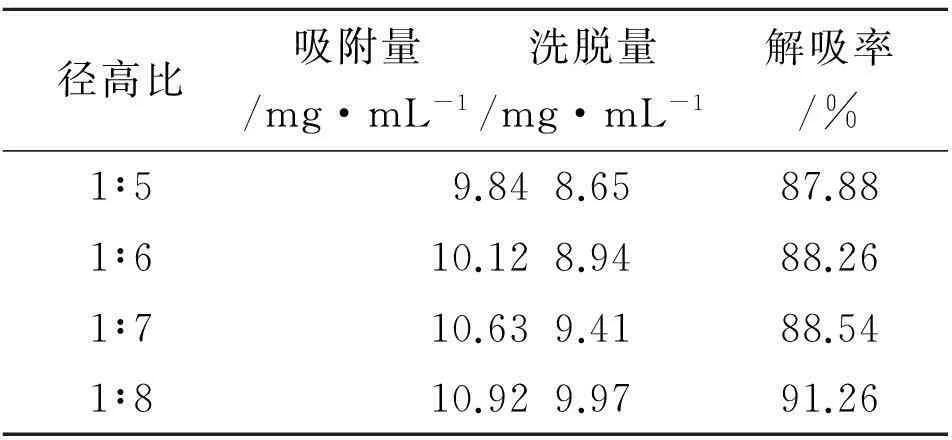
径高比吸附量/mg·mL-1洗脱量/mg·mL-1解吸率/%1∶59.848.6587.881∶610.128.9488.261∶710.639.4188.541∶810.929.9791.26
从表2可以看出,从吸附量和解吸率综合考虑,选择1∶8径高比湿法装柱效果最佳。
2.3.3吸附液质量浓度对吸附的影响取处理好的D101树脂15 mL,湿法装柱。分别取实验室制备的吸附液(总生物碱含量3.28 mg·mL-1,以槐定碱计)25,50,75和100 mL,加水定容至100 mL,摇匀,以平均5 BV·h-1的流速,自上而下分别通过4根吸附柱,收集流出液,吸附3 h后,用体积分数70%的乙醇洗脱,收集洗脱液,测定流出液和洗脱液中苦豆草总生物碱的含量(以槐定碱计),实验结果见表3。
表3吸附液质量浓度对吸附的影响
Tab.3 Effects of the adsorption concentration on adsorption behovior

上样液质量浓度/mg·mL-1吸附量/mg·mL-1解吸率/%0.822.9688.411.646.2880.242.467.8682.453.289.3292.14
从表3可以确定,上样液质量浓度为3.28 mg·mL-1(以槐定碱计)即1 mL相当于原生药0.23 g。
2.3.4吸附液pH值对吸附量的影响取苦豆草酸水提取吸附液(生物碱含量3.28 mg·mL-1,以槐定碱计),采用碘化铋钾试液鉴别生物碱,当流出液中出现显色反应,停止通液。检测各柱流出液量与质量浓度,计算吸附量。结果以吸附液pH为9.0时吸附效果最好。
2.4解吸条件优化为减少产品的有害溶剂残留,从常用的洗脱剂中选择乙醇与水为洗脱剂。
2.4.1不同pH值乙醇-水(70∶30)的解吸效果将8等份乙醇-水(70∶30)洗脱液分别调pH值为3.0,4.0,5.0,6.0,7.0,8.0,9.0和10.0,分别洗脱吸附饱和的等量树脂,流速均为1.0 BV·h-1。结果采用乙醇-水(70∶30)pH为9.0的洗脱液进行解吸,效果最好。
2.4.2洗脱液用量量取经过预处理的D101树脂15 mL,装入玻璃柱中,取苦豆草酸水提取吸附液(生物碱含量3.28 mg·mL-1,以槐定碱计),按最大上样体积为树脂量的5倍上柱,吸附流速为5 BV·h-1,洗脱用体积分数70%的乙醇、pH为9.0的洗脱液进行解吸,分段收集洗脱液,每1 BV为一份,测定苦豆草总生物碱的含量。实验结果表明,洗脱液用量为柱体积的6倍时基本洗脱完全,为简化工艺流程,降低成本,采用6倍柱体积的洗脱液进行洗脱。
2.4.3不同乙醇-水配比梯度洗脱的解吸效果由于苦豆草总生物碱中含有多种单体生物碱,极性强的生物碱在低浓度洗脱量高,非极性生物碱在高浓度洗脱量高,为洗脱完全,实验中采用不同乙醇-水配比进行梯度洗脱。如表4中所标识不同乙醇-水配比洗脱液,调节pH为9.0,流速为1.0 BV·h-1,分别梯度洗脱吸附饱和的等量树脂。实验结果如表4所示。
表4不同乙醇-水配比梯度洗脱的解吸率
Tab.4 Different ethanol-water ratio gradient elution rate of desorption

序号吸附总碱量/mg乙醇-水洗脱液用量/BV洗脱总碱/mg合计/mg解吸率/%113870∶306.0123.65118.6585.923413813813830∶7050∶5070∶3090∶1020∶8040∶6060∶4080∶2030∶7070∶301.51.51.51.51.51.51.51.53.03.029.6035.3048.0321.9024.6040.2040.9029.5449.1084.76134.83133.24133.8697.796.697.0
结果如表4所示,第1组单纯使用乙醇-水(70∶30)的洗脱液,解吸率为85.9%,不能洗脱完全;第2,3和4组采用不同乙醇-水配比梯度洗脱,解吸率高于第1组10%以上;其中第2组的解吸率最高,但生产工艺比较复杂;第4组解吸率较第2组稍低,但工艺简单,便于操作,工业蒸发回收的乙醇体积分数可达到70%,可以循环利用。故采用不同乙醇-水配比梯度洗脱,且选用第4组乙醇-水(30∶70)和(70∶30)的配比梯度进行洗脱。
2.5正交实验设计以吸附液pH值(A)、洗脱液体积分数(B)和洗脱液pH值(C)为因素,确定每个因素3个水平,按表L9(33)设置正交实验,上样量为5 BV,以苦豆草总生物碱的分离纯化提取率为评价指标。正交实验因素水平和正交实验结果见表5和表6。实验结果表明,苦豆草总生物碱最佳的分离纯化工艺条件是:A3B3C3,即吸附液pH值为9.0,洗脱液体积分数乙醇-水(30∶70)和(70∶30)的配比梯度洗脱液,洗脱液pH值为9.0,其中吸附液pH值对分离纯化提取率的影响最大。
表5正交实验因素水平表L9(33)
Tab.5 Levels and factors of orthogonal test L9(33)
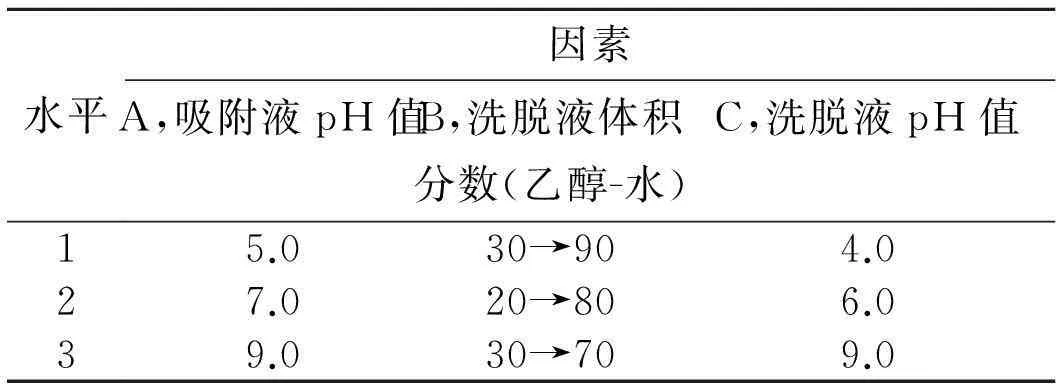
水平因素A,吸附液pH值B,洗脱液体积分数(乙醇-水)C,洗脱液pH值15.030→904.027.020→806.039.030→709.0
注:
30→90指采用乙醇-水配比梯度:30∶70,50∶50,70∶30,90∶10进行洗脱
20→80指采用乙醇-水配比梯度:20∶80,40∶60,60∶40,80∶20进行洗脱
30→70指采用乙醇-水配比梯度:30∶70,70∶30进行洗脱
表6正交实验结果
Tab.6 Results of the orthogonal test

序号A,吸附液pH值B,洗脱液体积分数(乙醇-水)C,洗脱液pH值生物碱分离纯化提取率/%1530→90490.22520→80691.23530→70991.44720→80492.15730→70692.56730→90992.87930→70493.28930→90692.79920→80993.1均值190.9391.9091.83均值292.4792.1392.13均值393.0092.3792.43极差2.070.470.60主次顺序A>C>B优水平A3B3C3优组合A3B3C3
2.6中试验证通过实验室确定的大孔树脂吸附法分离纯化苦豆草总生物碱的最佳工艺条件,进行3批中试工艺验证,采用大孔树脂三柱并联分离纯化苦豆草总生物碱,采用喷雾干燥,计算出膏率,分别为3.01%,3.03%和2.99%,苦豆草总生物碱的质量分数分别为66.75%,66.63%和66.42%。说明该工艺分离纯化苦豆草总生物碱稳定可行。
3讨论
采用大孔树脂分离纯化技术,吸附液和洗脱液的pH值都是影响树脂纯化效果的重要因素[10],本实验对吸附液和洗脱液的pH值进行考察,确定吸附液和洗脱液的pH为9.0时,分离纯化效果最好。
上样液质量浓度是影响吸附效果的重要因素,刘霞等[11]通过大孔树脂纯化鹿药总皂苷和总黄酮的研究表明,随着上样液质量浓度增加,总皂苷在树脂上的吸附量逐渐降低。采用大孔树脂吸附分离时,一般将上样液质量浓度控制在一定范围内。本研究对苦豆草上样液质量浓度进行考察,上样液质量浓度越大,树脂对其吸附量越大,解吸率相对越大。如果上样液质量浓度较低,生产中成本较高;但溶液质量浓度太大,溶液黏稠,溶液堵塞柱子。综合考虑,确定上样液质量浓度为3.28 mg·mL-1(以槐定碱计)即1 mL相当于原生药0.23 g。
本实验通过吸附曲线和洗脱曲线考察,确定单柱最大上样量和洗脱液用量,采用乙醇-水(30∶70)和(70∶30)的配比梯度洗脱液进行洗脱,为产业化生产采用大孔树脂三柱并联生产提供理论依据。
参考文献:
[1]廖春燕,梁健,杨燕,等.苦豆子的药理及应用概述[J].中国民族民间医药,2009,18(3):6-8.
[2]秦学功,元英进.高效薄层色谱分离苦豆子生物碱的体系优化[J].中草药,2002,33(6):513-514.
[3]杨巧丽,顾政一,黄华.中药苦豆子的研究进展[J].西北药学杂志,2011,26(3):232-235.
[4]梁磊,张绪慧,王晓燕,等.槐定碱对人结肠腺癌细胞株SW620增殖和凋亡的影响[J].中国药理学通报,2008,24(6):782-787.
[5]李旭芬,张苏展,郑树.苦参碱对K562及其多药耐药细胞K562/Vin的细胞生物学影响[J].中国病理生理杂志,2002,18(10):1233-1237.
[6]李伯庭,王湘,李小进.大孔吸附树脂在天然产物分离中的应用[J].中草药,1990,21(8):42-44.
[7]刘斌,石任兵,余超.影响大孔吸附树脂吸附分离中草药化学成分的因素[J].中草药,2002,33(5):475-476.
[8]李军,郝彩琴,陈海燕,等.酶法提取苦豆草生物碱研究[J].西北药学杂志,2014,29(4):347-350.
[9]辛海量,赵玉海,林峰,等.苦豆草中总生物碱含量测定[J].解放军药学学报,2002,18(2):113-115.
[10]孙君辉,孟秀芬.大孔树脂的应用及其提取纯化中药有效成分的影响因素[J].山东商业职业技术学院学报,2008,8(6):94-96.
[11]刘霞,岐琳,李延,等.大孔吸附树脂纯化鹿药总皂苷和总黄酮的研究[J].西北药学杂志,2012,27(6):516-519.

