RGD肽抗肿瘤机制及进展
The antitumor mechanism and progress of RGD peptide
管箫玉1,李庆伟1,2*,王继红1,2*(辽宁师范大学:1.生命科学学院;2.七鳃鳗研究中心,辽宁 大连 116029)
·综述·
RGD肽抗肿瘤机制及进展
The antitumor mechanism and progress of RGD peptide
管箫玉1,李庆伟1,2*,王继红1,2*(辽宁师范大学:1.生命科学学院;2.七鳃鳗研究中心,辽宁 大连116029)
摘要:近年来,癌症严重影响了人类的健康与生活。研发一种能够靶向有效的治疗肿瘤细胞而又不引起相关副作用的抗肿瘤药物已成为人类面临的重大挑战。随着研究的深入,已经证明精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)肽作为整合素与其配体相互作用的竞争性拮抗剂,有望成为有效的抗肿瘤治疗靶向药物。整合素具有在肿瘤细胞表面高表达的特点,其与细胞外基质(ECM)蛋白相结合,能够介导肿瘤的侵袭和转移。而整合素与ECM的识别位点就是RGD序列。迄今为止在人体内已发现67种蛋白质中含有RGD模体序列,其中包含纤维蛋白原、玻连蛋白、层黏连蛋白等ECM蛋白。这些ECM蛋白通过RGD序列位点与整合素结合,从而引起细胞与细胞外基质间的黏附、迁移、浸润和增殖等一系列生理行为。而外源RGD肽可以竞争性拮抗ECM与整合素的结合,因此这些RGD肽在肿瘤的诊断与治疗上发挥着极其重要的作用。本篇文章主要论述了RGD肽及其衍生物的抗肿瘤机制及其研究的进展。
关键词:RGD;整合素;肿瘤细胞
如今,癌症的发病率和死亡率明显增高。在肿瘤的侵袭和转移过程中,肿瘤细胞与细胞外基质的黏附是引起侵袭和转移的关键环节,整合素作为细胞黏附分子家族的重要成员,在这一过程中起到至关重要的作用。整合素与配体间相互作用的识别位点为精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD),因此RGD序列对肿瘤细胞与细胞外基质以及肿瘤细胞之间的黏附起了关键作用[1]。外源性RGD肽可以竞争性拮抗整合素与其配体的结合,因此有望发展成新型靶向抗肿瘤药物。下面就RGD肽与整合素相互作用机制及其抗肿瘤研究进展做一综述。
1RGD肽背景介绍
RGD序列由精氨酸、甘氨酸和天冬氨酸组成,广泛存在于细胞外基质蛋白中。其作为整合素与其配体相互作用的识别位点可以与11种整合素特异性的结合,进而促进细胞与细胞之间以及细胞与细胞外基质间的黏附、迁移、浸润和增殖等一系列生理行为。
此外有些RGD模体还存在于吸血动物唾液腺分泌物中。存在于吸血动物唾液腺中的RGD模体蛋白被统称为RGD毒素蛋白。RGD毒素肽以其特有的RGD模体与细胞外基质蛋白的RGD序列竞争性的与整合素结合,从而抑制整合素的信号通路,阻止细胞与细胞外基质的黏附、迁移等,达到了抗肿瘤目的。
2整合素家族
整合素家族是由α亚基和β亚基所组成的异源二聚体,其是由很多结构和功能相类似的蛋白质所组成的一类膜受体家族。其迄今为止已发现20种α亚基和11种β亚基[2],它们按照不同的组合方式构成20多种整合素。整合素的受体特异性是由α亚基和β亚基共同决定的,其中几乎一半的整合素受体如:αvβ3、αvβ5、αvβ1整合素亚型通过RGD三肽与各种细胞外基质蛋白如:纤连蛋白、玻连蛋白和胶原蛋白等结合,介导着细胞的黏附[3]、迁移、增殖、分化、凋亡和信号转导等。
整合素在正常细胞、正常血管上皮和内皮细胞上表达量较少,而在膀胱癌、骨肉瘤、胶质母细胞瘤及成神经细胞瘤[4]等多种实体肿瘤的细胞表面的表达量较高。此外在肿瘤组织的新生血管内皮细胞上同样有着较高的表达量[5],证明了整合素在肿瘤细胞的生长、转移、侵袭以及血管新生过程中的重要性,因此在抗肿瘤新兴药物的研发过程中整合素受体已成为重要的靶点。
整合素与其配体间相互作用的识别位点为RGD,因此外源性RGD肽对肿瘤细胞与细胞外基质以及肿瘤细胞之间的黏附起到了竞争性拮抗作用和靶向运输作用。近年来随着对RGD肽的深入研究,已有资料证明RGD肽不但能够竞争性的与整合素的受体结合,阻止肿瘤细胞的黏附和转移,而且还能直接诱导肿瘤细胞的凋亡,因此RGD肽在治疗肿瘤方面有着较好的应用前景。如图1所示为整合素与细胞外基质相互作用示意图。
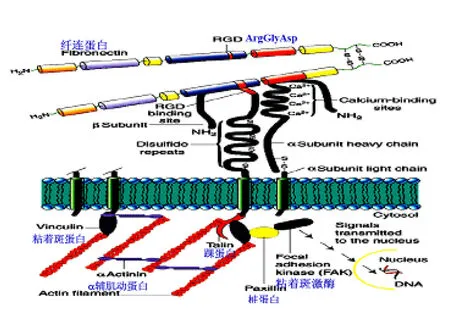
图 1 整合素与细胞外基质相互作用的图解
3RGD肽及其衍生物在肿瘤治疗中的应用
3.1当前肿瘤治疗方法的弊端
肿瘤的监测、诊断和治疗已成为当今社会医疗保健中一个极其重要的主题,一种理想的有效治疗癌症的药物不仅要完全的除去肿瘤细胞,还要阻止肿瘤细胞向正常组织细胞中扩散和侵袭。当前,临床中治疗肿瘤的方法包括外科手术治疗法、化学疗法、放射疗法以及免疫疗法。由于这些治疗方法本身的局限性,在对于高侵袭性和高转移性的肿瘤细胞的治疗中通常是失败的。放射疗法可以损坏临近的健康的组织。化学疗法由于高剂量的药物注射,可能导致患者全身系统发生紊乱而引起一系列的副作用。如:紫杉醇(PTX),在临床上已被用于多种癌症的治疗。但是同时其也引起了过敏性反应、骨髓抑制以及神经毒等一系列的副作用[6];阿霉素(DOX)在被用于癌症的化疗过程中导致心脏中毒[7]。此外在治疗的过程中由于身体本身的化学抵抗力,有些化学疗法对于肿瘤的治疗是无效的,如吉西他滨对于胰腺癌的治疗[8]。
3.2通过整合素配体靶向治疗肿瘤细胞
根据肿瘤细胞的结构和生物学的特征,过表达多种肿瘤细胞的受体,以区分肿瘤细胞和正常的生理细胞。由于配体能够优先识别受体,根据这一特性,能够引导抗肿瘤分子选择性的与肿瘤细胞结合以达到治疗肿瘤细胞的目的。
已有研究证明几种整合素受体的亚型在细胞黏附、细胞迁移、细胞信号转导以及细胞活性等方面有着至关重要的作用,且这些整合素受体在肿瘤细胞中是高表达的。因此将能够识别整合素受体的配体与药物或药物载体系统结合以达到靶向的治疗肿瘤细胞目的。由于RGD是整合素受体与其配体的识别位点,因此RGD已经被广泛的应用于靶向治疗肿瘤细胞过程中药物传输的载体。
通过药物传输靶向的结合肿瘤细胞能够克服传统治疗方法的局限性[9],在肿瘤治疗方面有着较好的应用前景。这种方法能够有目的性的特异的引导抗肿瘤药物与肿瘤细胞结合而不干扰正常的组织器官,减少了药物与正常组织之间不明确的反应,进而减少了与之相关的副作用的发生。其还可以在疾病组织区域定点释放药物,提高了疾病组织部位的药物浓度,减少了药物注射量,进而减少了潜在的化学药物抗性。
由整合素介导的细胞与细胞外基质蛋白的相互作用,特别是与纤连蛋白的作用能够诱导大量的MMPS的产生和激活。整合素作为细胞表面受体家族,在细胞外基质蛋白和多发性骨髓瘤细胞间起着重要的调节作用,其中整合素αvβ3亚型在这一过程中发挥着重要的作用。有研究表明甲状腺激素能够通过与位于αvβ3整合素上RGD识别位点附近的几个分散的受体相互作用,进而促进肿瘤细胞的生长、迁移和MMP-9的活化[10]。而这一过程可以通过RGD肽破坏甲状腺激素与整合素之间的信号通路,阻止甲状腺激素与整合素的相互作用抑制MMP-9的活化,最终抑制了多发性骨髓瘤细胞的生长和侵袭。
RGD模体除广泛存在于细胞外基质中外,还存在于吸血动物唾液腺分泌物中。存在于吸血动物唾液腺中的RGD模体蛋白被统称为RGD毒素蛋白。现已发现蛇毒[11]、蜱[12]、水蛭[13]、牛氓[14]及七鳃鳗[15]毒液或唾液腺分泌物中含有RGD毒素蛋白,这类蛋白能够凭借其蛋白序列上特有的RGD序列与细胞外基质蛋白的RGD序列竞争性与肿瘤细胞或新生血管内皮细胞表面高表达的整合素结合,从而抑制细胞外信号通过整合素向细胞内的转导,抑制肿瘤或血管内皮细胞的增殖、迁移及浸润[16]。
3.3RGD肽及其衍生物对血管新生的抑制作用
传统上治疗肿瘤的方法是集中摧毁肿瘤细胞和组织,近年来靶向抑制肿瘤供血系统,进而抑制肿瘤细胞的生长的治疗方法取得了很大的进步。众所周知,正常情况下没有新生血管供给养料,肿瘤细胞是不能够生长的,因此供血系统在肿瘤组织的生长、扩散过程中是十分重要的,因此有效的抑制肿瘤血管的新生能够应用于肿瘤的治疗。目前一些能够靶向治疗肿瘤供血系统的药物已被研发,并获得了临床上的验证。这些药物不但能够直接作用于新生血管,而且与传统抗肿瘤的方法或药物结合使用,能够提高肿瘤的治愈率。
血管新生是毛细血管长出的新的分支或是在已经存在的血管周围形成新的血管的过程。血管新生在生物体的伤口愈合以及生殖周期等正常生长发育过程中发挥着关键的作用。但同时血管新生与一些病理学过程密切相关,如炎症的发生、肿瘤的生长与代谢等。据报道,肿瘤区域的血管与正常组织的血管在结构功能以及分子水平上都有着明显的差异[17],且肿瘤区域的血管密度是正常区域血管密度的50~200倍,因此血管新生已成为癌细胞生长以及转移到其他组织器官的途径。而进一步研究血管新生的作用机制以及开发有效的抑制血管新生的药物已成为国内外研究的热点。血管新生与大量的细胞因子有关,如:血管内皮生长因子(VEGF)、肿瘤坏死因子α(TNF-α)、人碱性成纤维生长因子(bFGF)以及白介素-8等(IL-8)[18]。
在蛋白质参与的血管新生的过程中整合素具有重要的作用。其能够促进血管内皮细胞向细胞外基质进行黏附与迁移、调节细胞与细胞间的相互作用以及细胞内的信号转导[19]等。整合素主要通过其上的依赖金属离子的吸附位点(MIDAS)作为其与配体主要的结合位点。整合素亚基中α5β1和αⅡbβ3能够识别RGD三肽的内源性配体。许多研究小组对RGD肽的三维结构进行观察研究,发现整合素能够特异高效地与RGD肽结合,是与RGD肽的分子结构密切相关的。因此通过人工设计合成含有RGD序列的多肽或是模拟肽作为整合素特异性的配体与整合素结合,抑制整合素的信号通路。
西仑吉肽(Cilengitide)是一种人工合成的循环RGD肽,分子式为c[RGDf(N-Me)V]。西仑吉肽作为抑制胶质母细胞瘤血管生成抑制剂,目前已经进入到第三期的临床试验中[20]。该肽作为体内αvβ3整合素的配体,对αvβ3整合素具有高度的亲和性和选择性,临床试验结果显示,该肽单独使用时能较好抑制黑色素瘤和胶质母细胞瘤的生长,当与放射疗法或是其他抗肿瘤药物共同使用时肿瘤的治疗得到了明显的提高。
(RGD)3-tTF是另一种人工合成的含有RGD序列的融合蛋白,作者将3个串联的RGD肽作为tTF的载体使(RGD)3-tTF融合蛋白表达,以检测这种可溶蛋白是否能够特异高效的与结肠癌肿瘤新生血管结合[21]。通过实验证明这种融合蛋白在裸鼠模型的结肠癌肿瘤血管上高表达,并且能够与肿瘤血管中的αvβ3整合素结合,最终导致肿瘤细胞的衰退。
利用整合素在肿瘤细胞新生血管中表达量较高这一特点将RGD肽用放射性标记对肿瘤细胞进行核显像,可以对肿瘤细胞进行定位以及早期的诊断和治疗。有文献报道由于环状RGD肽在稳定性、抑制性以及亲和性方面都优于线性RGD肽[22],所以作者合成了含有2个二硫键的环状9肽CDCRGDCKC(RGD-4CK),并且采用直接标记的方法,用99mTc标记作为αvβ3特异性受体的放射性配体,以探究RGD-4CK对实体肿瘤诊断的可行性。通过实验证明99mTc拥有较好的放射化学性质,体内稳定性较高,并且具有比较理想的体内动力学。虽然RGD肽作为配体在抑制肿瘤以及肿瘤血管新生方面取得了较好的效果,但是其作用机制尚未完全解决。
3.4RGD肽相关的肿瘤的诊断与治疗
基因治疗是将一个治疗的基因“捆绑”在载体上,然后将载有治疗基因的载体感染肿瘤细胞,使治疗基因能够靶向进入到肿瘤细胞内,进而破坏杀死肿瘤细胞。由于肿瘤区的新生血管组织高表达αvβ3整合素[23],可将整合素αvβ3作为基因治疗的靶点,利用RGD肽能够与整合素αvβ3结合的属性,将RGD肽作为靶向分子与载体结合,构建靶向腺病毒载体[24]感染肿瘤细胞,肿瘤细胞的生长受到影响,肿瘤的血管新生得到阻滞,最终达到药物治疗的目的。
肿瘤细胞的迁移需要基质金属蛋白酶水解细胞外基质蛋白,在这个过程中发挥着主要作用的是基质金属蛋白酶-9(MMP-9)。因此MMP-9的抑制剂为抗肿瘤开辟了新的途径。有研究证明甲状腺激素能够通过与αvβ3整合素的相互作用诱导MMP-9的活化。由于甲状腺激素与αvβ3整合素的结合位点位于RGD肽识别位点的附近,所以用RGD肽绑定甲状腺激素使得αvβ3整合素发生别构调节,阻碍MMP-9的活化,进而阻碍肿瘤细胞的生长。能够抑制MMPS活性的还包括巴马司他(BB-94)、普林司他(AG-3340)和马马司他(BB-2516)等[25],目前已经进入到临床前期的研究阶段。
如今,RGD分子影像技术已广泛的应用于肿瘤的检测与治疗中,这种方法是将RGD肽用不同种类的放射性核素进行标记以显像肿瘤部位。其对于肿瘤细胞的靶向作用已在正常的动物体内得到验证[26]。此外64Cu、68Ga、125I、131I、18F、99mTc、125I、188Re、111In和90Y等多种放射性核素对RGD肽进行标记已成为应用前景良好的αvβ3受体的显像剂。利用受体和配体之间相互作用具有较高的特异性、较高的亲和性以及较高的选择性等优点,使其与肿瘤细胞上的整合素受体特异性结合将肿瘤部位标记,这种技术已经在多种荷瘤动物模型上获得成功[27]。
4RGD肽衍生物及其展望
RGD序列作为整合素与整合素配体的作用位点,在肿瘤的诊断与治疗上发挥着极其重要的作用,RGD肽单独作用时可以导致肿瘤细胞的凋亡,与其他抗肿瘤药物或方法共同使用时能够增加肿瘤的治疗效果。此外,RGD肽作为靶向治疗肿瘤细胞过程中的药物传输载体,提高了肿瘤部位药物剂量的浓度,可以在低剂量药物浓度下发挥抗肿瘤的作用,减少了传统治疗方法对人体产生的负面作用。人工改造的RGD肽极大的减少了对人体不良反应的发生,增强了抗肿瘤的治疗效果。而且一系列人工合成的RGD肽已应用于临床试验,并取得了较好的抗肿瘤生长、迁移、侵袭以及血管新生的效果。在基因治疗方面,RGD肽还可以用于对腺病毒的结构改造上,通过改造后的腺病毒对肿瘤细胞有更好的选择性和转染性,能够更有效的治疗肿瘤细胞。放射性核素标记的RGD肽,作为肿瘤细胞的显像剂,也有较好的应用前景。这一方法利用RGD肽与αvβ3整合素能够高特异性结合的特点,将肿瘤细胞与带有放射性核素标记的RGD肽结合,使肿瘤部位能够显像出来,对肿瘤细胞的监测和预防有着积极的作用。光学成像使肿瘤生长、迁移等过程更加形象化,深入了解了肿瘤侵袭转移的机制。对于肿瘤前期的诊断与治疗有着较好的应用前景,对抗肿瘤药物的研发有积极的作用。
RGD肽及其衍生物在抗肿瘤药物研究方面有着较好的应用前景,相信随着研究的深入有望为我国抗肿瘤药物研发提供一类抗肿瘤候选新药,具有较好的临床应用前景。
参考文献:
[1]Akkari L,Gocheva V,Kester JC,et al.Distinct functions of macrophage-derived and cancer cell-derived cathepsin Z combine to promote tumor malignancy via interactions with the extracellular matrix[J].Genes Dev,2014,28(19):2134-2150.
[2]岳宁,袁双虎,杨国仁.RGD 分子影像在肺癌的研究现状与进展[J].中国肺癌杂志,2014,17(12):855-859.
[3]沈瑛,糜军.靶向整合素αVβ3的分子影像探针[J].中国癌症杂志,2010,20(4):303-307.
[4]安莲效,李慧,顾月清.RGD肽作为药物靶向配体的研究进展[J].中国生化药物杂志,2010,31(1):66-69.
[5]Fukumura D,Jain RK.Imaging angiogenesis and the microenvironment[J].APMIS,2008,116(7/8):695-715.
[6]Marelli UK,Rechenmacher F,Sobahi TR,et al.Tumor targeting via integrin ligands[J].Front Oncol,2013,3:222.
[7]Prados J,Melguizo C,Ortiz R,et al.Doxorubicin-loaded nanoparticles:new advances in breast cancer therapy[J].Anticancer Agents Med Chem,2012,12(9):1058-1070.
[8]Bergman AM,Pinedo HM,Peters GJ.Determinants of resistance to 2′,2′-difluorodeoxycytidine (gemcitabine)[J].Drug Resistance Updates,2002,5(1):19-33.
[9]Desgrosellier JS,Cheresh DA.Integrins in cancer:biological implications and therapeutic opportunities[J].Nat Rev Cancer,2010,10(1):9-22.
[10]Cohen K,Ellis M,Khoury S,et al.Thyroid hormone is a MAPK-dependent growth factor for human myeloma cells acting via αVβ3 integrin[J].Mol Cancer Res,2011,9(10):1385-1394.
[11]Camacho E,Villalobos E,Sanz L,et al.Understanding structural and functional aspects of PⅡ snake venom metalloproteinases:characterization of BlatH1,a hemorrhagic dimeric enzyme from the venom of Bothriechis lateralis[J].Biochimie,2014,101:145-155.
[12]Mans BJ,Neitz AW.The mechanism of αⅡbβ3 antagonism by savignygrin and its implications for the evolution of anti-hemostatic strategies in soft ticks[J].Insect Biochem Mol Biol,2004,34(6):573-584.
[13]Krezel AM,Wagner G,Seymour-Ulmer J,et al.Structure of the RGD protein decorsin:conserved motif and distinct function in leech proteins that affect blood clotting[J].Science,1994,264(5167):1944-1947.
[14]Ma Dongying,Xu Xueqing,An Shu,et al.A novel family of RGD-containing disintegrins (Tablysin-15) from the salivary gland of the horsefly Tabanus yao targets αⅡbβ3 or αVβ3 and inhibits platelet aggregation and angiogenesis[J].Thromb Haemost,2011,105(6):1032-1045.
[15]Wu Caiping,Lü Li,Zheng Yuanyuan,et al.Novel anticandidal activity of a recombinant Lampetra japonica RGD3 protein[J].J Microbiol Biotechnol,2014,24(7):905-913.
[16]Fanelli R,Schembri L,Piarulli U,et al.Effects of a novel cyclic RGD peptidomimetic on cell proliferation,migration and angiogenic activity in human endothelial cells[J].Vasc cell,2014,6:11.
[17]St Croix B,Rago C,Velculescu V,et al.Genes expressed in human tumor endothelium[J].Science,2000,289(5482):1197-1202.
[18]D’Andrea LD,Del Gatto A,Pedone C,et al.Peptide-based molecules in angiogenesis[J].Chem Biol Drug Des,2006,67(2):115-126.
[19]Juliano RL.Signal transduction by cell adhesion receptors and the cytoskeleton:functions of integrins,cadherins,selectins,and immunoglobulin-superfamily members[J].Annu Rev Pharmacol Toxicol,2002,42:283-323.
[20]Cohen K,Flint N,Shalev S,et al.Thyroid hormone regulates adhesion,migration and matrix metalloproteinase 9 activity via αVβ3 integrin in myeloma cells[J].Oncotarget,2014,5(15):6312.
[21]黄正接,罗琪,颜江华,等.(RGD)3-tTF融合蛋白选择性结合结肠癌裸鼠模型肿瘤血管的实验研究[J].中国癌症杂志,2009,19(10):735-741.
[22]Leung SF,Stewart IE,Tsao SY,et al.Staging bone scintigraphy in nasopharyngeal carcinoma[J].Clin Radiol,1991,43(5):314-315.
[23]李前伟,郑秀海,张广运,等.125I-RGD-4CY肿瘤αvβ3受体显像的实验研究[J].第三军医大学学报,2002,24(11):1340-1342.
[24]安莲效,李慧,顾月清.RGD肽作为药物靶向配体的研究进展[J].中国生化药物杂志,2010,31(1):66-69.
[25]赵艳,万毅新,陶红艳.慢性炎症与慢性阻塞性肺疾病和肺癌进展的研究[J].临床肺科杂志,2013,18(1):108-109.
[26]Chin FT,Shen Bin,Liu Shuanglong,et al.First experience with clinical-grade[18F] FPP (RGD)2:an automated multi-step radiosynthesis for clinical PET studies[J].Mol Imaging Biol,2012,14(1):88-95.
[27]Choi N,Kim SM,Hong KS,et al.The use of the fusion protein RGD-HSA-TIMP2 as a tumor targeting imaging probe for SPECT and PET[J].Biomaterials,2011,32(29):7151-7158.
文章编号:1673-2995(2015)05-0361-03
中图分类号:R734.2
文献标识码:A
基金项目:国家863项目(SS2014AA091602),国家自然科学基金(30770297),国家海洋公益性行业科研专项(2013050165),大连市重大科技攻关项目(2013E11SF056,2014E12SF057).
作者简介:管箫玉(1989-),女(满族),硕士在读.
通讯作者:李庆伟(1955-),男(汉族),教授,博士. 王继红(1966-),女(汉族),教授,博士.
(收稿日期:2015-05-11)

