甲醇对HepG-2细胞毒理作用的初步研究
孙晓飞,宋大贺,刘淑艳,万 超,孙 燕(.辽宁出入境检验检疫局,辽宁 大连 6000;.大连机场出入境检验检疫局,辽宁 大连 6000; .大连森林动物园,辽宁 大连 6000)
甲醇对HepG-2细胞毒理作用的初步研究
孙晓飞1,宋大贺2,刘淑艳1,万 超1,孙 燕3
(1.辽宁出入境检验检疫局,辽宁 大连 116000;2.大连机场出入境检验检疫局,辽宁 大连 116000; 3.大连森林动物园,辽宁 大连 116000)
以HepG-2细胞作为研究对象,不同浓度甲醇作用细胞,观察细胞形态变化,采用CCK-8法测定吸光度值,确定甲醇对细胞的凋亡诱导作用。结果表明,当甲醇浓度达到8%时,对细胞毒力作用显著,所以,在使用甲醇作为贝类毒素的溶剂时,甲醇的使用浓度要<8%。
甲醇;HepG-2细胞;细胞活力
本次研究将甲醇配制为不同浓度的储备液,作用细胞中,观察细胞形态变化。采用CCK-8检测试剂盒检测细胞增殖情况,确定甲醇对细胞的影响。
1 材料和试剂
1.1 试验材料
1.1.1 细胞株 HepG-2人类肝肿瘤细胞株,由中国典型培养物保藏中心提供。
1.1.2 仪器
酶标仪;
培养摇床:SHKE4000-1CE;
二氧化碳培养箱:NU-5510E;
一次性移液器:corning 10 mL;
移液器:Eppendorf10 mL;
多通道移液器:0~200 μm;
细胞培养板:96孔;
滤膜:0.22 μm;
1.1.3 试剂
CCK-8细胞增殖-毒性检测试剂盒;
甲醇(分析纯);
细胞培养液:High-DMEM培养基;
胎牛血清:Gibco;
细胞消化液:胰酶-EDTA;
PBS磷酸盐缓冲液。
1.2 试剂配制细胞培养液:DMEM高糖培养基中加入12%胎牛血清,1‰青霉素和链霉素
甲醇储备液:用无血清培养基配制不同浓度甲醇溶液,体积分数分别为1%、2%、3%、4%、5%、6%、7%、8%、9%、10%,11%、12%,0.22 μm过滤,4℃保存。
2 试验方法
2.1 细胞培养与处理将对数生长期细胞经0.25%胰酶消化,将细胞反复吹打呈单个个体,用完全培养液重悬,测定细胞浓度。用多通道移液器将细胞悬液移入96孔细胞培养板,每孔接入100 μL(四周培养孔内不加入细胞悬液,加入100 μL无血清培养基,作为空白对照)37℃,5%二氧化碳培养箱培养18~24 h[4]。
吸弃96孔板内旧培养液,分别加入100 μL不同浓度的甲醇储备液,每个剂量3个重复孔,同时设空白、对照组。37℃,5%二氧化碳培养箱继续培养,分别在6、12、24、48 h对细胞进行观察,比较细胞形态的变化。

表1 不同浓度甲醇的配制Table1 Different concentrations of methanol
2.2 甲醇对细胞活力的测定本次检测试剂盒采用CCK-8细胞增殖-细胞毒性检测试剂盒,主要原理是CCK-8内的本四唑盐在电子载体存在的情况下能够被线粒体内的一些脱氢酶还原成橙黄色的水溶性的Fomazan,生成的Fomazan量与活细胞数量成正比。细胞毒性越大,则颜色越浅。对于同样的细胞,颜色的深浅和细胞数量呈线性关系。
甲醇作用细胞24 h后,弃掉原培养液,更换新无血清培养基。每孔加入10 μL CCK-8溶液,37℃孵育4 h,450 nm条件下测定各孔吸光值,计算细胞活力。

A试验:具有细胞、药物溶液和CCK-8溶液的孔的吸光度值;
A空白:含有细胞培养基和CCK-8溶液,不含细胞的孔的吸光度值;
A对照:具有细胞和CCK-8溶液,不含药物溶液的孔的吸光度值。
3 结果
3.1 甲醇对细胞形态影响通过在不同时间点对细胞形态的观察比较,确定甲醇作用细胞24 h时为最佳测定时间。甲醇对HepG-2人肝癌细胞染毒24 h后,倒置显微镜观察细胞形态的变化,如图1~10所示。图1中对照组细胞呈梭形生长,且细胞之间紧密连接;试验组低浓度甲醇对细胞未有明显作用,当甲醇浓度达到6%时,有死细胞出现,但数量极少;当甲醇浓度达到8时,30%细胞变圆缩小,对细胞呈现毒理作用;且随着甲醇浓度的增加,变化越趋明显,9%的甲醇致细胞50%~60%变圆缩小,部分细胞脱壁,细胞周围出现透明圈。10%的甲醇组细胞几乎全部呈圆形,部分细胞出现弥散状等细胞凋亡特征;当甲醇浓度达到12%时,100%细胞弥散状态。
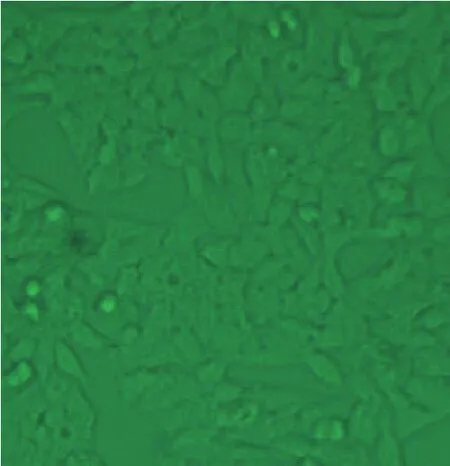
图1 对照组Fig.1 Control group

图2 1%甲醇添加组对细胞形态观察Fig.2 1%methanoladditiongrouptoobservethecellmorphology

图3 2%甲醇添加组对细胞形态观察Fig.3 2%methanol addition group to observe the cell morphology

图4 3%甲醇添加组对细胞形态观察Fig.4 3%methanol addition group to observe the cell morphology

图5 4%甲醇添加组对细胞形态观察Fig.5 4%methanol addition group to observe the cell morphology

图6 5%甲醇添加组对细胞形态观察Fig.6 5%methanoladditiongrouptoobservethecellmorphology

图7 6%甲醇添加组对细胞形态观察Fig.7 6%methanol addition group to observe the cell morphology

图8 7%甲醇添加组对细胞形态观察Fig.8 7%methanol addition group to observe the cell morphology

图9 8%甲醇添加组对细胞形态观察Fig.9 8%methanol addition group to observe the cell morphology

图10 10%甲醇添加组对细胞形态观察Fig.10 10%methanol addition group to observe the cell morphology

图11 12%甲醇添加组对细胞形态观察Fig.11 12%methanol addition group to observe the cell morphology
3.2 CCCCKK-- 88检测试剂盒试验结果试验数据按公式①计算细胞存活率,将存活率转换成增殖抑制率,以甲醇试验组为横坐标,不同浓度甲醇对HepG2细胞染毒的细胞增殖抑制率为纵坐标,如表2所示。
从表2中可以看出,细胞增殖抑制率随着甲醇浓度增大而增加。当甲醇浓度<7%时,抑制率差别不显著。
由图12可见,CCK-8检测试剂盒测定数值与细胞形态变化基本一致。
4 讨论
体外细胞毒性试验由于操作简便、试验条件可控以及不使用动物等优点,在化学物质毒性评价方面发挥着越来越重要的作用。目前,细胞毒性试验检测方法主要有MTT法、中性红法、乳酸脱氢酶(LDH)法、蛋白测定法及CCK-8细胞增殖-细胞毒性检测试剂盒法[5]。但是不同化学物质作用机制不同,每种方法的不足都可能对试验结果产生影响,所以,对不同的试验体系采用不同的细胞毒性方法,可以更好地推断其适用性。在本次试验预试验阶段中,使用MTT、中性红、LDH以及CCK-8等4种细胞毒性检测试剂盒对HepG2细胞毒性进行检测,结果显示,CCK-8试剂盒较其他细胞毒性检测法操作简便,无需多次进行细胞操作,减少了试验过程中人为因素导致的试验误差,降低了细胞污染的风险[6];与传统的MTT法相比,CCK-8试剂稳定,无放射性,并且对细胞没有毒性,可以长时间孵育,更适合细胞毒力的检测[7]。
以细胞活力作为甲醇对细胞毒性作用的参考,可以更加直观地反应毒理作用效果。细胞活力即在细胞群体中总有一些因各种原因而死亡的细胞,总细胞中活细胞所占的百分比。本次研究中,细胞初始状态良好,各组在试验后期显现出不同的细胞状态,其中的死细胞以细胞凋亡为主。细胞凋亡是细胞产生特征性生物学变化的程序性死亡过程。凋亡细胞主要特征为细胞收缩变小变圆,染色质裂解、核浓缩以及形成凋亡小体等[8]。本次试验使用的是HepG2细胞,该细胞来源于人类胚胎细胞瘤,所含生物转化代谢Ⅰ相和Ⅱ相酶,用于体外遗传毒性研究时,无需依赖外源性活化系统的加入,且该细胞分化程度较高,含有大量线粒体,被认为是检测外来化合物毒性的一个理想细胞系。同时,HepG2细胞易于培养,细胞状态稳定,可以避免由于细胞状态引起的细胞误差。
在本研究中用甲醇作用细胞,随着甲醇浓度的增加,细胞形态变化越趋明显。这说明一定浓度的甲醇会对细胞产生毒理作用。当甲醇含量为1%~3%时对细胞影响甚微,与对照组相比差异不显著。当甲醇含量为4%、5%、6%、7%时,死亡细胞数量略有增加,但细胞存活率显示与对照组差异不显著。通过图9可以看出,当甲醇含量达到8%时死细胞数明显增多,50%细胞形态发生变化,细胞变小变圆。
所以在使用甲醇作为溶剂时,要将浓度控制在8%以内,对检测结果的影响甚微。

图12 CCK-8法测定细胞增殖抑制率结果Fig.12 The cell viability results by the CCK-8
[1]谭志军,吴海燕,郭萌萌,等.脂溶性贝类毒素安全评价与检测技术研究进展[J].中国水产科学,2013(20):467-479.
[2]Franchini A,Marchesini E,Poletti R,et al. Lethal and sub-lethal yessotoxin dose induced morpho-functional alterationin intraperitoneal injected Swiss CD1 mice[J].Toxicon,2004,44:83-90.
[3]BLAY P K,BROMBACHER S,VOLMER D A.Studies on azaspiracid biotoxins.Instrumental validationforrapidquantificationofAZA1in complex biologicalmatrices[J]. Rapid Commun Mass Spectrom,2003,17.
[4]A.F.Flanagan,K.R.Callanan,J.Donlon,et al. A cyctotoxicity assay for the detection and differentiation of two families of shellfish toxins[J].Toxicon,2001,39:1021-1027.
[5]李雪,牛勇,贾强,等.四种细胞毒性试验测定柴油机尾气颗粒物提取物急性毒性的比较[J].卫生研究,2013(42):221-227.
[6]黄海燕,付英斌,赵昆山,等.麻痹性贝类毒素细胞检测法的建立[J].中国卫生检验杂志,2010,4(20):779-781.
[7]李磊,杨雨晗,王双,等.细胞活性检测方法之比较[J].生物学杂志,2011(2):87-90.
[8]庞敏,高春蕾,吴振兴,等.虾夷扇贝毒素对Hela细胞凋亡诱导作用的初步研究[J].中国海洋大学学报,2010,40(11):45-50.
Preliminary Research on the Toxicology of HepG-2 Cell Induced by Methanol
Sun Xiaofei1,Song Dahe2,Liu Shuyan1,Wan Chao1,Sun Yan3
(1.Liaoning Entry-Exit Inspection and Qurantine Bureau,Liaoning Dalian 116001; 2.Dalian Airport Entry-Exit Inspection and Qurantine Bureau,Liaoning Dalian 116001; 3.Dalian Forest Zoo,Liaoning Dalian 116000)
贝类毒素主要是由于海洋中有毒微藻或微生物产生,能够在海洋生物尤其是双壳贝类中富集的、对其他生物产生危害的一类小分子有毒化学物质[1]。从类型上划分,目前已经发现的贝类毒素分为脂溶性贝类毒素和水溶性贝类毒素。其中脂溶性贝类毒素包括0A、AZA、BTX、PTX、YTX、CIs等6种聚醚类物质,具有热稳定性,易融入甲醇、乙醚等非极性有机试剂中。所以在检测此类型贝类毒素时,甲醇作为常用的萃取剂。甲醇本身具有毒性,在探讨有机物的毒理作用时,首先要排除甲醇的毒理作用。有报道研究体积分数在0~10%的甲醇毒性甚微[2]。
目前,国际上检测AZA的方法主要采用小鼠生物测定法和高效液相色谱法(HPLC),尤其以高效液相色谱与质谱联用技术(HPLC-MS)的应用最为广泛[3]。但是由于小鼠生物法低灵敏度、不能确定具体毒素成分等技术上的缺陷,而液-质联用技术使用成本昂贵,前处理过程繁琐,不适合应用到贝类的常规筛选中。在2001年爱尔兰科研机构就试图建立一种快速、灵敏、特异的免疫学检测方法。细胞毒性试验和蛋白磷酸酶抑制试验等也正处于探索之中[18]。基于细胞的敏感性,为了更加系统地研究甲醇的毒理作用,本文采用细胞增殖方法来测定甲醇的对细
Different concentrations of methanol were administered to HepG-2 cells,the changes of cell morphology was observed,and apoptosis-inducing effect of methanol on cells were determined by recording the absorbance value in the CCK-8 assay.The results showed that:the 8%concentration of methanol has the most significant cytotoxic effect,so the concentration of methanol should under 8%when it was used as a shellfish toxin solvent.
Methanol;HepG-2 cell;Cell viability胞的致死量。
R735.7
1672-9692(2015)12-0007-05
2015-11-14
孙晓飞(1983-),女,硕士,兽医师,主要从事贝类毒素研究工作。
国家质检总局科技计划项目(2013IK037)

