山姜素对急性重症胰腺炎大鼠肺损伤中水通道蛋白-1表达的影响
山姜素对急性重症胰腺炎大鼠肺损伤中水通道蛋白-1表达的影响
聂容荣袁晟光1刘杰1余水平1唐芳2唐博1
(桂林医学院附属医院中医科,广西桂林541001)
摘要〔〕目的探讨山姜素对急性重症胰腺炎(SAP)肺损伤的保护作用是否与水通道蛋白(AQP)-1表达相关。方法选取60只雄性SD大鼠,随机分为正常对照组(Control组),假手术组(Sham组)、模型组(SAP组)、山姜素治疗组(Alpinetin组)每组15只。以逆行注入15 g/L 熊去氧胆酸钠(1 ml/kg)30 s注射制作SAP模型。各组均于造模8 h后剖杀,提取肺组织。检测肺组织髓过氧化物酶(MPO)活性、湿/干重比及对肺脏进行病理学评分;取材测定血清肿瘤坏死因子(TNF)-α含量;RT-PCR检测肺组织AQP-1 mRNA的表达,免疫组化法检测肺组织AQP-1的表达。结果SAP组与Sham组相比,SAP组肺组织损害程度明显升高(P<0.01),血清TNF-α,MPO活性明显增加(P<0.05)。AQP-1 mRNA与AQP-1蛋白表达显著下调(P<0.05)。Alpinetin组与SAP组相比,Alpinetin组肺干/湿比值、肺组织病理损害程度、血清TNF-α明显降低(P<0.05),AQP-1 mRNA和AQP-1蛋白表达则明显升高(P<0.05),AQP-1表达水平与TNF-α呈负相关。结论应用山姜素能够对SAP肺损伤起到明显的保护作用,其机制可能与抑制肺组织分泌TNF-α和上调AOP-1水平有关。
关键词〔〕山姜素;急性重症胰腺炎;肺损伤;水通道蛋白-1
中图分类号〔〕R285〔文献标识码〕A〔
基金项目:广西壮族自治区中医药管理局中医药科技专项基金资助(GZPT13-45)
通讯作者:唐博(1979-),男,副主任医师,博士,主要从事肝胆胰外科临床与基础研究。
1桂林医学院附属医院肝胆外科2桂林医学院附属医院病理科
第一作者:聂容荣(1981-),男,副主任医师,博士,主要从事中医肝病临床与基础研究。
急性重症胰腺炎(SAP)病情凶险,死亡率高,严重者导致全身炎症反应综合征(SIRS),从而导致多器官障碍〔1,2〕。其中最常见的是急性肺损伤(ALI)〔3〕,是临床上难治之症。SAP在中医学中属于“胃脘痛”、“脾心痛”范畴。《内经》有言,肺与大肠相表里。若肺脏功能失调,易致大肠之气发生郁塞。此时如能通导大肠,使得大肠腑气得以通调,则可促使肺之肃降功能恢复正常。肺为相傅之官而朝百脉,百脉顺,则诸症可解〔4〕。本课题前期进行了山姜素治疗SAP的临床预实验,抗ALI效果令人满意。本研究旨在进一步明确山姜素是否通过上调水通道蛋白(AQP)-1的表达来达到减轻ALI的效果。
1材料与方法
1.1实验动物雄性SD大鼠60只,体重(250±20)g。动物分笼饲养,自由饮水,喂标准颗粒饲料,室温(20±2)℃,动物及饲料均购由桂林医学院实验动物中心提供。实验研究经过桂林医学院附属医院伦理委员会的批准。
1.2药品及试剂山姜素购自美国Sigma公司;肿瘤坏死因子(TNF)-α的ELISA检测试剂盒,髓过氧化物酶(MPO)检测试剂盒,AQP-1抗体、免疫组化试剂盒购自武汉博士德生物工程有限公司;RT-PCR试剂盒购自大连宝生物公司。
1.3动物模型与分组大鼠随机分为正常对照组(Control组)、假手术组(Sham组)、模型组(SAP组)、山姜素治疗组(Alpinetin组),每组15只。所有大鼠禁食、自由饮水12 h,1%戊巴比妥钠(30 mg/kg)腹腔注射麻醉。正常对照组不做任何手术处理。Sham组模拟造模手术情况,开腹后仅轻度揉搓胰腺、翻转肠管5 min后即关腹。SAP组采用20 g/L水合氯醛腹腔注射麻醉,动物腹部剃毛,消毒术区皮肤,无菌条件下经正中切口入腹,在十二指肠乳头对侧肠壁插入1 ml小注射器针头经胰腺胆管十二指肠乳头开口入胰胆管,同时在胆管出肝门处用小动脉夹夹闭,逆行注入15 g/L熊去氧胆酸钠(1 ml/kg)30 s注射造模。Alpinetin组在SAP造模后0.5 h内,灌服山姜素80 mg/ml。
1.4标本采集及检测各组大鼠造模或术后8 h后处死,经腹主动脉采血,离心后血清置-70℃冰箱保存备用。
1.4.1肺干/湿比值测定动物放血致死后无菌操作下取左肺叶称湿重,置60℃烤箱连续烘烤24 h,去除水分后称干重。
1.4.2肺组织病理形态观察无菌操作下取出右肺下叶行常规甲醛固定、石蜡包埋,切片5 μm,HE染色观察,并行病理学评分。
1.4.3血清MPO及TNF-α含量测定大鼠解剖胸腔暴露肺,夹闭右肺下叶支气管。自主支气管灌入无菌生理盐水,每次8 ml,共5次,收集灌洗液。将灌洗液以2 000 r/min离心10 min,弃去上清。将沉淀用RPMI1640培养液悬浮,计数细胞,调整细胞浓度为1×106/ml,置24孔细胞培养板中。于37℃、5% CO2中培养1 h,用温培养液冲洗2次,去除未黏附细胞。然后将黏附细胞再置于培养液中培养24 h,取上清用于检测 TNF-α。TNF-α与MPO检测用ELLSA法。
1.4.4肺组织中AQP-1免疫组化检测取右肺组织常规脱水、包埋制成蜡块,用于免疫组化染色,采用SP法,PBS代替一抗作为阴性对照,按免疫组化试剂盒说明书操作。
1.4.5肺组织中AQP-1 mRNA表达检测取右肺组织,提取总RNA。RT-PCR采用一步法。AQP-1引物设计,上游为:5′-ATGGCCAGCGAAATCAAGAAG-3′,下游引物为5′-GATATCATCAGCATCCAGGTC-3′。β-actin作为内参照,其引物设计:上游为5′-GATATCGCTGCGCTCGTCGTC-3′,下游为5′-CATGAGGTAGTCTGTCAGGTC-3′。PCR反应条件:94℃预变性5 min,98℃变性10 s,55℃退火30 s,72℃延伸10 s,循环30次,72℃延伸1 min,最后降至4℃结束反应。PCR产物在琼脂糖凝胶中电泳后采用凝胶成像系统记录分析。
1.4.6肺组织中AQP-1蛋白表达Western印迹分析肺组织AQP-1蛋白表达代替。
1.5统计学方法采用SPSS18.0统计软件行方差分析。
2结果
2.1大鼠一般情况及死亡率观察Control组与Sham组大鼠一般状况较好,术后无死亡发生。SAP组大鼠一般状况差,出现精神萎靡、反应迟钝、懒动、竖毛、呼吸急促、拒食等表现,24 h死亡率高达50%。Alpinetin组大鼠的一般状况较模型组有不同程度的改善,24 h死亡率也有显著下降。
2.2肺脏病理学评分Control组与Sham组肺脏病理学大体观:肺脏形态、结构基本正常。SAP组肺脏表面暗红并伴有点片状出血灶,水肿明显。Alpinetin组肺脏见少量出血点,水肿轻。肺泡腔融合形成肺大泡.随着时间延长,上述表现呈逐渐加重趋势。按文献〔5〕肺组织病理评分标准,Control组组织学评分显著高于Sham组〔(0.41±0.43) vs(0.37±0.48),P<0.01〕,而Alpinetin组肺组织炎症反应明显减轻〔(0.81±0.48)〕,组织学评分显著低于SAP组〔(1.93±0.64),P<0.01〕。
2.3血清及肺组织各项指标表1可见,Sham组、Alpinetin组


组别TNF-α(μg/L)MPO(U/g)肺湿/干重比AQP-1mRNAAQP-1蛋白Control组56.31±5.822.82±0.426.53±0.380.782±0.026197±6Sham组74.31±6.433.42±0.726.31±0.250.812±0.029201±7SAP组216.8±15.1311.32±1.269.75±0.370.362±0.01197±5Alpinetin组100.48±30.121)6.91±1.721)6.62±0.411)0.773±0.0121)162±81)F/P值13.37/08.01/021.95/097.78/026.68/0
与SAP组比较:1)P<0.05
与SAP组相比血清TNF-α,MPO水平明显降低(P<0.05)。SAP组肺干/湿比值明显增加,Alpinetin组与其相比肺干/湿比值减少(P<0.05)。SAP组AQP-1 mRNA表达较Sham组显著下调(P<0.05),而Alpinetin组较SAP组AQP-1 mRNA表达明显上调(P<0.05)(图1)。SAP组AQP-1蛋白表达较Sham组明显下调(P<0.05),Alpinetin组AQP-1蛋白表达较SAP组明显上调(P<0.05)(图2)。
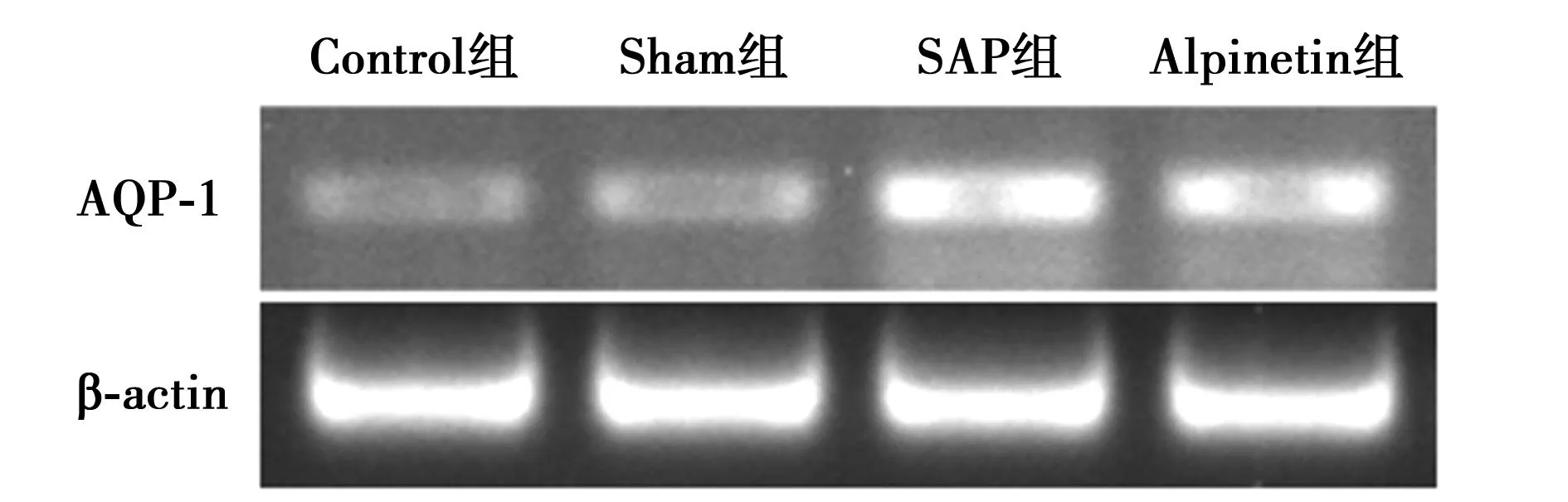
图1 各组大鼠造模后肺组织AQP-1 mRNA表达结果

图2 各组大鼠造模后肺组织AQP-1蛋白表达结果
3讨论
SAP并发ALI〔3〕,其病情发展迅速,死亡率高,是临床上难治之症。ALI治疗的难点之一是因为胰源性肺损伤的发病机制不甚明了。目前研究表明,胰源性肺损伤的发病机制与一系列因素有关,如细胞因子与炎症介质过度释放〔6,7〕,细胞凋亡〔8〕,中性粒细胞及巨噬细胞过度积聚〔7〕等。TNF-α是其中较为重要的炎症介质〔9,10〕。MPO是一种重要的含铁溶酶体,是中性粒细胞的功能标志和激活标志,其水平及活性变化代表着嗜中性多形核白细胞(PMN)的功能和活性状态,对机体产生和调节炎症反应等多方面发挥作用〔11〕。
AQP是与水的快速转运密切相关的细胞膜蛋白家族〔12,13〕,现已发现11种亚型,在肺组织内分布的有AQP-1、AQP-3、AQP-4、AQP-5四种,其中肺微血管内皮细胞中AQP-1含量相对较高〔14〕。AQP-1已经被证实参与了多种肺损伤性疾病的病理过程〔15〕。AQP-1在SAP并ALI时表达与肺水肿的严重程度呈负相关〔13〕。SAP在中医学中属于“胃脘痛”、“脾心痛”范畴。《灵枢·本输》云:“肺合大肠”,肺属太阴,大肠属阳明。五行同属金。肺与大肠生理上相互协调,病理上相互影响,治疗上相互为用。现代研究表明〔14〕,消化管、呼吸道的上皮组织大多来源于原始消化管的内胚层,这种胚胎学上的共同来源被认为是“肺与大肠相表里”的生理结构基础。中医学认为,SAP病程中,因肺失肃降,使得大量的有毒物质积聚体内,肠道也因此发生传导阻滞,出现腑实壅盛,里热积聚等证。此时如能选取合适的方法通利大肠,使肠腑之气得以通降,则肺之肃降功能也可恢复正常,肺气喘逆等症也能随之改善。
《名医别录》载:豆蔻味辛,温,无毒。主温中、心腹痛、呕吐。草豆蔻具有燥湿健脾、温胃止呕的功效,在中医临床上用于寒湿内阻、脘腹冷痛、嗳气呃逆、不思饮食等症。山姜素是姜科植物草豆蔻种子团中的主要成分,其结构式分别为7-羟基-5-甲氧基二氢黄酮。现代药理学研究表明,山姜素具有明显的抗菌、抗炎作用〔16,17〕。前期临床预实验表明,山姜素具有通里攻下作用,能促进胃肠道排空,减少肠道细菌易位,从而起到清热解毒,抑制肺组织多种细胞因子及炎症介质的释放,发挥通腑保肺的作用。本实验说明山姜素可有效抑制中性粒细胞在肺组织的聚集,进而减轻SAP并发的ALI。因此,山姜素对SAP肺组织具有较全面的保护作用,可能是上调AQP-1的表达来抑制TNF-α的分泌,达到减轻肺损伤的效果。
4参考文献
1Halonen KI,Pettilä V,Leppäniemi AK,etal.Multiple organ disfunction associated with severe acute pancreatitis〔J〕.Crit Care Med,2002;30(6):1274-9.
2Yuan Z,Meyerholz DK,Twait EC,etal.Systemic inflammation with multiorgan dysfunction is the cause of death in murine ligation-induced acute pancreatitis〔J〕.Gastrointest Surg,2011;15(10):1670-8.
3Pastor CM,Matthay MA,Frossard JL.Pancreatitis-associated acute lung injury:new insights〔J〕.Chest,2003;124(6):2341-51.
4王仲霞.肺与大肠相表里的理论及临床研究进展〔J〕.北京中医,2006;25(7):438-40.
5雷文章,韦靖江.实验性坏死性胰腺炎多器官损害与内毒素血症的关系〔J〕.中华实验外科杂志,1995;12(1):131-2.
6Huai JP,Sun XC,Chen MJ,etal.Melatonin attenuates acute pancreatitis-associated lung injury in rats by modulating interleukin 22〔J〕.World J Gastroenterol,2012;18(36):5122-8.
7Akbarshahi H,Rosendahl AH,Westergren-Thorsson G,etal.Acute lung injury in acute pancreatitis-awaiting the big leap〔J〕.Respir Med,2012;21(9):1199-210.
8Weng TI,Wu HY,Chen BL,etal.Honokiol attenuates the severity of acute pancreatitis and associated lung injury via acceleration of acinar cell apoptosis〔J〕.Shock,2012;37(5):478-84.
9Kylänpää L,Rakonczay Z Jr,O′Reilly DA.The clinical course of acute pancreatitis and the inflammatory mediators that drive it〔J〕.Int J Inflam,2012;2012:360685.
10徐军,张梅,刘学民,等.TNF-α基因表达在大鼠急性重症胰腺炎肺损伤中的作用〔J〕.西安交通大学学报,2004;8(4):388-9,392.
11陈平,王文闻,王刚,等.一氧化碳释放分子对重症急性胰腺炎肺损伤保护作用的实验研究〔J〕.中华肝胆外科杂志,2010;16(3):196-9.
12Jiao G,Li E,Yu R.Decreased expression of AQP1 and AQP5 in acute injured lungs in rats〔J〕.Chin Med J(Engl),2002;115(7):963-7.
13Su X,Song Y,Jiang J,etal.The role of aquaporin-1(AQP1) expression in a murine model of lipopolysaccharide-induced acute lung injury〔J〕.Respir Physiol Neurobiol,2004;142(1):1-11.
14Bai C,Fukuda N,Song Y,etal.Lung fluid transport in aquaporin-1 and aquaporin-4 knockout mice〔J〕.Clin Invest,1999;103(4):555-61.
15Towne JE,Harrod KS,Krane CM,etal.Decreased expression of aquaporin(AQP)1 and AQP5 in mouse lung after acute viral infection〔J〕.Am J Respir Cell Mol Biol,2000;22(1):34-44.
16Sala A,Recio MC,Schinella GR,etal.Assessment of the anti-inflammatory activity and free radical scavenger activity of tiliroside〔J〕.Eur J Pharmacol,2003;461(1):53-61.
〔2014-04-19修回〕
(编辑安冉冉/曹梦园)
欢 迎 投 稿欢 迎 订 阅

