活血通腑方含药血清对大鼠腹膜间皮细胞增殖的作用
·基础研究·
活血通腑方含药血清对大鼠腹膜间皮细胞增殖的作用
颜帅曾莉李文林
(南京中医药大学,江苏南京210023)
摘要〔〕目的观察活血通腑方含药血清干预体外培养大鼠腹膜间皮细胞增殖的效果,初筛对大鼠腹膜间皮细胞增殖能力有影响的最佳药物剂量和时间。方法采用腹腔注射胰酶消化的方式建立RPMC细胞模型,运用血清药理学方法制备不同剂量的活血通腑方含药血清,细胞培养经鉴定成功后分组(空白组、空白血清组、活血通腑方低剂量组、活血通腑方中剂量组、活血通腑方高剂量组),应用 MTT法检测活血通腑方含药血清对大鼠腹膜间皮细胞的作用。结果与空白血清组比较,活血通腑方中剂量组含药血清可显著促进RPMC细胞增殖,作用时间在36 h 时最为显著。结论活血通腑方含药血清具有诱导大鼠腹膜间皮细胞增殖的作用。
关键词〔〕活血通腑方;腹膜间皮细胞
中图分类号〔〕R264〔文献标识码〕A〔
基金项目:国家自然科学基金面上项目(No.81373843);南京中医药大学中医学一级学科开放课题资助项目(YS2012ZYX111)
通讯作者:曾莉(1962-),女,教授,博士生导师,主要从事术后腹腔粘连防治研究。
第一作者:颜帅(1986-),男,在读博士,主要从事术后腹腔粘连防治研究。
Influence on proliferation of rat peritoneal mesothelial cells by serum containing of Huoxuetongfu formula
YAN Shuai,ZENG Li,LI Wen-Lin.
The First Medical College of Nanjing University of Chinese Medicine,Nanjing 210023,Jiangsu,China
Abstract【】ObjectiveTo investigate the influence of in vitro proliferation ability of rat peritoneal mesothelial cells(RPMCs) by serum containing of Huoxuetongfu formula and preliminary screen the optimum dose and time.MethodsTrypsin digestion method in vitro was used to establish RPMCs model,and divided into blank,blank serum,Huoxuetongfu formula low dose,Huoxuetongfu formula dose,Huoxuetongfu formula high dose groups.MTT was used to detect the effects of serum containing of Huoxuetongfu formula on RPMCs.ResultsCompared with those of blank serum group,huoxuetongfu formula drug serum improved RPMCs proliferation stimulating effect,and reaction time at 48h was the most significant.ConclusionsHuoxuetongfu formula drug serum has inducing role of RPMCs proliferation.
【Key words】Huoxuetongfu formula;Peritoneal mesothelial cell
腹膜间皮细胞可合成纤溶成分并分泌多种细胞因子,维持腹腔内局部微环境。相关研究显示腹膜间皮细胞的完整性及功能正常与否是腹腔粘连形成的关键因素〔1〕。活血通腑方是曾莉教授依据祖国医学“六腑以通为用”、“腑病以通为补”的原则,在总结多年临床防治术后粘连经验的基础上形成的验方。经药效实验和处方优化后〔2,3〕,在活血通腑方前期临床疗效观察基础上〔4〕,以整体动物为研究对象,发现活血通腑方能降低实验性腹腔粘连大鼠术后血清白细胞介素(IL)-8、肿瘤坏死因子(TNF)-α水平,下调粘连组织中Col-Ⅰ mRNA的表达水平,防治粘连效果确切〔5〕。本实验通过观察活血通腑方的含药血清对腹膜间皮细胞增殖的影响,获取活血通腑方含药血清干预大鼠腹膜间皮细胞的最佳药物剂量和时间。
1材料与方法
1.1动物雄性清洁级SD 大鼠(原代细胞用),体质量160~180 g,由上海杰思捷实验动物有限公司提供,许可证号码:SCXK(沪)2012-0006。
1.2药物大黄、桃仁、红花、芒硝、延胡索、莱菔子由南京中医药大学附属医院提供,均由南京市药品检验所核定。
1.3试剂DMEM/F12 培养基、胎牛血清、0.25% 胰蛋白酶-EDTA、青霉素、链霉素抗生素、D-Hank液(Gibco公司);各种免疫组化染色一抗、抗角蛋白(Keratin)抗体、抗波形蛋白(Vitamin)抗体、抗白细胞CD45 抗体、抗第Ⅷ因子抗体及 SABC 试剂盒(武汉博士德公司)。四甲基偶氮唑盐(MTT,Sigma);二甲基亚砜(DMSO,南京凯基生物科技有限公司);多聚甲醛(天津市科密欧化学试剂有限公司);PBS缓冲液(自配)。
1.4主要仪器CPA224S电子分析天平(北京赛多利斯科学仪器有限公司);电恒水浴锅、精密鼓风干燥箱(上海一恒科学仪器有限公司);CKX31倒置式生物显微镜(日本 OLYMPUS公司);常温低速离心机(德国 Eppendorf 公司);垂直流超净工作台(新加坡艺思高科技有限公司);CO2恒温培养箱(美国Thermo Scientific公司);Synergy 2全自动酶标仪(美国 Bio-Tek 公司);纯水仪(美国Millipore公司)。
1.5药物制备参照文献〔5〕,取大黄,桃仁,延胡索,莱菔子各100 g,加饮片总量15倍的70%乙醇,分两次回流提取,每次2 h,滤过,合并提取液,滤液减压回收乙醇,浓缩至无醇味。上述药渣与红花60 g合并,加饮片总量20倍水,分3次煎煮,每次1 h,滤过,合并水煎液,滤液浓缩至相对密度为1.09~1.11(60℃),冷却,加乙醇至含醇量50%,搅匀,静置48 h,取上清液加芒硝100 g,浓缩至相对密度1.12~1.15(60℃),4℃储存备用。灌胃前用生理盐水配制成浓度分别为200、600、1 800 g/L的低、中、高剂量给药样品液。
1.6含药血清的制备将大鼠随机分为不含药血清组、活血通腑方低、中、高剂量含药血清组,每组6 只。每日上午给药前将大鼠禁食12 h,活血通腑方低、中、高剂量含药血清组分别按200、600、1 800 g/L剂量给大鼠灌胃,每日2次,连续3 d。不含药血清组仅给予等体积生理盐水灌胃,在最后一次给药2 h 后,腹主动脉取血,取血后用颈椎脱臼法处死动物。血液置于10 ml离心管内,室温放置1 h,待充分凝血后,4℃放置过夜。3 000 r/min离心15 min,分离血清,56℃水浴上放置30 min,在超净工作台内用0.22 μm 微孔滤器滤过除菌,无菌分装,密封后-80℃保存备用。
参考文献1.7细胞的培养、传代及鉴定〔6~8〕,在大鼠腹腔内注射 0.25% 胰蛋白酶-0.02% EDTA 消化液,1.5 h后在超净台无菌打开腹腔,吸取腹腔液至15 ml 离心管,若肉眼可见红细胞,则加红细胞裂解液室温裂解10 min,1 500 r/min离心10 min,弃上清并用D-Hank液将细胞洗一遍,离心弃上清,以含 15%胎牛血清的DMEM/F12培养基重悬细胞,置于37℃、5%CO2、湿度95%的培养箱中静置培养。3 d 后细胞完全贴壁后换液,以后每 3 d换液 1 次,约培养6~9 d细胞融合至 90% 以上后可传代培养。3 d后首次换液,以后根据细胞生长状态每2~3 d换液1次,取第2代细胞经倒置显微镜观察并采用免疫组化法对大鼠腹膜间皮细胞进行Keratin、Vitamin抗体、抗白细胞CD45 抗体、抗第Ⅷ因子(Factor Ⅷ)等相关抗原鉴定,取第3代细胞用于实验。
1.8MTT法测定RPMC增殖选取状态良好的对数生长期腹膜间皮细胞,0.25%胰蛋白酶消化后制成细胞悬液,调整细胞浓度,以每孔2×104/ml密度均匀接种于 96 孔培养板中,每孔加200 μl。每个培养板的周围边缘孔用0.01 mol/L PBS 填充。接种后将培养板放入37℃、5%CO2湿度95%的培养箱中静置培养24 h,24 h后取出96孔板,弃去上清,加入0.5% FBS培养基继续放入培养箱中培养24 h,24 h后随机分为以下5组,A 组(空白血清组):5 μl 空白血清+DMEM/F12 单培90 μl;B 组(不含药大鼠血清组):5 μl 大鼠不含药血清+ DMEM/F12 单培95 μl;C 组(活血通腑方低剂量组):5 μl 大鼠含药血清+DMEM/F12 单培95 μl;D 组(活血通腑方中剂量组):5 μl 大鼠含药血清+ DMEM/F12 单培95 μl;E 组(活血通腑方高剂量组):5 μl 大鼠含药血清+ DMEM/F12 单培95 μl。另设空白对照组加入PBS,同时以无细胞培养液的孔作为调零孔,每组设6个复孔。作用12、24、36 h后,每空加入50 μl MTT溶液(5 mg/ml),37 ℃继续孵育4 h,弃除培养板各组孔内上清液,每孔加入 150 μl DMSO,振荡 10 min 后,用酶标仪在 490 nm 波长处测定各孔光吸光度,并计算OD值。
1.9统计学处理采用 SPSS19.0软件,多组间比较运用单因素方差分析,两两比较采用LSD法检验。
2结果
1.1倒置显微镜下观察及免疫组化鉴定大鼠腹膜间皮细胞在倒置显微镜下观察24 h后贴壁的大鼠原代细胞,培养初期呈梭形及椭圆形,1 w后融合成多边形细胞,外观如铺路鹅卵石样,为典型的腹膜间皮细胞外形(图1A、图1B)。光镜下鉴定的细胞的Keratin和Vitamin染色均呈棕色(图1C,图1D),而第Ⅷ因子相关抗原及CD45抗原染色均为阴性(图1E,图1F)。
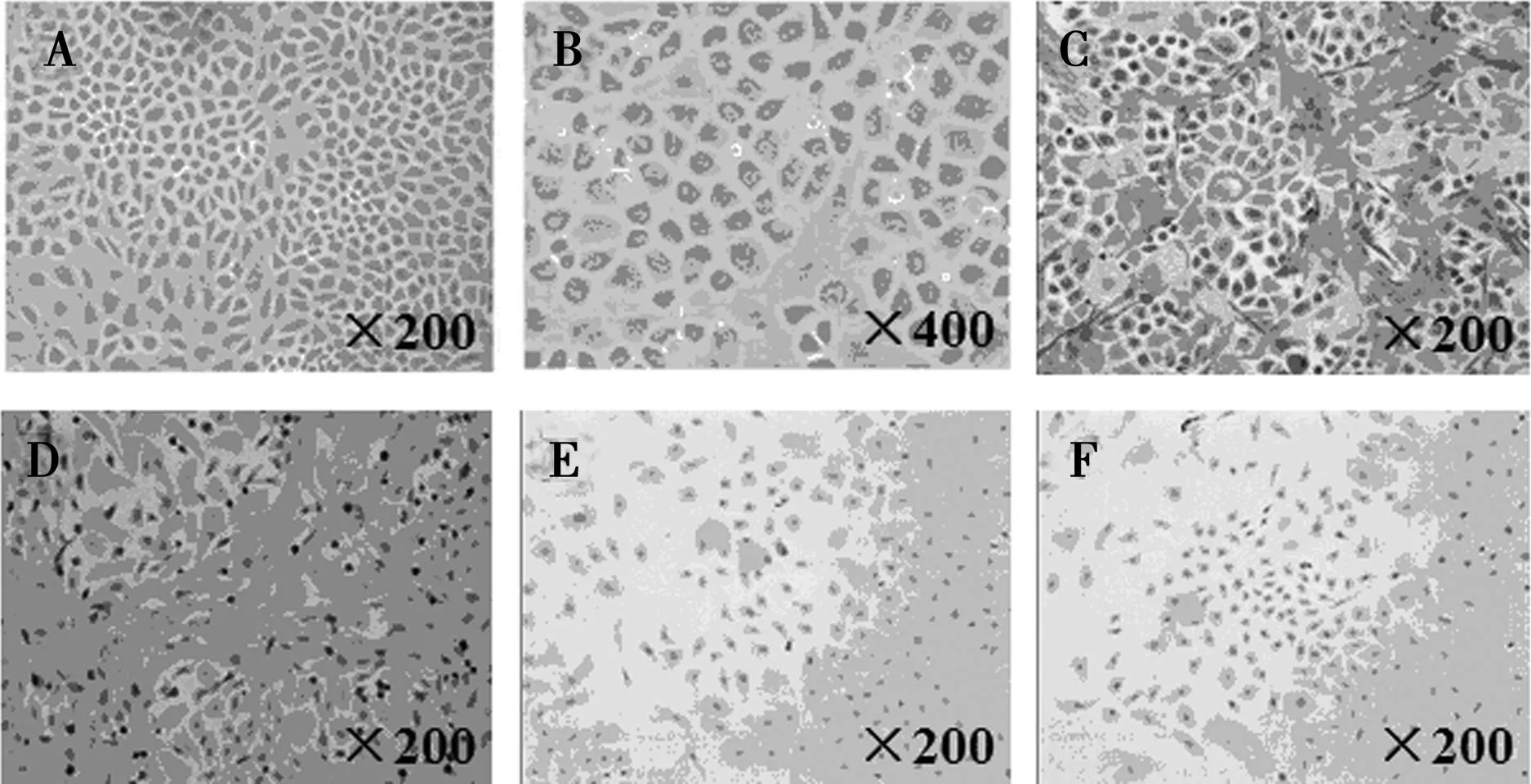
A,B:倒置显微镜下腹膜间皮细胞的形态;C:Keratin(+);D:Vitamin(+);E:CD45(-);F:第Ⅷ因子(-) 图1 原代腹膜间皮细胞培养形态及免疫组化相关鉴定
2.2不同剂量活血通腑方含药血清作用RPMCs 各时间点 OD 值变化经Mauchly球形检验可知,统计量W=0.355,P=0.000,拒绝球形假设,用Epsilon校正,选取Huynh-Feldt一行的结果,P=0.02,表明各组OD值在不同时间点均值不等,提示细胞增殖数量有随时间变化的趋势,且时间因素的作用差异随着分组的不同而改变。组内效应方差分析显示,时间:F=46.712,P=0.000,不同时间各组的光密度值有统计学意义;时间*组别:F=4.550,P=0.003,分组和时间的交互作用有统计学意义。组间效应方差分析,F=19.775,P=0.000,各组药物在不同时间总的OD值差异显著(P<0.05)。培养12 h和24 h 后,各组间OD值差异不明显(P>0.05),仅有活血通腑方中剂量含药血清组与空白血清组相比差异显著(P<0.05),提示活血通腑方含药血清无毒性。活血通腑方中剂量组在36 h时OD值与其他各组相比差异显著(P<0.01)。见表1。


组别12h24h36h空白组0.266±0.1810.280±0.0060.302±0.011空白血清组0.391±0.0870.532±0.0280.686±0.376活血通腑方低剂量组0.423±0.0290.438±0.0200.761±0.104活血通腑方中剂量组0.458±0.0861)0.502±0.0331)0.819±0.0691)活血通腑方高剂量组0.455±0.0170.516±0.0270.816±0.046
与空白血清组相比:1)P<0.01
3讨论
术后腹腔粘连发病率较高,可引起诸如慢性疼痛、机械性肠梗阻、女性不孕及增加二次手术风险等并发症,给患者精神和经济上带来双重负担〔9〕。研究发现腹膜间皮细胞可以分泌多糖包被,同时亦可合成一系列的细胞因子和生长因子,调节炎症反应,诱导细胞增殖分化和迁移,介导组织修复〔10〕。
本实验研究表明不同剂量的活血通腑方含药血清可不同程度提高RPMC的光密度值和存活能力。活血通腑方中剂量组作用 36 h 后RPMC的活性最强,而活血通腑方高剂量组作用36 h 后,虽然没有出现对细胞的抑制作用或者毒副作用,但RPMC的存活率相对较低。综上,活血通腑方能诱导正常腹膜间皮增殖,无毒性,未来可能成为防治腹腔粘连的有效手段。
4参考文献
1Cheong YC,Laird SM,Li TC,etal.Peritoneal healing and adhesion formation/reformation 〔J〕.Hum Reprod Update,2001;7(6):556-66.
2曾莉,徐庆,夏卫军,等.活血通腑方治疗腹腔粘连处方优化的正交T值法研究〔J〕.中国中医急症,2008;17(3):370-1.
3曾莉,翟亚春,夏国守,等.活血通腑方有效剂量筛选实验研究〔J〕.南京中医药大学学报,2004;20(5):309-11.
4曾莉,钱海华,赵群男,等.活血通腑方治疗术后粘连性肠梗阻 56 例临床观察〔J〕.南京中医药大学学报,2010;26(3):178-80.
5颜帅,杨斓,曾莉,等.活血通腑方优化方防治大鼠术后腹腔粘连的最佳有效剂量的实验研究〔J〕.中国实验方剂学杂志,2014;20(9):166-70.
6Zou XL,Pei DA,Yan JZ,etal.A20 overexpression inhibits lipopolysaccharide-induced NF-κB activation,TRAF6 and CD40 expression in rat peritoneal mesothelial cells 〔J〕.Int J Mol Sci,2014;15(4):6592-608.
7Liu L,Du L,Chen Y,etal.Down-regulation of Aquaporin1(AQP1) by peptidoglycan via p38 MAPK pathways in primary rat pleural mesothelial cells.Exp Lung Res,2014;40(4):145-53.
8Liu Q,Zhang Y,Mao H,etal.A crosstalk between the Smad and JNK signaling in the TGF-β-induced epithelial-mesenchymal transition in rat peritoneal mesothelial cells 〔J〕.PLoS One,2012;7(2):e32009.
9Ten Broek RP,Wilbers J,van Goor H.Electrocautery causes more ischemic peritoneal tissue damage than ultrasonic dissection 〔J〕.Surg Endosc,2011;25(6):1827-34.
10Yung S,Li FK,Chan TM.Peritoneal mesothelial cell culture and biology 〔J〕.Perit Dial Int,2006;26(2):162-73.
〔2014-09-04修回〕
(编辑郭菁)

