老年慢性肾脏病患者颈动脉内中膜增厚及粥样斑块的危险因素
老年慢性肾脏病患者颈动脉内中膜增厚及粥样斑块的危险因素
王利军董春霞史亚男郭岚牛凯胡志娟刘冰
(河北省人民医院肾内科,河北石家庄050051)
摘要〔〕目的回顾性分析老年慢性肾脏病(CKD)患者发生颈动脉内中膜厚度(IMT)增厚及颈动脉粥样斑块的危险因素。方法回顾性分析河北省人民医院47例CKD 2~5期老年患者的临床资料,分析其IMT增厚、颈动脉粥样斑块发生的危险因素。结果单因素相关分析显示,颈动脉IMT增厚与年龄、肌酐、尿素及血清磷呈正相关,而与肾小球滤过率、总胆红素呈负相关。CKD患者颈动脉IMT危险因素Logistics回归分析,IMT的增厚与年龄、血清总胆红素(TBIL)和血磷密切相关。结论年龄、TBIL和血磷是老年CKD患者发生动脉粥样硬化的独立危险因素。老年CKD患者存在低胆红素血症,低胆红素血症与颈动脉IMT相关,其可能参与了CKD患者动脉粥样硬化的发生和发展。
关键词〔〕慢性肾脏病;胆红素;颈动脉内膜-中层厚度;动脉粥样硬化
中图分类号〔〕R5〔文献标识码〕A〔
通讯作者:刘冰(1965-), 男,硕士,主任医师,教授,硕士生导师,主要从事肾小球疾病的诊治和慢性肾病并发症防治研究。
第一作者:王利军(1969-),男,硕士, 副主任医师,副教授,主要从事慢性肾脏病与血液透析患者心血管并发症的防治研究。
慢性肾脏病(CKD)患者是发生动脉粥样硬化(AS)性疾病的高危人群,其心脑血管疾病的患病率及相关的病死率均远远高于普通人群〔1〕。颈动脉是评估AS的特殊部位,可以反映全身的粥样硬化情况。本文观察老年CKD患者颈动脉内中膜增厚及粥样斑块的危险因素,研究血清胆红素水平与颈动脉内膜中层厚度(IMT)的关系,以了解胆红素在老年CKD患者AS形成过程中的作用。
1资料与方法
1.1一般资料选择2010年1月至2011年12月在河北省人民医院住院病房诊治的CKD 2~5期患者47例为研究对象。CKD的诊断按照慢性肾脏病及透析的临床实践指南(K/DOQI): ①肾脏损伤(肾脏结构或功能异常)≥3个月,可以有或无肾小球滤过率(GFR)下降,可表现为病理学检查异常或肾损伤的指标(包括血、尿成分)异常或影像学检查异常;②肾小球滤过率< 60 ml·min-1·m-2≥3个月,有或无肾脏损伤证据。采用中国修订的MDRD公式计算eGFR,其中CKD 2~3期11例, CKD 4期16例,CKD 5期20例。排除标准:①急性肾功能不全;②慢性肾功能不全急性加重者;③近1个月发生过急性心血管事件、感染、手术、创伤者;④近半年内使用过激素和免疫抑制剂者;⑤合并肝病、胆道系统疾病、血液系统疾病、恶性肿瘤、妊娠者;⑥糖尿病肾病。发病前均未服用降脂药、利胆剂及利尿剂。
1.2颈动脉多普勒超声检查由专人操作,检测仪器为philips-iu22型彩色多普勒超声诊断仪,使用血管超宽频探头,频率为7.5 MHz。检查部位包括双侧颈总、颈内动脉,颈动脉内IMT于颈总动脉分叉近端1 cm处后壁测量或IMT最厚处,右颈总动脉各测量3次,取平均值以平均IMT≥1.0 mm为内中膜增厚,以IMT或最大IMT>1.2 mm为斑块。
1.3收集一般资料记录所有研究对象的性别、年龄等。由于部分患者年龄偏大卧床,而未计算体质指数(BMI)等。
1.4血液生化指标检测所有患者禁食12 h后采空腹肘静脉血检测总蛋白(TP)、白蛋白(ALB)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、血清肌酐(Cr)、尿素氮(BUN)、血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、载脂蛋白AⅠ(ApoAⅠ)、载脂蛋白B(ApoB)、血红蛋白(HB)、尿酸(UA)、血钙(Ca)、血磷(Ph)、血浆纤维蛋白原(FIB)等。检测项目均按说明书严格操作、并在HITACHI-7600全自动生化分析仪上进行测试。
2结果
2.1患者的一般情况47例患者中男21例,女26例;平均年龄(74.02±9.31)岁;TP(59.98±9.48)g/L;ALB(32.88±6.08)g/L;TBIL(6.99±3.38)μmol/L;DBIL(2.82±1.52)μmol/L;IBIL(4.17±2.38)μmol/L;血脂:TC(3.64±1.03)mmol/L;TG(1.66±1.37)mmol/L;HDL(1.02±0.42)mmol/L;LDL(2.43±0.80)mmol/L;ApoAⅠ(1.02±0.60)mmol/L;ApoB(0.83±0.24)mmol/L;UA(410.43±113.66)μmol/L,FIB(3.48±0.90)g/L;Ca(1.99±0.24)mmol/L;Ph(1.54±0.40)mmol/L;BUN(23.24±12.56)mmol/L;Cr(414.73±231.13)μmol/L、 eGFR(21.74±16.33)ml·min-1·1.73 m-2。
2.2颈动脉IMT增厚及AS的影响因素IMT与年龄、BUN、Cr、Ph呈正相关,而与eGFR,TBIL、DBIL、IBIL呈负相关。见表1。
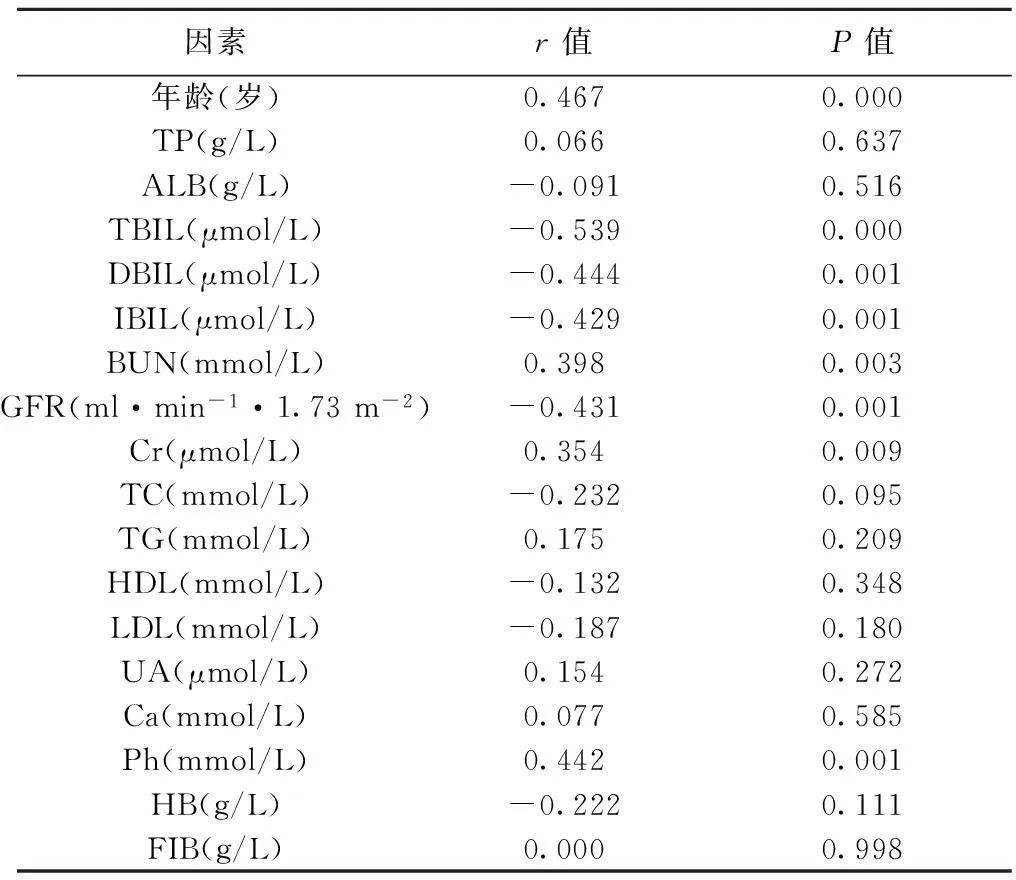
表1 CKD患者IMT与各生化指标的相关分析
2.3颈动脉增厚组与斑块组指标比较按颈动脉内膜增厚程度将患者分为颈动脉内膜增厚组与斑块组进行比较,年龄、性别、TC、TG、HDL、LDL、ApoAⅠ、ApoB、BUN、Cr、GFR、Hb、UA等均无统计学差异,斑块组 TBIL、DBIL、IBIL、等均明显低于内膜增厚组(P<0.01,见表2)。
2.4不同分期CKD患者各指标比较根据CKD分期将患者分为3组:CKD 2~3期(GFR 30~90 ml·min-1·1.73 m-2)11例,CKD 4期(GFR 15~29 ml·min-1·1.73m-2)16例,CKD 5期(GFR<15 ml·min-1·1.73 m-2)20例。如表3所示,3组间IMT、TBIL均有明显统计学差异。随着GFR的降低,TBIL水平降低,IMT增加。
2.5二元Logistic回归分析以IMT为应变量(IMT<1 mm为0,IMT≥1 mm为1),以年龄、性别、BMI、TBIL、DBIL、IBIL、TC、TG、HDL、LDL、ApoAⅠ、ApoB、BUN、Cr、GFR、HB、UA为协变量,采用前进LR法进行多元Logistic回归分析,经校正以上因素后,IMT的增厚与年龄、TBIL和血磷密切相关。相对危险度分别为1.262、0.496、45.331。见表4。

表2 老年CKD患者颈动脉内膜增厚组与
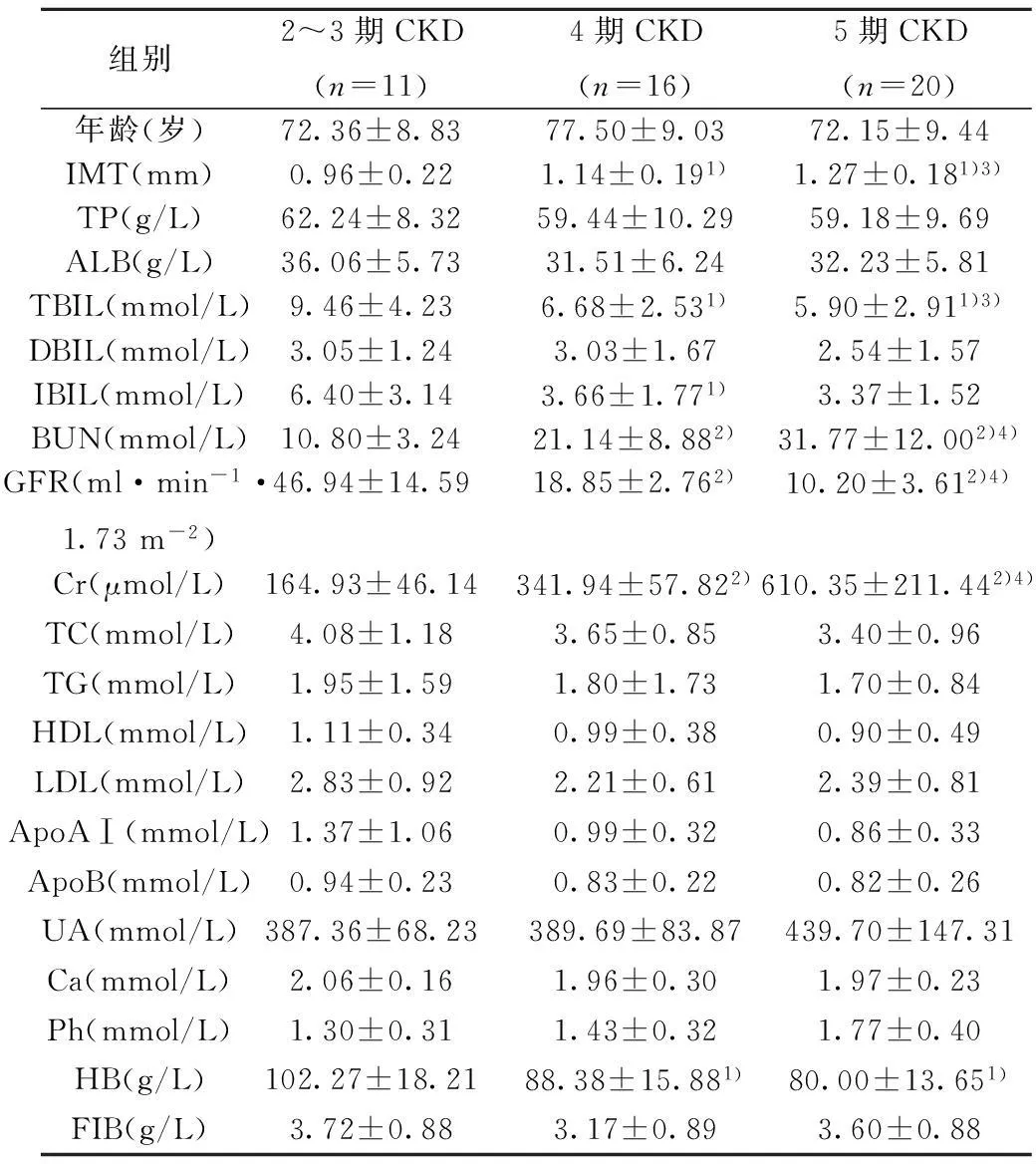
表3 老年CKD分期患者各组生化指标的比较
与2~3期比较:1)P<0.05,2)P<0.01;与4期比较:3)P<0.05,4)P<0.01
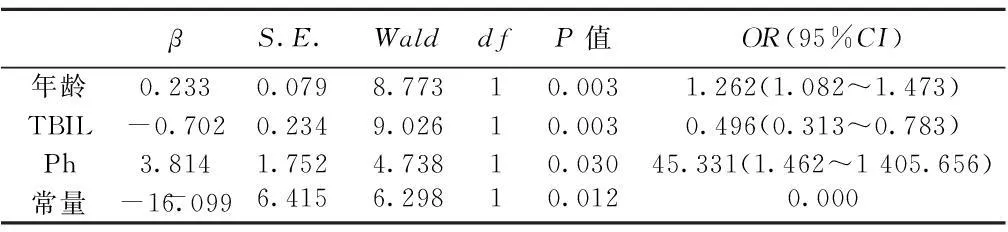
表4 CKD患者颈动脉IMT危险因素Logistic回归分析
3讨论
多项前瞻性研究认为低胆红素血症对未来发生心血管病有预示作用。胆红素是血红蛋白的代谢产物,正常情况下人体内的70%~80%胆红素来自血红蛋白的降解。在细胞微粒体血红素加氧酶作用下,血红素被降解为胆绿素、一氧化碳和三价铁离子。胆绿素经还原生成胆红素。胆红素强抗氧化作用近年来正被逐渐揭示。循环中不同类型的胆红素均是有效的抗氧化物质,如游离胆红素、白蛋白结合胆红素和未结合胆红素等均可清除超氧自由基的损伤和保护人体LDL以对抗超氧化损伤〔2〕。Schwerther等〔3〕研究发现无论进行单因素分析还是多因素分析,血清胆红素浓度与冠状动脉硬化程度均呈显著负相关。血清胆红素下降50%,冠心病的发生率增加47%。Breimer等〔4〕对7 685例英国中年男子进行了长达11.5年的前瞻性随访性研究,发现随着血清胆红素水平的升高,发生缺血性心脏病事件的危险性逐渐降低。本研究结果发现,老年CKD患者血清TBIL、DBIL和IBIL随GFR的降低而降低,与王利军等〔5〕在非老年CKD患者中研究结果相一致;随着肾功能的进一步进展,颈动脉IMT增加,并显示血清胆红素与颈动脉内膜增厚程度呈负相关,提示低血清胆红素可能是老年CKD患者AS的危险因素。
近年研究发现,即使在早期CKD患者中,心血管疾病的危险也明显增加〔1〕。前瞻性随机对照研究HOPE中也提示,即使轻微的肾功能减退(血肌酐100~200 μmol/L)也是独立于高血压、糖尿病、清蛋白尿之外的导致AS和冠状动脉病变的危险因素〔6〕。并且肾功能不全本身可能与传统危险因素一样,具有类似或者更大的导致心血管疾病的作用。本研究单因素相关分析及回归分析均证实,年龄也是CKD患者AS的独立危险因素,这与大多数学者的观点是一致的〔7〕。
导致CKD患者AS的原因目前尚不完全清楚,包括传统危险因素如高血脂、糖尿病、高血压等以及尿毒症特有的因素,如容量负荷过度、贫血、钙磷代谢紊乱等。近年来寻找能反映CKD患者心血管疾病高危因素的生物学标志物已成为目前关注的重点。粥样斑块是AS的明显特征,动脉内皮损伤及脂质代谢异常与AS的发生和发展有密切关系。脂蛋白(a)是AS斑块中重要的脂质成分,具有强烈的致AS和促血栓形成作用。本研究发现脂蛋白(a)在老年CKD患者中并未明显升高,在回归分析中也未与颈动脉IMT相关,是否AS的独立危险因素值得进一步研究。
CKD3期时即可出现钙磷失衡、继发性甲状旁腺功能亢进,上述改变相互影响,导致血管钙化和心血管事件发生危险增加。其中高血磷是引起心血管钙化的关键因素。Raggi等〔8〕对205例维持性血液透析患者资料分析显示:高磷血症是血管钙化特别是冠状动脉钙化的独立危险因素,血磷水平每增加1 mg/dl对冠脉钙化造成的危险性相当于增加 2.5 年的血液透析时间,是影响CKD患者生存的重要因素之一〔9〕。高磷血症可引起甲状旁腺激素分泌增加,介导血管内皮细胞增生分化成骨样细胞,促进血管钙化。钙、磷代谢紊乱所致的转移性软组织钙化可能导致动脉血管顺应性降低,致使AS、动脉狭窄以及冠状动脉和心脏瓣膜的钙化等。本研究发现血清磷与颈动脉IMT呈正相关,出现在多因素逐步回归模型中,可能与早中期CKD患者血钙磷乘积水平相对较低有关。
本研究未发现TC、TG、LDL与颈动脉IMT、颈动脉斑块相关,可能与3、4、5期CKD患者逐渐出现营养不良导致血脂偏低有关。LDL-C在普通人群中与心血管疾病的发生明确相关,而在CKD患者中LDL-C变化不大。
由此可见老年CKD患者颈动脉IMT、斑块形成与低胆红素血症、高磷及肾功能进展相关。
4参考文献
1Govindarajan G,Saab G,Whaley-Connell A.Outcomes of carotid revascularization in patients with chronic kidney disease 〔J〕.Adv Chronic Kidney Dis,2008;15(4):347-54.
2Mayer M.Association of serum bilirubin concentration with risk of coronary artery disease〔J〕.J Clin Invest,2000;106(6):793-802.
3Schwertner HA,Jackson WG,Tolan G.Association of how serum concentration of bilirubin with increased risk of coronary artery disease〔J〕.Clin Chem,1994;4(6):18-23.
4Breimer LH,Wansemethee G,Ehrehim S.Serum bilirubin and risk of ischemic heart disease in middle-aged British men 〔J〕.Clin Chem,1995;41:1504-8.
5王利军,刘冰,史亚男,等.慢性肾脏病患者血清总胆红素水平与颈动脉内膜中膜厚度的关系〔J〕.中国动脉硬化杂志,2012;20(7):639-42.
6Mann JF,Gerstein HC,Dulau-Florea I,etal.Cardiovascular risk in patients with mild renal insufficiency〔J〕.Kidney,2003;(Suppl 84):S192-6.
7Toussaint ND,Lau KK,Strauss BJ,etal.Associations between vascular calcification,arterial stiffness and bone mineraldensity in chronic kidney disease 〔J〕.Nephrol Dial Transplant,2008;23(2):586-93.
8Raggi P,Boulay A,Chasan-Taber S,etal.Cardiac calcification in adult hemodialysis patients.A link between end-stage renal disease and cardiovascular disease〔J〕 J Am Coll Cardiol,2002;39:695-701.
9Masho Y,Shigematsu T.Arteriosclerosis and vascular calcification in chronic kidney disease(CKD)patients 〔J〕.Clin Calcium,2007;17:354-9.
〔2013-10-31修回〕
(编辑赵慧玲/曹梦园)

