人乳头状瘤病毒感染、P53及缺氧诱导因子-1α蛋白表达与非小细胞肺癌的相关性
人乳头状瘤病毒感染、P53及缺氧诱导因子-1α蛋白表达与非小细胞肺癌的相关性
周颖张辉谢永红1赵敏沈彦
(秦皇岛市第一医院病理科,河北秦皇岛066000)
摘要〔〕目的探讨人乳头状瘤病毒(HPV)感染在非小细胞肺癌(NSCLC)发生中的病因学意义,分析HPV感染与P53和缺氧诱导因子-1α(HIF-1α)蛋白表达之间的关系。方法应用免疫组化法检测60例NSCLC及20例肺良性病变组织中P53、HIF-1α蛋白的表达,应用PCR方法选用HPV16、18型特异性引物检测两组中HPV DNA的表达。结果①HPV DNA检出率NSCLC组为41.7%,肺良性病变组5.0%,二者有显著差异(P<0.05)。②NSCLC中P53和HIF-1α的表达阳性率分别为43.3%和48.3%,肺良性病变组均未见阳性表达,差异均有统计学意义(P<0.05)。③NSCLC中P53的表达率与HIF-1α呈正相关(r=0.500,P<0.05)。④HPV DNA阳性组中P53的表达率为60.0%高于HPV DNA阴性组31.4%(P<0.05)。HPV DNA阳性组与阴性组间HIF-1α的阳性表达率分别为52.0%和45.7%,差异无统计学意义(P>0.05)。结论HPV感染可能是NSCLC发生的病因学因素之一,HPV感染降解野生型P53蛋白,诱导P53基因突变,从而促进肺癌发生发展。
关键词〔〕非小细胞肺癌;人乳头状瘤病毒;P53蛋白;缺氧诱导因子-1α
中图分类号〔〕R734.2〔
基金项目:秦皇岛市科学技术研究与发展计划项目(2012023A135)
1秦皇岛市第一医院科教科
第一作者:周颖(1981-),女,主治医师,硕士,主要从事肿瘤病理学研究。
人乳头状瘤病毒(HPV)是一种DNA病毒,感染人和动物的皮肤或黏膜可引起增殖性损伤。近年来,越来越多的国内外临床和实验室研究检测出肺癌患者携带HPV〔1,2〕,尤其是HPV 16、18型。但HPV感染与肺癌的关系,目前说法不一。P53为人类最常见的抑癌基因之一,在多种肿瘤中呈现高表达,其表达与肿瘤的发生发展相关。缺氧诱导因子(HIF)-1α是近年发现的一种转录因子,在肺癌、乳腺癌等多种肿瘤组织中过度表达。肿瘤细胞快速生长所造成的缺氧环境可诱导HIF-1α的表达,而HIF-1α又可调节其下游基因的表达而促进血管的形成和肿瘤的生长。然而肺癌中P53、HIF-1α与HPV感染的关系尚未见报道。本研究通过检测非小细胞肺癌(NSCLC)中HPV DNA、P53和HIF-1α蛋白的表达情况,探讨HPV感染在NSCLC发生中的病因学意义。
1材料与方法
1.1标本收集秦皇岛市第一医院2012年1~5月NSCLC新鲜标本60例,男46例,女14例;年龄36~80岁;鳞癌42例,腺癌18例;高分化12例,中分化29例,低分化19例;淋巴结转移30例,无淋巴结转移30例;吸烟者43例,不吸烟者17例。20例肺良性病变组织,其中包括肺结核6例,炎性假瘤5例,硬化性血管瘤4例,肺大疱4例,支气管扩张1例。标本取材后,部分置-20℃保存,部分中性甲醛溶液固定,石蜡包埋。
1.2HPV PCR检测
1.2.1引物选用分别用来扩增HPV16、18型的特异性引物2对。引物均由北京奥科生物公司合成。引物序列如表1。

表1 引物序列和产物长度
1.2.2组织DNA的提取取适量冻存组织,加提取缓冲液制成单细胞悬液后,沸水浴10 min,冷却至室温加蛋白酶K消化,酚-氯仿-异戊醇反复抽提3次,再经100%冰冷无水乙醇沉淀、70%冰冷无水乙醇洗涤后,加TE(10 mmol/L Tris-HCl,1 mmol/L EDTA,pH8.0)缓冲液溶解所得DNA并4℃保存。
1.2.3PCR扩增反应PCR反应体系:每25 μl反应体系中包含 10倍缓冲液2.5 μl,20 pmol/μl引物各0.5 μl,Taq酶1 μl(1 U/μl),Mg2+1.5 μl,dNTPs 0.5 μl,去离子水16.5 μl及DNA模板2 μl。扩增条件:94℃预变性5 min,循环特征为94℃ 45 s,55℃ 45 s,72℃ 45 s,共30个循环,72℃延伸8 min。每次实验以不加模板为阴性对照,HPV16、18型分别用Siha和Hela细胞株DNA作阳性对照。PCR扩增产物用加有溴乙啶的1.5%琼脂糖凝胶,80 V电压下电泳约40 min,于紫外透射仪上观察结果。
1.3P53、HIF-1α免疫组化检测
1.3.1试剂与方法P53抗体、HIF-1α抗体及通用型SP试剂盒购自福州迈新生物技术开发公司,染色步骤按试剂盒说明书操作。一抗稀释浓度为1∶100。阴性对照用PBS代替一抗。
1.3.2判断标准HIF-1α和P53阳性表达均为细胞核出现棕黄或棕褐色颗粒,显色结果由两位病理医生采用半定量评分系统独立判定。每例均高倍镜下(×400)随机选择5个视野,每个视野计数200个细胞,取平均值,用半定量积分法判断结果:0分阴性;1分<25%;2分25%~75%;3分>75%。阳性强度:1分弱表达(浅黄色);2分中等强度表达(棕黄色);3分强表达(棕褐色)。两者积分相乘,0~1分为阴性(-),2~3分为弱阳性(±),4~6分为中等阳性(+),7~9分为强阳性()。就其结果进行分析,将-、±合并为“-”,+、合并为“+”,以简化数据处理。
1.4统计学分析采用SPSS12.0软件进行χ2检验及相关性分析。
2结果
2.1HPV DNA的PCR检测结果及其与临床病理特征的关系HPV DNA检出率NSCLC组为41.7%(25/60),肺良性病变组5.0%(1/20),二者有显著差异(χ2=9.193,P<0.05)(图1);HPV16、18型特异性引物分型检测,HPV16检出率为48.0%(12/25),HPV 18检出率为52.0%(13/25)。NSCLC组HPV感染与性别、年龄、组织学分型、吸烟无关,与组织分化程度及淋巴结转移相关。见表2。

M:Marker;1、2:HPV16 阳性、阴性对照;3、4:HPV16;5、6:HPV18 阳性、阴性对照;7、8:HPV18 图1 PCR检测HPV16、18型DNA扩增结果电泳图
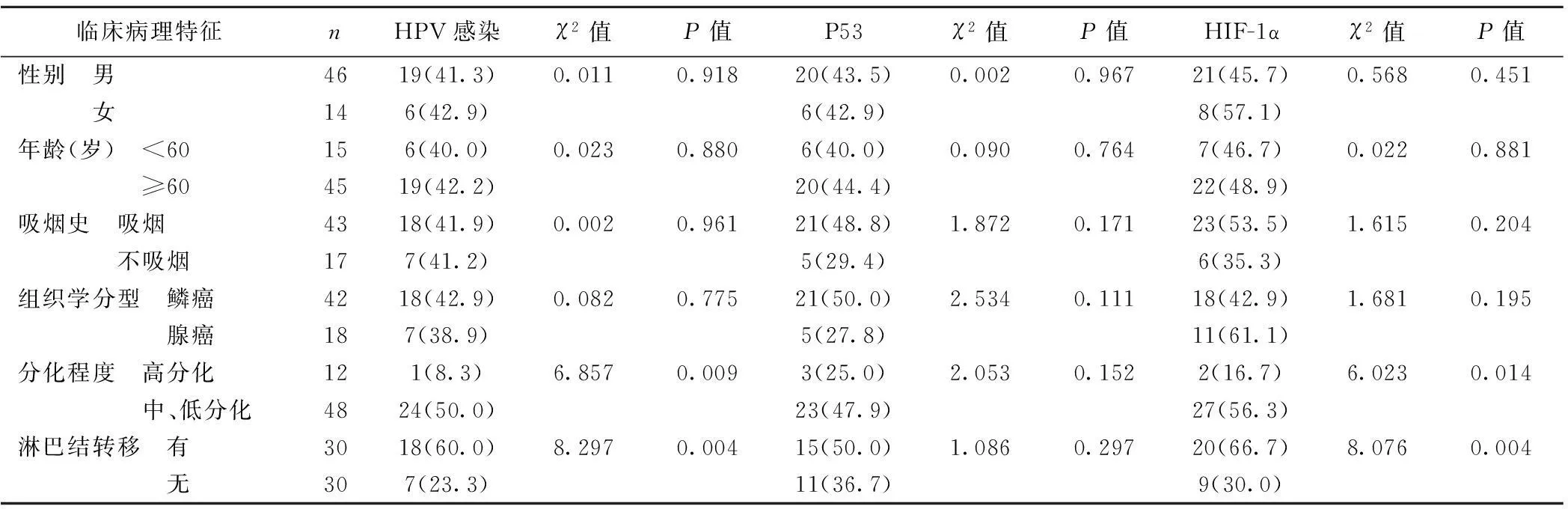
临床病理特征nHPV感染χ2值P值P53χ2值P值HIF-1αχ2值P值性别 男4619(41.3)0.0110.91820(43.5)0.0020.96721(45.7)0.5680.451 女146(42.9)6(42.9)8(57.1)年龄(岁) <60156(40.0)0.0230.8806(40.0)0.0900.7647(46.7)0.0220.881 ≥604519(42.2)20(44.4)22(48.9)吸烟史 吸烟4318(41.9)0.0020.96121(48.8)1.8720.17123(53.5)1.6150.204 不吸烟177(41.2)5(29.4)6(35.3)组织学分型 鳞癌4218(42.9)0.0820.77521(50.0)2.5340.11118(42.9)1.6810.195 腺癌187(38.9)5(27.8)11(61.1)分化程度 高分化121(8.3)6.8570.0093(25.0)2.0530.1522(16.7)6.0230.014 中、低分化4824(50.0)23(47.9)27(56.3)淋巴结转移 有3018(60.0)8.2970.00415(50.0)1.0860.29720(66.7)8.0760.004 无307(23.3)11(36.7)9(30.0)
2.2P53、HIF-1α的检测结果及两者的相关性NSCLC中P53的阳性表达位于细胞核(图2),阳性率为43.3%(26/60),肺良性病变组未见阳性表达,差异有统计学意义(χ2=12.840,P<0.05)。HIF-1α的阳性表达也位于细胞核(图2),阳性率为48.3%(29/60),肺良性病变组未见阳性表达,差异有统计学意义(χ2=15.163,P<0.05)。P53阳性组中HIF-1α的表达率76.9%(20/26),明显高于P53阴性组26.5%(9/34),经统计学分析,两者呈正相关(r=0.500,P<0.05)。
2.3P53、HIF-1α蛋白表达与临床病理特征的关系NSCLC组中P53表达与性别、年龄、吸烟、组织学分型、组织分化程度、淋巴结转移均无关(P>0.05)。HIF-1α表达与性别、年龄、吸烟、组织学分型无关,与组织分化程度及淋巴结转移相关,见表2。

P53

HIF-1α
2.4HPV感染与P53、HIF-1α表达的关系HPV DNA阳性组中P53的表达率为60.0%(15/25)高于HPV DNA阴性组31.4%(11/35)(P<0.05)。HPV DNA阳性组与阴性组间HIF-1α的阳性表达率分别为52.0%(13/25)和45.7%(16/35),差异无统计学意义(P>0.05)。
3讨论
HPV感染是宫颈癌的主要病因,然而近年来HPV感染与肺癌的关系已经引起人们的重视〔3〕。本研究提示HPV感染可能是NSCLC发生的病因学因素之一。HPV感染与NSCLC患者临床病理资料的关系目前尚未明确,本研究发现HPV感染与性别、年龄、吸烟、组织学分型无关,与组织分化程度、淋巴结转移相关。高分化型NSCLC HPV DNA的检出率低于中、低分化型,可能是由于分化成熟的细胞退出了细胞周期,细胞不再具有分裂能力,细胞内仅有少量病毒复制所需的复制酶。淋巴结转移组HPV DNA的检出率高于无淋巴结转移组。Lane等〔4〕报道HPV阳性的肿瘤细胞株与HPV阴性的相比VEGF的表达水平普遍升高。Lopezocejo等〔5〕认为HPV E6可能如一些原癌基因一样能够使VEGF表达增强。VEGF不仅诱导血管生成,还可诱导肿瘤外周形成新的淋巴管,促进癌细胞通过淋巴管转移到淋巴结。由此推测HPV感染与淋巴结转移可能存在一定的相关性。
抑癌基因P53是恶性肿瘤中突变率最高的基因。野生型P53半衰期短,不易被检测到,突变型P53半衰期长达7 h,在细胞内堆积易被检测到,但失去了对细胞增殖的负调节作用,因而促进细胞过度增生和癌变,容易通过免疫组化方法检测。故本研究中采用免疫组化法所测得的均属于突变型P53蛋白〔6〕。有研究显示HPV16、18型E6可以降解野生型P53蛋白,导致上皮细胞的增殖分化失控,引起肿瘤的发生〔7〕。本研究提示NSCLC中HPV感染与P53基因突变密切相关。HPV16、18型E6通过降解野生型P53蛋白,使其失去对细胞DNA的监视作用,最终使得P53基因突变得以复制和积累〔8〕。HPV感染诱导P53基因突变可能成为NSCLC多步骤进程中的起始环节。
HIF-1是由α、β亚单位构成的异二聚体,其中HIF-1α受缺氧的调节。缺氧是实体肿瘤微环境特征之一。在细胞缺氧时,细胞核中HIF-1α显著增加。HIF-1α不仅调节众多的下游基因以维持或促进肿瘤的血管形成和肿瘤的发展,而且可反馈接受肿瘤生长过程中产生的因子或缺氧环境上调表达,如此形成恶性循环促进肿瘤生长、浸润和转移〔9〕。本研究结果提示HIF-1α在NSCLC的发生发展中起重要作用。Ravir等〔10〕认为,野生型P53蛋白可通过直接抑制HIF-1α转录活性和通过促进mdm2介导的HIF-1α泛素化-蛋白酶降解两种形式抑制HIF-1α活性。在P53缺失或突变的肿瘤细胞内,HIF-1α明显积聚。本研究结果支持这一观点。HIF-1α与HPV感染之间的关系,国内外研究较少,其可能的联系有:HPV16、18型E6可以通过降解野生型P53蛋白,并诱导P53基因突变,从而促进HIF-1α的积聚。本研究发现HPV DNA阳性组HIF-1α的表达率稍高于阴性组,可能由于HPV通过P53对HIF-1α的影响是有限的,两者的关系有待今后进一步的深入研究。本研究结果还显示,HIF-1α的表达与组织分化程度、淋巴结转移有关,与Swinson等〔11〕的结果基本一致。高分化型HIF-1α的表达率低于中、低分化型,推测肿瘤分化程度降低,缺氧程度明显加重,HIF-1α表达上调,通过与缺氧反应元件作用便利于肿瘤克服缺氧并诱导新生血管形成,浸润生长。淋巴结转移组HIF-1α的表达率高于无淋巴结转移组。有研究报道HIF-1α通过调节其下游基因VEGF诱导肿瘤新生淋巴管形成;同时上调COX-2,促使癌细胞对基质的粘附性增加,E-cadherin蛋白水平下降,使癌细胞易于转移,提示HIF-1α是NSCLC发生发展中的关键步骤,并参与肿瘤的侵袭和转移。
综上所述,HPV感染可能是NSCLC发生的病因学因素之一,HPV感染降解野生型P53蛋白,诱导P53基因突变,从而促进肺癌发生发展。HIF-1α不但在NSCLC发生发展中起重要作用,还参与肿瘤的侵袭和转移。因此选用HPV疫苗预防高危HPV感染,采用药物或应用RNA干扰技术抑制HIF-1α基因表达有可能成为肺癌预防和治疗的新方向。
4参考文献
1Syrjanen KJ.HPV infection and lung cancer〔J〕.J Clin Pathol,2002;5(12):885-91.
2Wang Y,Wang A,Jiang R,etal.Human papillomavirus type 16 and 18 infection is associated with lung cancer patients from the central part of China〔J〕.Oncol Res,2008;20(2):333-9.
3Zafer E,Ergun M,Alver G,etal.Detection and typing of human papillomavirus in non-small cell cancer〔J〕.Respiration,2004;71(1):88-90.
4Lane D,Gray EA,Mathur RS,etal.Up-regulation of vascular endothelial growth factor-C by nicotine in cervical cancer cell lines〔J〕.Am J Reprod Immunol,2005;53(3):153-8.
5Lopezocejo O,Viloriapetit A,Bequetromero M,etal.Oncogenes and tumor angiogenesis:the HPV-16 E6 oncoprotein activates the vascular endothelial growth factor(VEGF)gene promoter in a p53 independent manner〔J〕.Oncogene,2000;19(40):4611-20.
6张骏.肺癌P53蛋白表达和基因突变与临床病理的相关研究〔J〕.中华病理学杂志,1998;27(4):286-9.
7Brachman DG.Occurrence to p53 gene deletions and human papillomavirus infection in human head and neck cancer〔J〕.Cancer Res,1992;52(7):832-6.
8Kuscu E,Ozdemir BH,Erkanli S,etal.HPV and P53 expression in epithelial ovarian carcinoma〔J〕.Eur J Gynaecol Oncol,2005;26(6):642-5.
9Jubb A,Hillan K.Expression of HIF-1 alpha in human tumours〔J〕.J Clin Pathol,2005;58(3):335-6.
10Ravir D,Mookerjee B,Bhujwalla ZM,etal.Regulation of tumor angiogenesis by P53-induced degradation of hypoxia inducible factor-1 alpha〔J〕.Genes Dev,2000;14(1):24-44.
11Swinson DE,Jones JL,Cox G,etal.Hypoxia-inducible factor-1 alpha in non small cell lung cancer:relation to growth factor,protease and apoptosis pathways〔J〕.Int J Cancer,2004;111:43.
〔2013-11-17修回〕
(编辑赵慧玲/曹梦园)

