核酸适配体修饰的纳米脂质体的制备及靶向毒性研究
(苏州百拓生物技术服务有限公司,江苏苏州215123)
近年来,癌症的靶向治疗显示了巨大的应用前景。靶向治疗分为被动靶向和主动靶向,被动靶向主要是利用肿瘤新生血管通透性比普通血管高,纳米载体容易从这些部位渗漏到肿瘤部位,从而实现肿瘤部位的药物富集作用;主动靶向是在纳米载体的表面修饰一段能特异识别肿瘤细胞的抗体、肽、小分子等,使药物载体能特异识别并杀伤癌细胞[1]。脂质体是所有载体中应用最成功的,而且许多抗癌小分子脂质体药物(如吉西他滨、阿霉素、紫杉醇、顺铂、喜树碱等)已经实现了商业化[2],但还存在着在体液环境中不稳定、药物未到达肿瘤部位就突然释放、肿瘤部位药物富集量少等缺点。为此,需要对脂质体进行进一步的修饰,抗体、肽、小分子等可作为细胞靶向识别配体修饰在脂质体上,以提高药物载体的特异识别能力。抗体通常对配体有很高的亲和力,但会引起很强的免疫反应;肽合成容易,不会引起很强的免疫反应,但易被体内的酶降解[3];叶酸、乳糖酸等小分子虽然价格便宜,体内也稳定,但没有很强的靶向性[4-6]。聚乙二醇修饰能大大延长脂质体的血液循环时间、避免内皮系统的清除作用、提高药物在肿瘤部位的富集[7]。
适配体(aptamer)因独特的生物学特性已成为靶向治疗的热点。核酸适配体是短的DNA 或RNA 片段,一般由12~30个碱基构成,能特异识别目标分子,而且合成容易、修饰简单、储存和运输方便,在癌症诊疗中显示了巨大的应用前景,越来越多的研究用核酸适配体修饰脂质体,以进一步提高脂质体的治疗效果[8-12]。美国FDA 已于2004年批准了针对血管内皮生长因子(vascular endothelial growth factor,VEGF)的核酸适配体Pegaptanib用于老年眼睛黄斑病变的治疗[13]。核酸适配体AS1411是一段26个核苷酸的单链DNA 片段,富含鸟嘌呤,具有非常紧凑的结构和独特的生物学特性,能抵抗血液核酸酶的降解,能以很高的亲和力结合在癌细胞表面高表达核素蛋白(nucleolin),是第一个FDA 批准用于各种癌症临床治疗试验的适配体,Antisoma公司已完成了肾癌和急性髓性白血病(acute myeloid leukemia,AmL)的二期(phaseⅡa)临床研究,取得了不错的临床效果,现正等待审批进行下一期(phaseⅡb)临床研究[14-15]。
鉴于此,作者利用DSPE-PEG2000和核酸适配体修饰的DSPE-PEG5000(DSPE-PEG5000-Aptamer)自组装构建靶向载药体系(纳米脂质体),使修饰的核酸适配体充分暴露在载体表面,发挥识别细胞受体的作用,从而提高靶向性;并用乳腺癌细胞MCF-7(表面高表达核素蛋白)[16]检测该载药体系的靶向毒性。
1 实验
1.1 材料与仪器
DSPE-PEG2000(Mw2 700Da)、DSPE-PEG5000-COOH(Mw5 700Da),NanocsInc;1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),Sigma-Aldrich;核酸适配体AS1411(100 μmol·mL-1),序列为FAM-5′-(GGTGGTGGTGGTTGTGGTGGTGGTGG)-3′-NH2,5′端进行了FAM 荧光基团修饰,3′端进行了氨基修饰,由上海生工生物工程股份有限公司合成;盐酸阿霉素(DOX,Mw579Da),上海生工生物工程股份有限公司;人乳腺癌细胞MCF-7、非洲绿猴肾细胞Vero,自行保存;1640培养基、小牛血清,Gibco。
透析袋,Spectrum;WST 细胞增殖及细胞毒性检测试剂盒,碧云天;流式检测凋亡试剂盒Annexin-VFLUOS,Roche;旋转蒸发仪,上海申胜;探头式超声仪,宁波新芝;动态光散射仪,Malvern;荧光显微镜,Leica;FC-500型流式细胞仪,Beckman Coulter。
1.2 DSPE-PEG5000-Aptamer的合成
DSPE-PEG5000-COOH 通过EDC 交联,与核酸适配体AS1411反应,通过氨基和羧基形成酰胺键,从而把AS1411交联到DSPE-PEG5000-COOH 上,形成DSPE-PEG5000-Aptamer。合成路线如图1所示。

图1 DSPE-PEG5000-Aptamer的合成路线Fig.1 Synthetic route of DSPE-PEG5000-Aptamer
具体过程:按DSPE-PEG5000-COOH∶AS1411∶EDC∶NHS=1∶1∶5∶1(物质的量比,下同)的比例取11.4 mg(2 μmol·L-1)的DSPE-PEG5000-COOH 溶于10mL PBS溶液(pH 值7.4,50mmol·L-1)中,加入10μmol·L-1的EDC,磁力搅拌0.5h,然后加入2μmol·L-1的NHS和AS1411,25 ℃反应16h后将反应物装入透析袋(截留分子量10 000)透析24h,除去未反应的物质,即得DSPE-PEG5000-Aptamer。将合成的 DSPE-PEG5000-Aptamer 用15%的聚丙烯酰胺凝胶电泳(PAGE)检测,上样量15 μL,再用凝胶成像系统(Bio-Rad)检测。
1.3 纳米脂质体载药体系的构建
先用10mL氯仿溶解54 mg(20μmol·L-1)的DSPE-PEG2000,抽真空状态下55 ℃旋转蒸发4h,使其在瓶壁上形成脂膜;然后按DSPE-PEG2000∶DSPE-PEG5000-Aptamer∶盐酸阿霉素=20∶1∶4的比例取5 mL PBS 溶液溶解的DSPE-PEG5000-Aptamer(0.2μmol·L-1),加入2.4 mg(4μmol·L-1)盐酸阿霉素,充分混匀后加入已成干膜的旋转蒸发瓶中;维持真空0.05MPa、温度55℃、转速180r·min-1旋转蒸发2h,使脂膜完全溶解在PBS溶液中,形成微红的乳液;乳液用超声仪冰浴超声(功率200 W,探头直径2mm,超声5s,间隔20s,共超声10次)后用250nm 的滤膜过滤,即得纳米脂质体。合成路线如图2所示。

图2 纳米脂质体载药体系的构建及细胞靶向识别示意图Fig.2 Construction of liposome nanocarrier target drug delivery system and scheme of targeted cells recognization
由于DSPE-PEG5000的分子量大,组装完成后可以使Aptamer充分暴露在载体表面,有利于和细胞表面的受体结合,通过受体介导的方式进入细胞而发挥药效。
用动态光散射仪检测纳米脂质体粒径分布。产物进行透析,收集透析液,按下式计算包封率:

1.4 载药体系对乳腺癌细胞MCF-7的靶向毒性
用MCF-7细胞检测载药体系的靶向毒性,以非洲绿猴肾细胞Vero为对照。将细胞培养于96孔板中,待细胞长满培养板70%左右,用PBS 溶液洗细胞3次,然后每孔加入无血清培养基100μL,培养2h,设计5个浓度梯度,每个浓度设3个重复孔。用于毒性实验的细胞孔先吸出10μL、15μL、20μL、25μL 和50μL的培养液,再分别加入10μL、15μL、20μL、25 μL和50μL的药物,使培养基的终体积为100μL,继续培养4h。每孔加入10μL WST 溶液,37 ℃孵育2h,测定450nm 处吸光度。
荧光显微镜检测载药体系进入细胞的情况:细胞培养于24孔板中,待细胞长满培养板70%左右,吸出培养基,用PBS 溶液洗3 次,加入0.5 mL 新鲜的1640培养基,培养2h,加入20μL药物孵育4h,用荧光显微镜观察。
流式细胞仪检测细胞的凋亡情况:待培养于6孔板的细胞长满培养板70%左右,加入40μL 药物孵育4h,PBS溶液洗3次,胰酶消化,用1.5mL PBS溶液重悬,2 000r·min-1离心3min,用1mL PBS溶液重悬细胞,使细胞浓度为1.5×106个·mL-1,加入5μL的Annexin-V-FLUOS和5μL 的PI染色液,孵育20 min,用流式细胞仪检测。
2 结果与讨论
2.1 DSPE-PEG5000-Aptamer的电泳图谱
由于Aptamer上带有FAM 基团,紫外照射下能发黄绿色的光。因此,用15%PAGE 对DSPEPEG5000-Aptamer进行电泳检测,结果见图3。
由图3可看出,由于Aptamer的交联,使DSPEPEG5000在凝胶中迁移受到阻滞(泳道1),而游离的Aptamer在凝胶中迁移较快(泳道2)。表明Aptamer成功交联到了DSPE-PEG5000上。
2.2 纳米脂质体的粒径分布及包封率
用动态光散射仪检测纳米脂质体的粒径分布,结果见图4。
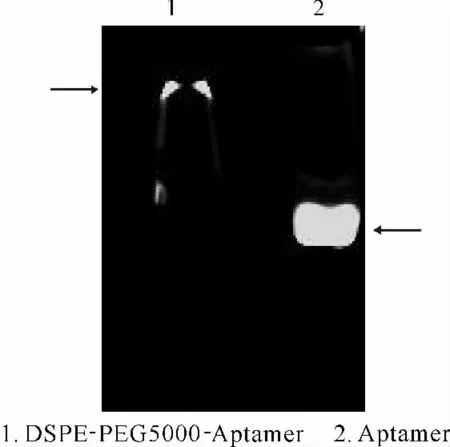
图3 DSPE-PEG5000-Aptamer的电泳图谱Fig.3 Electrophorogram of DSPE-PEG5000-Aptamer
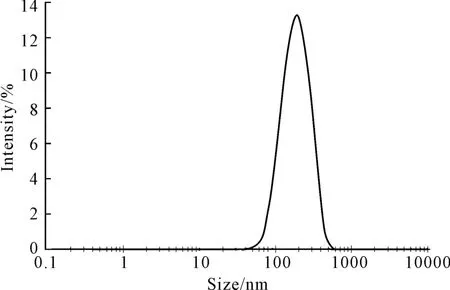
图4 纳米脂质体的粒径分布Fig.4 Particalsize distribution of liposome nanocarrier
由图4 可看出,纳米脂质体的平均粒径为130 nm。
以盐酸阿霉素浓度(c)为横坐标、OD550(A)为纵坐标绘制标准曲线(图5),拟合得到标准曲线方程:A=0.01337c+0.0014,R2=0.99964。

图5 盐酸阿霉素的标准曲线Fig.5 Standard curve of doxorubicin hydrochloride
将纳米脂质体用透析袋透析后,收集透析液,测得550nm(盐酸阿霉素的最大吸收波长)处吸光度为0.095,由标准曲线方程得盐酸阿霉素浓度为7μg·mL-1,即透析液体系(100 mL)的盐酸阿霉素含量为700μg(0.7mg),据此计算包封率为70.8%。进一步算得载药体系中盐酸阿霉素的浓度为0.34 mg·mL-1。
2.3 载药体系进入细胞的情况(图6)

图6 载药体系在乳腺癌细胞MCF-7(a、b)及正常细胞Vero(c、d)中的荧光显微照片Fig.6 Fluorescence microscopy of drug delivery system in breast cancer cell MCF-7(a,b)and normal cell Vero(c,d)
由图6可看出,在乳腺癌细胞MCF-7(图6a、b)中有较强的黄绿荧光(FAM)和红色荧光(DOX),而在正常细胞Vero(图6c、d)中只能见到微弱的荧光,说明构建的载药体系对癌细胞有较强的靶向选择性。
2.4 细胞的凋亡情况
凋亡试剂Annexin-V-FLUOS主要针对细胞膜的磷脂酰丝氨酸(phosphatidylserine,PS),PS在细胞死亡和凋亡时从膜内外翻到膜外,与Annexin-V-FLUOS结合后发绿光,流式检测时为FL1绿光通道(激发波长488nm,发射波长533nm);PI不能通过正常和早期凋亡的细胞膜,但是晚期和死亡的细胞由于膜受体破坏,PI能通过膜并与细胞核结合,发出红光,流式检测时为FL2红光通道(激发波长535nm,发射波长615nm)。
细胞经药物和凋亡试剂盒处理后,进行流式检测,结果见图7。
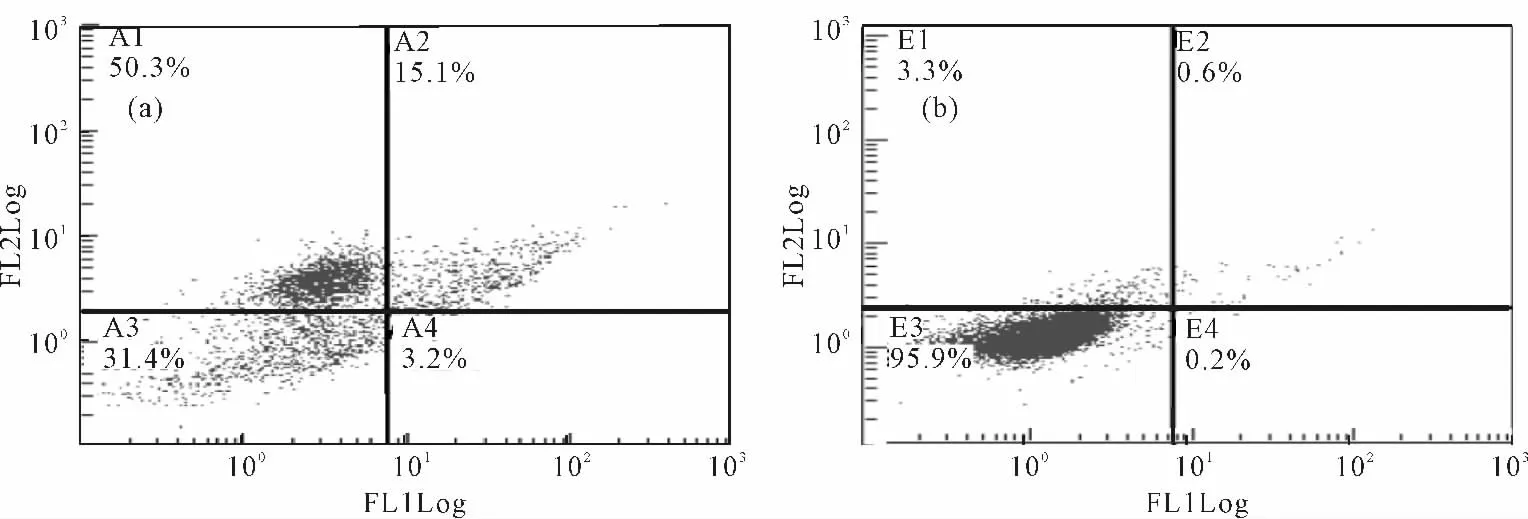
图7 乳腺癌细胞MCF-7(a)和正常细胞Vero(b)的凋亡情况Fig.7 Apoptosis of breast cancer cell MCF-7(a)and normal cell Vero(b)
由图7 可知,Vero 细胞经过药物处理4h 后,95.9%的细胞处于正常细胞象限E3,而乳腺癌细胞MCF-7的正常细胞降低到31.4%(A3象限),死亡细胞(A1 象限)为50.3%,死亡和凋亡的细胞(A2)为15.1%。
2.5 药物的细胞毒性
用WST 检测药物对乳腺癌细胞MCF-7 和正常细胞Vero的毒性,结果见图8。
由图8可知,药物对Vero细胞活性的影响较小,随着药物浓度的增加,细胞活性下降得比较缓慢;药物对MCF-7细胞活性影响较大,当药物浓度从6.8μg·mL-1(20μL)增加到8.5μg·mL-1(25μL)时,细胞活性急剧下降;当药物浓度继续增加到17μg·mL-1(50μL)时,细胞活性没有继续下降。表明8.5 μg·mL-1的盐酸阿霉素可以使一个6孔板的细胞(约1.5×106个)发生凋亡。
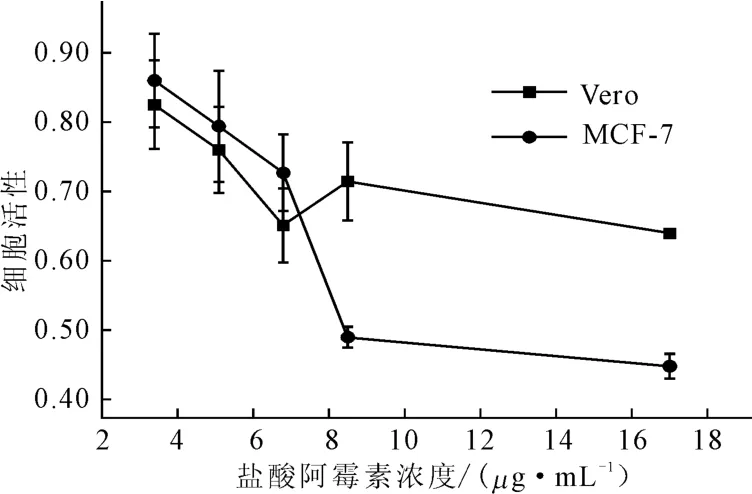
图8 药物对乳腺癌细胞MCF-7和正常细胞Vero的毒性Fig.8 Drug cytotoxicity on breast cancer cell MCF-7and normal cell Vero
3 结论
通过核酸适配体修饰,利用聚乙二醇化的DSPE自组装构建了纳米脂质体靶向载药体系,并进行了载药体系的靶向毒性研究,纳米脂质体的平均粒径为130nm,对盐酸阿霉素药物的包封率为70.8%。组装材料中DSPE-PEG5000的PEG 链比DSPE-PEG2000的长,可以使适配体充分暴露在载体表面,利于和癌细胞结合。载体具有体内被动靶向作用,即可以通过血液循环渗漏进入细胞间隙比较大的肿瘤新生血管,从而提高药物在肿瘤组织的富集浓度。另外,适配体的修饰进一步提高了载体对乳腺癌细胞的主动靶向性,提高了载体进入乳腺癌细胞的能力。研究表明,构建的载药体系对乳腺癌细胞MCF-7具有较好的靶向性,所使用的DSPE是FDA 已批准进入临床的材料,可以加快临床研究的转化,为开发乳腺癌的临床靶向治疗药物奠定了基础。
[1]SVENSON S.Clinical translation of nanomedicines[J].Current Opinion in Solid State and Materials Science,2012,16(6):287-294.
[2]WAGNER A,PLATZGUMMER M,KREISMAYR G,et al.GMP Production of liposomes-A new industrial approach[J].Journal of Liposome Research,2006,16(3):311-319.
[3]JIN E L,ZHANG B,SUN X R,et al.Acid-active cell-penetrating peptides forinvivotumor-targeted drug delivery[J].J Am Chem Soc,2013,135(2):933-940.
[4]GUO W J,LEE T,SUDIMACK J,et al.Receptor-specific delivery of liposomesviafolate-PEG-chol[J].Journal of Liposome Research,2000,10(2-3):179-195.
[5]ZHAO X,LI H,LEE R J.Targeted drug deliveryviafolate receptors[J].Expert Opin Drug Deliv,2008,5(3):309-319.
[6]LU Y J,LOW P S.Folate-mediated delivery of macromolecular anticancer therapeutic agents[J].Advanced Drug Delivery Reviews,2002,54(5):675-693.
[7]MURA S,BUI D T,COUVREUR P,et al.Lipid prodrug nanocar-riers in cancer therapy[J].Journal of Controlled Release,2015,208:25-41.
[8]XING H,TANG L,YANG X,et al.Selective delivery of an anticancer drug with aptamer-functionalized liposomes to breast cancer cellsinvitroandinvivo[J].J Mater Chem B.Mater Biol Med,2013,1(39):5288-5297.
[9]LI L,HOU J,LIU X,et al.Nucleolin-targeting liposomes guided by aptamer AS1411for the delivery of siRNA for the treatment of malignant melanomas[J].Biomaterials,2014,35(12):3840-3850.
[10]CAO Z,TONG R,MISHRA A,et al.Reversible cell-specific drug delivery with aptamer-functionalized liposomes[J].Angew Chem Int Ed,2009,48(35):6494-6498.
[11]KANG H,O′DONGOGHUE M B,LIU H,et al.A liposomebased nanostructure for aptamer directed delivery[J].Chem Commun,2010,46(2):249-251.
[12]ZHOU J H,ROSSI J J.Cell-specific aptamer-mediated targeted drug delivery[J].Oligonucleotides,2011,21(1):1-10.
[13]SUNDAEAM P,KURNIAWAN H,BYRNE M,et al.Therapeutic RNA aptamers in clinical trials[J].European Journal of Pharmaceutical Sciences,2013,48(1-2):259-271.
[14]RIZZIERI D,STOCKERL-GOLDSTEIN A,WEI A,et al.Longterm outcomes of responders in a randomized,controlled phaseⅡtrial of aptamer AS1411in AmL[R].American Society of Clinical Oncology,2010,28:6557.
[15]ROSENBERG J E,DRABKIN H A,LARA P,et al.A phaseⅡ,single-arm study of AS1411in metastatic renal cell carcinoma(RCC)[R].American Society of Clinical Oncology,2010,28:4590.
[16]SOUNDARARGJAN S,CHEN W,SPICER E K,et al.The nucleolin targeting aptamer AS1411destabilizes Bcl-2 messenger RNA in human breast cancer cells[J].Cancer Research,2008,68(7):2358-2365.

