灵菌红素分批发酵过程的溶氧和补料调控
(武汉工程大学化工与制药学院绿色化工过程省部共建教育部重点实验室,湖北武汉430074)
灵菌红素(prodigiosin,PG)是一类由细菌(如粘质沙雷氏菌属[1]、假单胞菌属[2])和放线菌(如链霉菌属[3])等微生物通过次级代谢途径产生的天然红色素,具有由3 个吡咯环组成的甲氧基吡咯骨架结构[4]。PG 已被证实具备多种生物活性,如抗菌、抗疟疾、抗原生动物、浸润转移抑制活性、免疫抑制和抗肿瘤活性等[4-9]。PG 最引人关注的是其引起癌细胞凋亡的作用机制完全不同于当前的临床抗癌药物,在一定浓度范围内,PG 可以选择性作用于癌细胞,而对正常细胞毒性较小,是很有开发潜力的抗肿瘤药物[10-12]。粘质沙雷氏菌是PG 最主要的产生菌[13],天然PG 由于产量低而价格昂贵。目前国内对PG 发酵过程的研究主要针对摇瓶培养过程,而对发酵罐发酵过程研究甚少。
溶氧(dissolved oxygen,DO)对好氧微生物来说既是重要的营养成分,又是环境因素,溶氧很大程度上影响着细菌生长和产物的代谢[14]。根据微生物的生长特性,发酵周期可分为调整期、对数期、稳定期和衰亡期。次级代谢产物一般在稳定期大量合成,流加补料延长稳定期可以提高产物产量[15]。
作者在此以粘质沙雷氏菌ZSG 为受试菌株,对PG 分批发酵过程的溶氧和补料方式进行调控,研究恒溶氧控制下的PG 发酵过程,确定高产PG 分批发酵过程的最佳溶氧浓度;将溶氧浓度恒定在30%,通过流加补料并维持最适发酵pH 值,以期进一步提高PG 产量,为工业化高产PG 提供帮助。
1 实验
1.1 菌株与培养基
粘质沙雷氏菌株ZSG,从糖化车间酸性土壤中筛选,保藏于中国典型培养物保藏中心(CCTCC No:M 209195)。
固体培养基:牛肉膏0.5%,蛋白胨1%,琼脂粉2%,NaCl 0.5%。
种子培养基:蔗糖0.5%,蛋白胨1.5%,NaCl 0.5%,MgCl20.25%,吐温-80 1.0%。
分批发酵过程培养基同种子培养基。
1.2 试剂与仪器
灵菌红素标准品,自行分离提纯;琼脂粉、牛肉膏、蛋白胨均为国产生化试剂;其它药品均为国产分析纯。
BIOSTAT A plus型生物反应器(德国贝朗5L发酵罐),赛多利斯;YXQ-LS-75S型立式压力蒸汽灭菌锅,上海博迅实业有限公司;SPX-250B-D 型恒温振荡培养箱,上海卓爵仪器设备有限公司;TG18M 型高速离心机;UV-1800 型紫外可见分光光度计,岛津;AIR TECH 型超净工作台;BS124S型分析天平。
1.3 方法
1.3.1 培养方法
将菌种活化后于固体培养基上划线,29 ℃培养24h后接种于装有50mL种子培养基的250mL锥形瓶中,于29℃、160r·min-1培养24h后,作为二级种子按10%的接种量接入发酵罐中。5L发酵罐中装液量为3L,通气量2.0vvm,培养温度29 ℃,初始搅拌转速200r·min-1,溶氧值用溶氧探头实时监控,手动调控转速维持恒定溶氧。
1.3.2 灵菌红素的提取与纯化
取粘质沙雷氏菌ZSG 的发酵液,10 000r·min-1离心20 min,去上清,沉淀用酸性甲醇(pH=3.0)溶解,超声20 min 破碎菌体,离心,收集上清液,30~35 ℃下减压蒸馏,浓缩液用乙酸乙酯溶解,4 ℃静置过夜后冰浴析出杂质。然后以体积比为5∶2的石油醚-丙酮为展开剂,通过薄层层析法分离出红色组分,即为PG 粗品。利用硅胶柱层析进一步纯化后减压富集,得到PG 样品,经高效液相色谱测得纯度高达98%,通过紫外分光光度计检测特征吸收峰值为534 nm。
1.3.3 菌体干重的测定
取发酵液20mL装入已知质量的50mL 离心管中,10 000r·min-1离心20min,用蒸馏水洗涤后再离心,重复2次,余下的湿菌体置于80 ℃烘箱中烘干至恒质量,测菌体干重(DCW)。再取3mL发酵液,蒸馏水洗涤菌体2次,生理盐水稀释菌体至30mL 后测600nm 处吸光度(OD600)。以菌体干重(x)为横坐标、OD600(y)为纵坐标绘制菌体干重标准曲线。
测菌体干重时,取发酵液测吸光度OD600,根据回归方程计算菌体干重。
1.3.4 灵菌红素产量的测定
准确称取纯化的PG 粉末10mg,用酸性甲醇(pH值3.0)溶解并定容至20mL,得到0.5mg·mL-1的色素母液。准确吸取色素母液0 mL、0.2 mL、0.4 mL、0.8mL、1.2mL、1.6mL、2.0mL,用酸性甲醇定容至10mL,测定534nm 处吸光度(OD534),以PG 浓度(x)为横坐标、OD534(y)为纵坐标绘制PG 标准曲线。
测PG 产量时,取1mL 发酵液,酸性甲醇定容至10mL,超声20 min破碎细胞,离心,收集上清液,测OD534,根据回归方程计算发酵液中PG 浓度。
2 结果与讨论
2.1 菌体干重标准曲线(图1)
由图1可看出,OD600在0.1~1.0范围内与菌体干重呈良好的线性关系,回归方程为:y=0.696x+0.007,R2=0.9961。
2.2 灵菌红素标准曲线(图2)
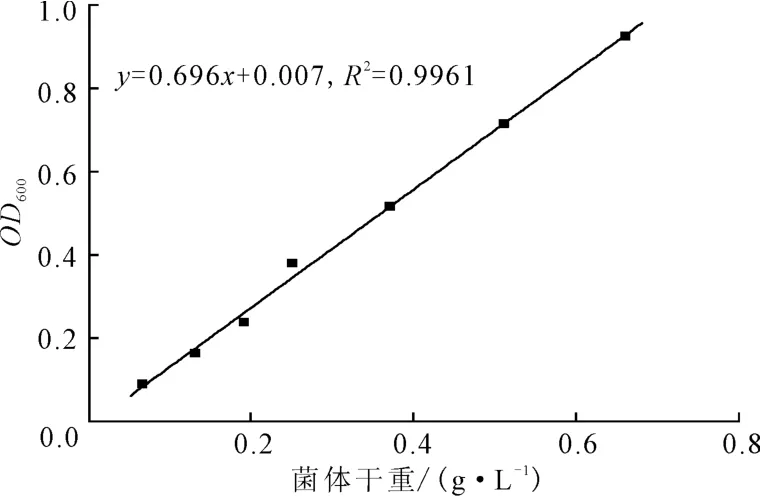
图1 菌体干重标准曲线Fig.1 The standard curve of DCW
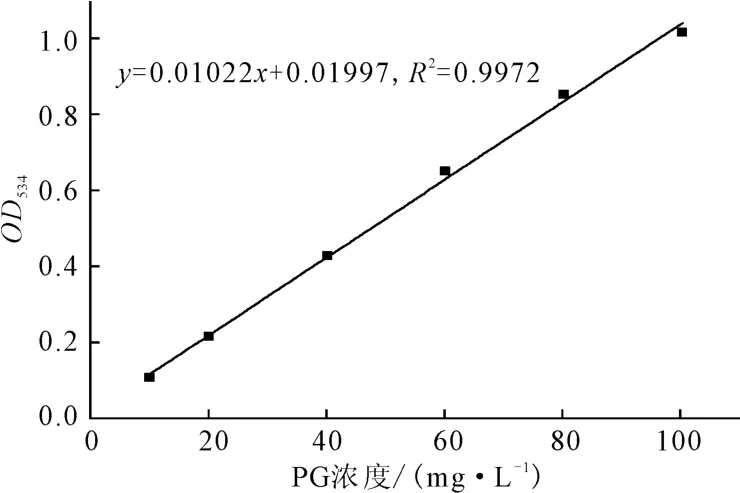
图2 灵菌红素标准曲线Fig.2 The standard curve of PG
由图2 可看出,OD534在0.1~1.0 范围内与PG浓度呈良好的线性关系,回归方程为:y=0.01022x+0.01997,R2=0.9972。
2.3 溶氧调控
粘质沙雷氏菌属于兼性厌氧菌,发酵过程中通入氧有利于生长代谢,但细胞生长和代谢的各个时期对氧的需求量是不同的,恒定转速的溶氧控制方式容易造成发酵各阶段溶氧浓度过高或过低,可能影响PG的产量。因此,有必要对发酵过程中的溶氧浓度进行调控,使PG 产量最大化。考察了恒定转速为200r·min-1以及恒定溶氧分别为10%、30%、50%等4种溶氧控制下的分批发酵过程,结果见图3。
由图3a可看出:0~2h处于调整期,2~24h属于对数期,24~54h是稳定期,54h之后进入衰亡期,表明该菌生长速度极快,生长周期较短;与恒定转速相比,恒定溶氧更有利于菌体生长,且溶氧浓度越高,生长速度越快,菌体干重越高。由图3b可看出:溶氧浓度为10%和30%时,PG 产量均比恒转速时高;溶氧浓度为50%时,PG 产量最低,表明溶氧在一定浓度范围内提高了PG 产量,但并不是溶氧浓度越高PG 产量越高。
以恒转速200r·min-1为对照组,分析不同溶氧控制下的发酵过程参数,如表1所示。
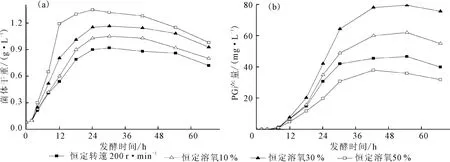
图3 不同溶氧控制下,菌体干重(a)和灵菌红素产量(b)与发酵时间的关系曲线Fig.3 Relationship curves of DCW(a)and PG production(b)with fermentation time under different DO controls
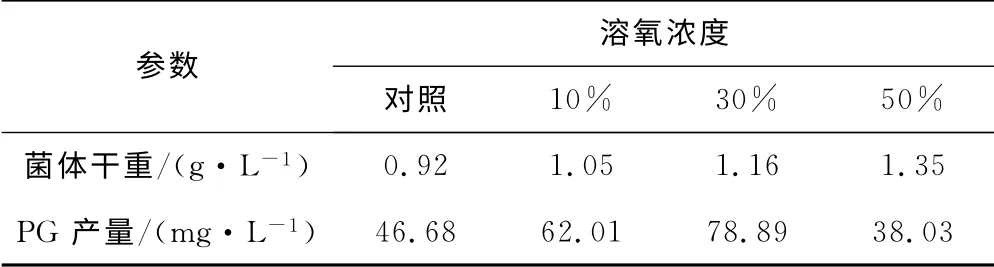
表1 不同溶氧控制下,灵菌红素的发酵过程参数比较Tab.1 Comparison of parameters for PG batch fermentation under different DO controls
由表1可知:溶氧浓度为10%和30%时,菌体干重和PG 产量有所提高,尤其是当溶氧浓度为30%时,PG 产量提高幅度最大,为69.0%;当溶氧浓度为50%时,菌体干重提高幅度最大,为46.7%,但PG 产量反而下降了18.5%。表明溶氧浓度过低或过高都可能导致PG 产量下降。因此,确定恒定溶氧浓度为30%,此时PG 产量可达到最高。
2.4 补料调控
确定PG 合成最适pH 值:由于PG 主要在18~42h内大量合成(图3b),而在此期间pH 值由6.5上升到7.8(表2),表明PG 的合成是一个碱性增强的过程,当pH 值超过7.8时,PG 合成缓慢,因此补料时pH 值应控制在6.7~7.8。

表2 30%溶氧控制下,pH 值随发酵时间的变化Tab.2 pH Value changes with fermentation time under 30% DO control
设计补料方案:45h时第一次流加0.5%的蔗糖和0.5%的吐温-80;90h进行第二次加倍补料。补料期间流加HCl维持发酵液pH 值在6.7~7.8,流加速度均控制在5mL·min-1,HCl浓度为3mol·L-1。
将发酵过程溶氧浓度控制在30%,在稳定期流加补料,并维持发酵液pH 值为6.7~7.8,考察不同补料方式下菌体干重和PG 产量与发酵时间的关系,结果见图4,发酵过程参数见表3。
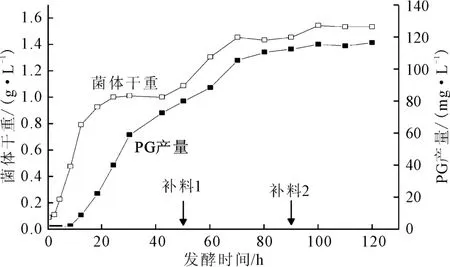
图4 不同补料方式下,菌体干重和灵菌红素产量与发酵时间的关系Fig.4 Relationship curves of DCW and PG production with fermentation time under different feeding modes
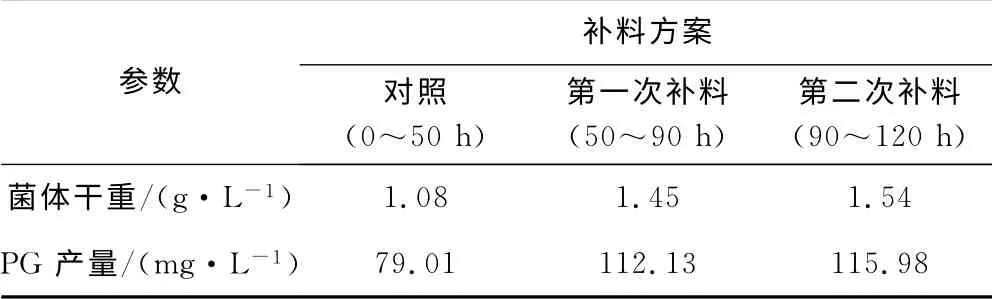
表3 不同补料方式下,灵菌红素的发酵过程参数比较Tab.3 Comparison of parameters for PG batch fermentation under different feeding modes
由图4可看出:在稳定期50h进行第一次补料后菌体出现了二次生长,PG 产量快速上升;90h时,PG合成再次停滞,此时进行第二次补料,菌体干重和PG产量未见明显上升。由表3也可以看到:第一次补料后,菌体干重和PG 产量分别增长了34.3%和41.9%,增长幅度较大,表明补料过程促进了菌体生长;第二次补料菌体干重和PG 产量分别只增长了6.2%和3.4%,PG 产量没有明显变化。这可能是培养体系中毒性物质累积太多或者是体系中较高浓度的PG 产生了产物抑制,也可能是补料浓度过高,产生了底物抑制,导致PG 合成能力下降。经过两次补料调控后,菌体干重从1.08g·L-1提高到1.54g·L-1,PG 产量从79.01mg·L-1提高到115.98mg·L-1,与未补料相比,菌体干重提高了42.6%,PG产量提高了46.8%。
3 结论
以粘质沙雷氏菌ZSG 为受试菌株,对灵菌红素分批发酵过程的溶氧和补料方式进行调控。分别以恒转速(200r·min-1)与恒溶氧(10%、30%、50%)方式控制灵菌红素分批发酵过程,结果表明,与恒转速相比,恒溶氧控制方式能明显提高菌体干重,且在一定浓度范围内促进了灵菌红素的合成,在溶氧浓度为30%时,灵菌红素产量可提高69.0%。将溶氧浓度恒定在30%、维持最适pH 值为6.7~7.8,通过流加补料可使灵菌红素产量从补料前的79.01 mg·L-1提高到115.98mg·L-1,提高了46.8%。
[1]GUTIERREZ-ROMAN M I,HOLGUIN-MELENDEZ F,BELLO-MENDOZA R,et al.Production of prodigiosin and chitinases by tropicalSerratiamarcescensstrains with potential to control plant pathogens[J].World Journal of Microbiology and Biotechnology,2012,28(1):145-153.
[2]SAKATA T,YOSHIKAWA T,NISHITARUMIZU S.Algicidal activity and identification of an algicidal substance produced by marinePseudomonassp.C55a-2[J].Fisheries Science,2011,77(3):397-402.
[3]EL-BONDKLY A M,EL-GENDY M M,BASSYOUNI R H.Overproduction and biological activity of prodigiosin-like pigments from recombinant fusant of endophytic marineStreptomycesspecies[J].Antonie Van Leeuwenhoek,2012,102(4):719-734.
[4]MONTANER B,PEREZ-TOMAS R.The prodigiosins:A new family of anticancer drugs[J].Current Cancer Drug Targets,2003,3(1):57-65.
[5]刘同军,杨海龙,唐华.灵菌红素的研究进展[J].食品与药品,2007,9(8):47-51.
[6]SURYAWANSHI R K,PATIL C D,BORASE H P,et al.Studies on production and biological potential of prodigiosin bySerratia marcescens[J].Applied Biochemistry and Biotechnology,2014,173(5):1209-1221.
[7]MANSSON M,GRAM L,LARSEN T O.Production of bioactive secondary metabolites by marineVibrionaceae[J].Marine Drugs,2011,9(9):1440-1468.
[8]PAPIREDDY K,SMILKSTEIN M,KELLY J X,et al.Antimalarial activity of natural and synthetic prodiginines[J].Journal of Medicinal Chemistry,2011,54(15):5296-5306.
[9]HE J,HE X,ZHANG H Y,et al.Effect of the Chinese herbMesimareishiUE-1on invasion of human ovarian cancer cellsin vitro[J].African Journal of Biotechnology,2013,10(48):9888-9897.
[10]KAVITHA R,AISWARIYA S,RATNAVALI C M G.Anticancer activity of red pigment fromSerratiamarcescensin human cervix carcinoma[J].International Journal of Pharmaceutical Research,2010,2(1):784-787.
[11]PANDEY R,CHANDER R,SAINIS K B.Prodigiosins as anticancer agents:Living upto their name[J].Current Pharmaceutical Design,2009,15(7):732-741.
[12]SOTO-CERRATO V,VINALS F,LAMBERT J R,et al.Prodigiosin induces the proapoptotic gene NAG-1viaglycogen synthase kinase-3βactivity in human breast cancer cells[J].Molecular Cancer Therapeutics,2007,6(1):362-369.
[13]CHANG C C,CHEN W C,HO T F,et al.Development of natural anti-tumor drugs by microorganisms[J].Journal of Bioscience and Bioengineering,2011,111(5):501-511.
[14]卫功元,王大慧,陈坚.不同溶氧控制方式下的谷胱甘肽分批发酵过程分析[J].化工学报,2007,58(9):2329-2335.
[15]郑传宝,暴海军,薛强.红曲色素发酵流加补料研究[J].氨基酸和生物资源,2012,34(1):66-67.

