昆虫细胞制备AAV-ITR基因表达微载体
李泰明,潘俊杰,祁静,张春
昆虫细胞制备AAV-ITR基因表达微载体
李泰明1,潘俊杰1,祁静2,张春2
1 中国药科大学生命科学与技术学院,江苏 南京 210009 2 中国科学院苏州生物医学工程技术研究所苏州市分子诊断和治疗技术重点实验室,江苏 苏州 215163

李泰明, 潘俊杰, 祁静, 等. 昆虫细胞制备AAV-ITR基因表达微载体. 生物工程学报, 2015, 31(8): 1230–1238.Li TM, Pan JJ, Qi J, et al. Preparation of a novel AAV-ITR gene expression mini vector in Sf9 insect cells via baculovirus. Chin J Biotech, 2015, 31(8): 1230–1238.
AAV-ITR基因表达微载体是只含有腺相关病毒 (Adeno-associated virus, AAV) 倒置末端重复序列 (Inverted terminal repeats, ITR)、基因表达顺式元件和目的基因,而不含有其他外源DNA序列的双链或单链DNA。本研究利用杆状病毒表达系统,制备得到两种重组杆状病毒Bac-ITR-EGFP和Bac-inrep,并将二者的P3代病毒共同感染昆虫细胞Spodoptera frugiperda (Sf9),抽提小分子量DNA,获得AAV-ITR-EGFP基因表达微载体,2×107的Sf9细胞抽提可以得到100 μg AAV-ITR-EGFP基因表达微载体,核酸电泳显示AAV-ITR-EGFP基因表达微载体主要以单体和二聚体的形式存在。将AAV-ITR-EGFP基因表达微载体通过polyethylenimine (PEI) 转染HEK 293T细胞,24 h后荧光显微镜观察有EGFP表达,48 h后达到高峰,转化效率达到65%。
基因治疗,基因表达微载体,杆状病毒表达系统,非病毒载体
基因治疗是人类治疗肿瘤、传染病、遗传病的发展方向。基因治疗要依靠转染性高、安全有效的基因载体,寻找安全有效的基因治疗载体是当今基因治疗领域的研究热点。目前,应用于基因治疗的载体分为病毒载体和非病毒载体两大类。病毒基因表达载体是用于基因治疗的主要基因表达载体,但是病毒载体由于其蛋白质组成成分以及DNA组成成分,体内实验表明易引发机体产生免疫反应、细胞炎症,而且存在插入突变、致癌等风险[1-3]。非病毒载体通常使用细菌质粒DNA (pDNA) 将外源基因导入到受体细胞中,除了导入目的基因外,还会包含筛选和扩增质粒所必需的DNA 序列[4-6],比如抗生素抗性基因 (-内酰胺类) 以及增殖复制的起始子 (,),造成机体免疫反应、细胞炎症、细胞毒性等不良副作用。目前,针对pDNA的改造有制备成微环DNA (Mini-circle DNA) 和线性共价闭合微环DNA (Mini-linear covalently closed, mini-lcc)[7-9]。二者都是尽可能删除潜在的会引发机体免疫反应以及干扰载体整合效率的序列。Chen[11-12]课题组对基因表达微载体表达外源基因的机理进行的研究表明,外源基因序列以及CpG的存在会引起外源基因的表达沉默化,而基因表达微载体中的外源基因则能长久表达。
本实验制备得到的AAV-ITR基因表达微载体是一种基于腺相关病毒倒置末端重复序列的基因表达载体,仅含有AAV基因组的两端的ITR序列和中间的基因表达框序列。前期实验[13]中采用热变性的方法制备了AAV-ITR单链微载体,在细胞内得到了有效表达。近期有研究者证实在一个阅读框架中同时表达AAV复制蛋白Rep78和Rep52,能使Rep蛋白表达量提高,从而增加AAV基因组的复制[14]。本研究在其基础上,合理改进杆状病毒载体,将基因中插入一段人工合成的内含子序列,该序列中含有杆状病毒晚期启动子ph,得到的杆状病毒Bac-inrep感染昆虫细胞后能在一个阅读框架中同时表达Rep78和Rep52,提高了Rep78和Rep52的表达,增加了AAV基因组的复制。将含有ITR及EGFP表达框的序列构建到另外一个杆状病毒Bac-ITR-EGFP中,共同感染Sf9细胞,制备AAV-ITR基因表达微载体。
1 材料与方法
1.1 材料
AAV-MCS质粒、pFastbBacdual质粒购自Invitrogen公司。Sure 2感受态、pUC57- minivector、pAAV-in-RC质粒、DH10 Bac感受态、Sf9细胞、HEK 293T细胞均为中国科学院苏州生物医学工程技术研究所细胞分子生物学研究中心保存。限制性内切酶Ⅰ、Ⅰ购自Thermo Scientific。其余限制性内切酶以及T4DNA连接酶均购自NEB。购自TOYOBO。小鼠抗人AAV-rep单克隆抗体购自American Research Products。辣根过氧化物酶标记山羊抗小鼠IgG (H+L) 购自海门碧云天。Cycle-pure kit试剂盒购自OMEGA。Sf-900 II SFM、Cellfectin II reagent、Fetal bovine serum、Antibiotic-Antimycotic (100×) 购自Invitrogen公司。其余试剂为国产分析纯以上。PCR引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 构建pFastBacdual-ITR-EGFP质粒
腺相关病毒载体pAAV-MCS用Ⅰ和Ⅰ双酶切得到目的片段,杆状病毒载体 pFastBacdual用Ⅰ和Ⅰ双酶切得到载体片段,分别用1%琼脂糖电泳,胶回收。目的片段和载体片段在T4 DNA连接酶的作用下,16 ℃连接过夜,转化感受态,挑取单克隆经37 ℃过夜培养后抽提质粒,通过Ⅰ单切鉴定该重组质粒并测序。
以质粒pUC57-minivector为模板,通过PCR扩增EGFP序列 (约720 bp)。引物分别为P1和P2,PCR扩增条件为:94 ℃ 2 min;98 ℃ 10 s,64.3 ℃ 30 s,68 ℃ 1 min,35个循环。用HⅠ和Ⅰ双酶切PCR产物和pFastBacdual-ITR载体,用Cycle-pure kit试剂盒纯化后用T4 DNA连接酶,16 ℃连接过夜,转化感受态,挑取单克隆经37 ℃过夜培养后抽提质粒,用HⅠ和Ⅰ双酶切鉴定该重组质粒并测序。
1.2.2 构建pFastBacdual-inrep质粒
以pAAV-in-RC[15]为模板,P3和P4为引物,PCR 扩增条件为:94 ℃ 2 min;98 ℃ 10 s,68 ℃ 3 min,PCR 扩增得到inrep。PCR 产物用1%琼脂糖电泳胶回收。Z17Ⅰ和Ⅰ双酶切PCR回收产物。pFastBacDual用Ⅰ和Ⅰ双切。PCR片段酶切产物与载体片段用Cycle-pure kit试剂盒回收,T4 DNA连接酶16 ℃连接过夜,转化DH 5α感受态,挑取单克隆经37 ℃过夜培养后抽提质粒,通过I酶切鉴定该重组质粒并测序。
1.2.3 质粒转化
将测序正确的pFastBacdual-inrep、pFastBacdual-ITR-EGFP质粒转化含有Bacmid和helper质粒的DH10 Bac感受态,蓝白斑筛选出阳性克隆,抽提重组Bacmid。用M13通用引物P5和P6,PCR鉴定Bacmid-inrep,PCR扩增条件为:94 ℃ 2 min;98 ℃ 10 s,55 ℃30 s,68 ℃ 5 min,35个循环。用M13上游引物P5和EGFP下游引物P7,PCR鉴定 Bacmid- ITR-EGFP,PCR扩增条件为:94 ℃2 min;98 ℃ 10 s,55 ℃ 30 s,68 ℃ 2 min,35个循环。

表1 PCR引物序列
1.2.4 重组杆状病毒的获取
将鉴定正确的Bacmid-inrep、Bacmid- ITR-EGFP用Cellfectin II Reagent转染六孔板中的Sf9细胞,细胞密度为50%–60%,120 h后收集培养上清 (1 450 r/min, 5 min) 得到的上清即为P1。取P1按 MOI值0.1连续感染Sf9细胞两次后获得高滴度的P3病毒,噬菌斑法测病毒滴度。
1.2.5 杆状病毒表达Bac-inrep蛋白的鉴定
取重组杆状病毒Bac-inrep P3 (MOI=5) 感染六孔板中的Sf9细胞,72 h后收集细胞,离心 (1 450 r/min, 5 min),用PBS洗两遍。细胞沉淀裂解后,上清用于Western blotting检测。浓缩胶浓度5%,分离胶浓度10%。一抗为小鼠抗人AAV-rep单克隆抗体,二抗为辣根过氧化物酶标记山羊抗小鼠IgG (H+L)。
1.2.6 制备AAV-ITR-EGFP基因表达微载体
当Sf9细胞处于指数增长期至2×106cells/mL时,按MOI=2加入两种重组杆状病毒 Bac-inrep P3和Bac-ITR-EGFP P3。继续培养72 h后,收取Sf9细胞。抽提Sf9中的小分子量的DNA,用Ⅰ酶切鉴定。
1.2.7 AAV-ITR-EGFP基因表达微载体在体外细胞中的表达
取对数生长期HEK 293T细胞接种于24孔板,待细胞贴壁生长至较好状态时(密度为2.5×105cells/mL)。基因表达微载体DNA用PEI转染细胞,N/P比为15,将PEI-DNA混合液加入至用PBS溶液清洗过的HEK 293T细胞表面,再加入适量培养基,置于37 ℃、5% CO2的饱和湿度培养箱中培养。24 h后荧光显微镜下观察,流式细胞仪测其转染效率。
2 结果
2.1 质粒构建与杆状病毒的制备
在质粒pFastBacdual上插入含有AAV-ITR基因表达框的序列,得到重组质粒pFastBacdual- ITR,Ⅰ单切鉴定得到4 997 bp、1 277 bp、666 bp,电泳结果见图1A,与预期条带一致,测序结果正确。以重组质粒pFastBacdual-ITR 为载体,插入报告基因EGFP,得到重组质粒pFastBacdual-ITR-EGFP (图1B),用HⅠ和Ⅰ双酶切得到6 905 bp、726 bp,电泳结果见图1C,与预期条带一致,测序结果正确。
参照Chen[15]的构建方法,构建rep表达质粒,为的启动子,为的启动子(图2A)。在质粒pFastBacdual上插入得到重组质粒pFastBacdual-inrep,Ⅰ单切鉴定得到7 375 bp条带,电泳结果见图2B,与预期条带一致,测序结果正确。
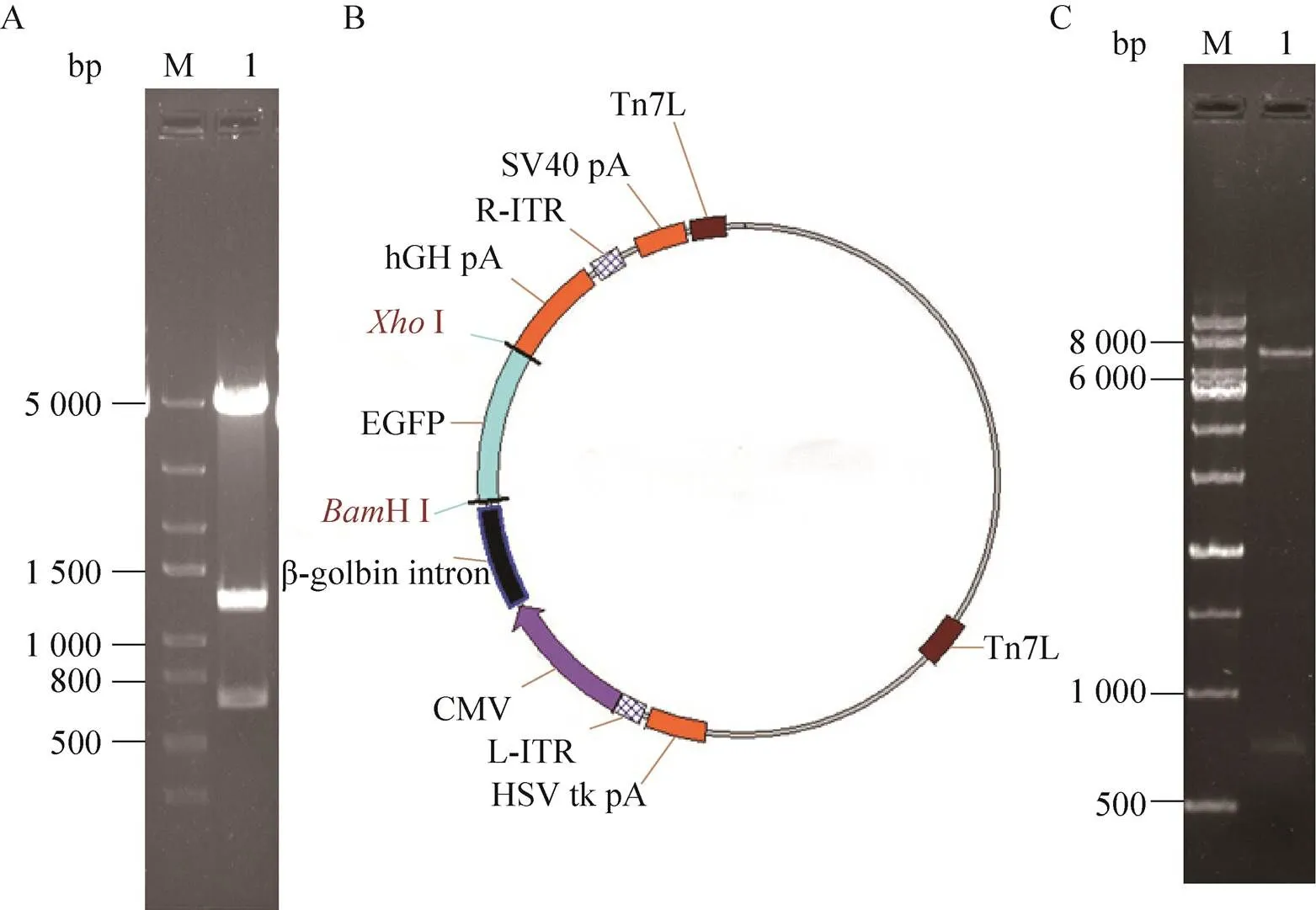
图1 pFastBacdual-ITR-EGFP质粒的构建与鉴定
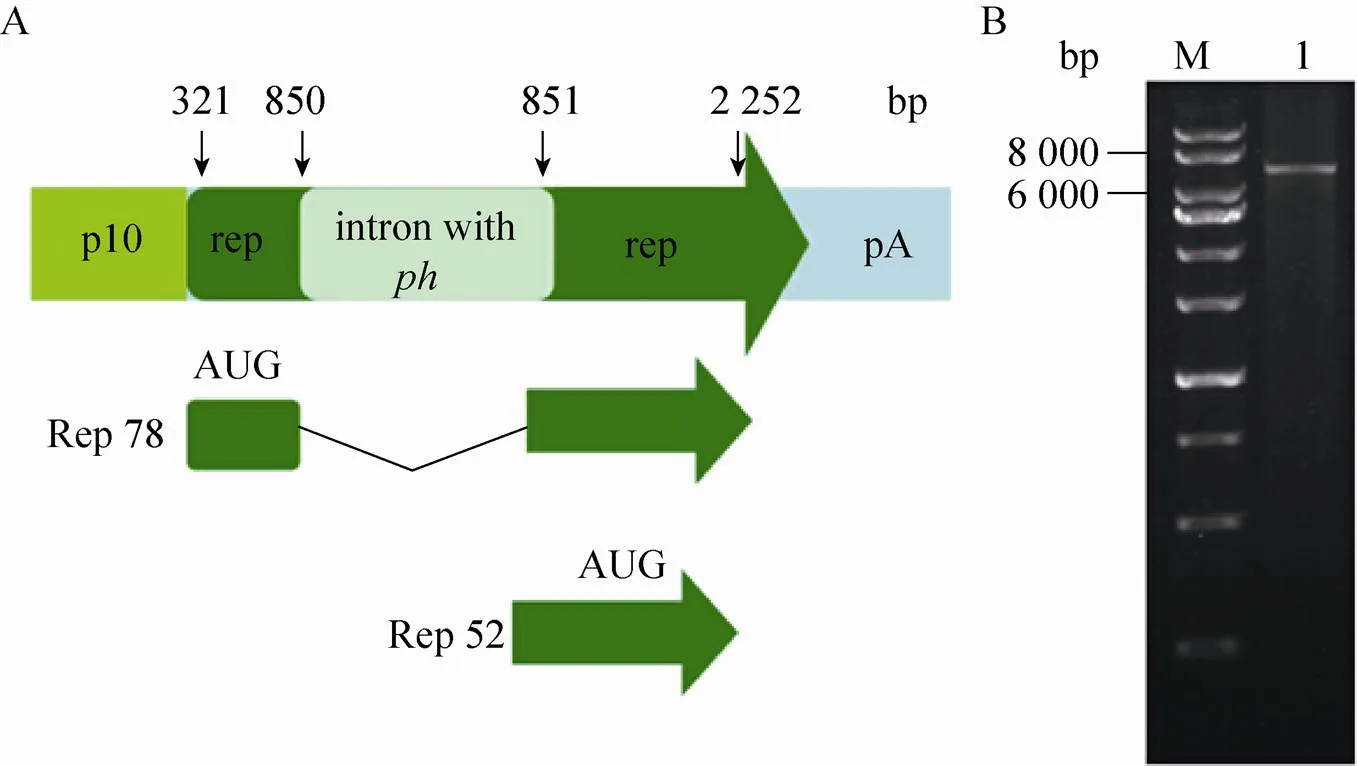
图2 Bac-inrep的基因转录示意图与pFastBacdual-inrep质粒的鉴定
将上述两种质粒分别转化DH 10Bac感受态,蓝白筛选得到Bacmid-inrep、Bacmid- ITR-EGFP。通过PCR进一步筛选正确杆粒。以Bacmid-inrep为模板,P5和P6为引物做PCR扩增,鉴定重组杆状病毒DNA。结果显示,重组Bacmid-rep在5 000 bp附近有目的条带 (图3A),与预计的结果 (4 760 bp) 一致。以Bacmid-ITR-EGFP为模板,以P5和P7为引物做PCR扩增,结果显示重组Bacmid-ITR-EGFP在2 000–3 000 bp附近有目的条带 (图3B),与预计的结果 (2 151 bp) 一致。重组Bacmid转染昆虫细胞得到病毒Bac-ITR-EGFP和Bac-inrep。
2.2 Rep蛋白在Sf9细胞中的表达
用小鼠抗人AAV-rep单克隆抗体的单克隆抗体检测Bac-inrep感染Sf9细胞表达的Rep蛋白,同时用未感染的Sf9细胞和野生型杆状病毒感染的Sf9细胞作对照。相比对照,Bac-inrep P3感染的Sf9细胞可以表达AAV复制所必需的蛋白Rep 78、Rep 52以及Rep 40 (图4)。
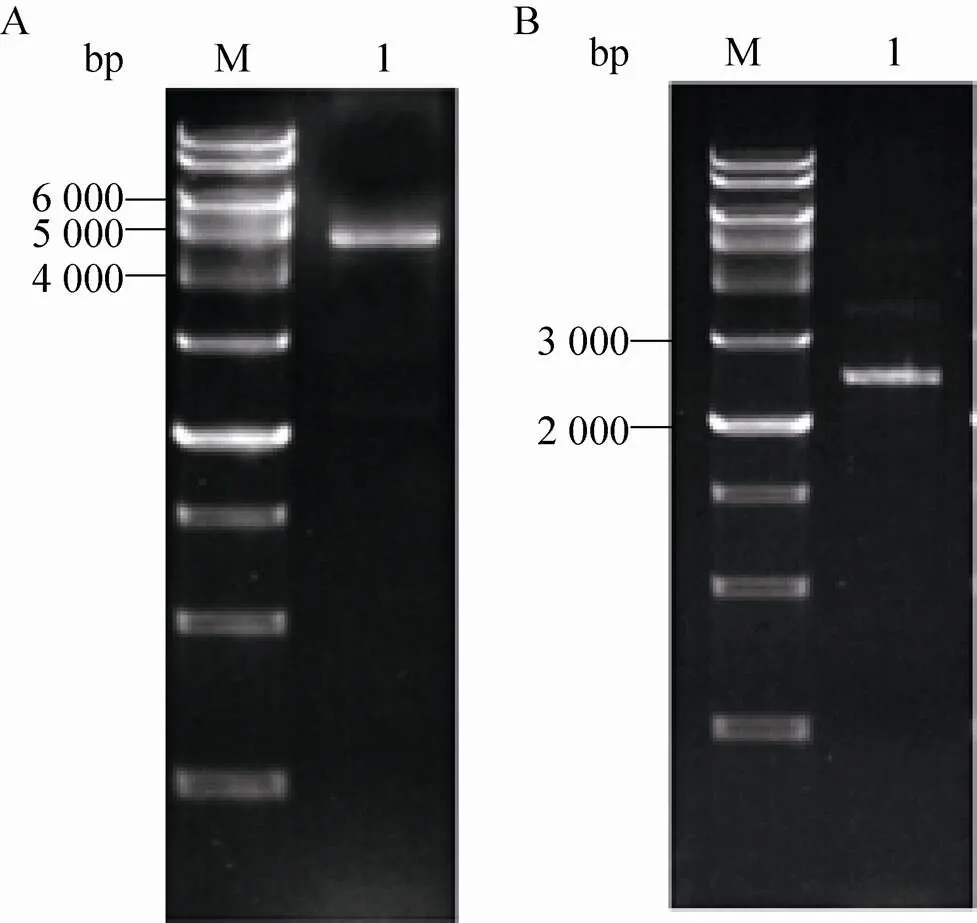
图3 PCR鉴定重组Bacimd
2.3 制备AAV-ITR-EGFP基因表达微载体
两种重组杆状病毒Bac-inrep P3 (MOI=2) 和Bac-ITR-EGFP P3 (MOI=2) 同时感染Sf9 细胞,72 h后抽提小分子量DNA得到基因表达微载体。2×107的Sf9细胞抽提可以得到100 μg AAV-ITR基因表达微载体DNA。琼脂糖凝胶电泳显示,主要条带在2.7 kb和5.4 kb,分别对应基因表达微载体的单体和二聚体。推算得到其余的条带上显示的大小即为三聚体以及多聚体 (图5A)。用Ⅰ单酶切做进一步鉴定,得到 2 048 bp,670 bp的条带 (图5B),与预期相符。
2.4 AAV-ITR-EGFP基因表达微载体在293T细胞中的表达
为了鉴定AAV-ITR-EGFP基因表达微载体在细胞中的基因表达能力,将AAV-ITR-EGFP基因表达微载体DNA用PEI转染HEK 293T细胞。24 h、48 h后在荧光显微镜下观察EGFP的表达情况。如图6A所示,24 h后即有荧光表达,48 h (图6B) 达到65%的阳性率。该结果表明AAV-ITR-EGFP基因表达微载体已经成功转染HEK 293T细胞并得到有效表达。
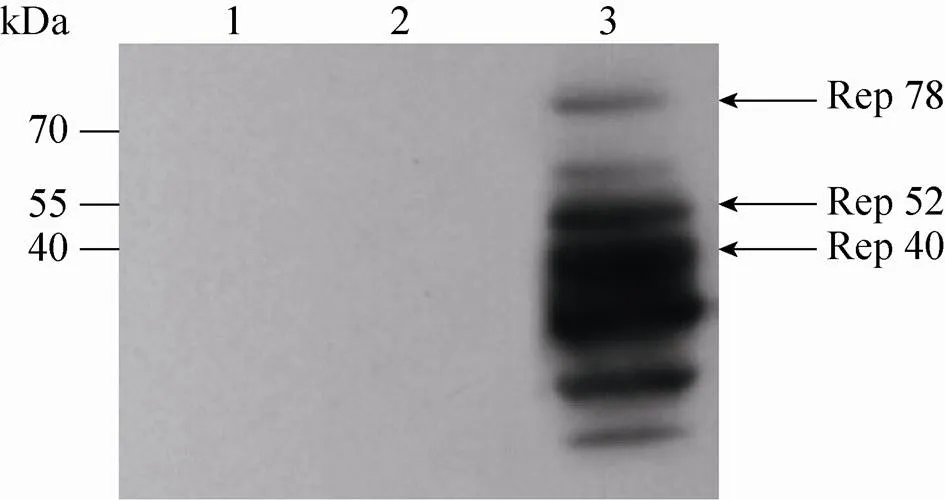
图4 Western blotting检测Rep蛋白
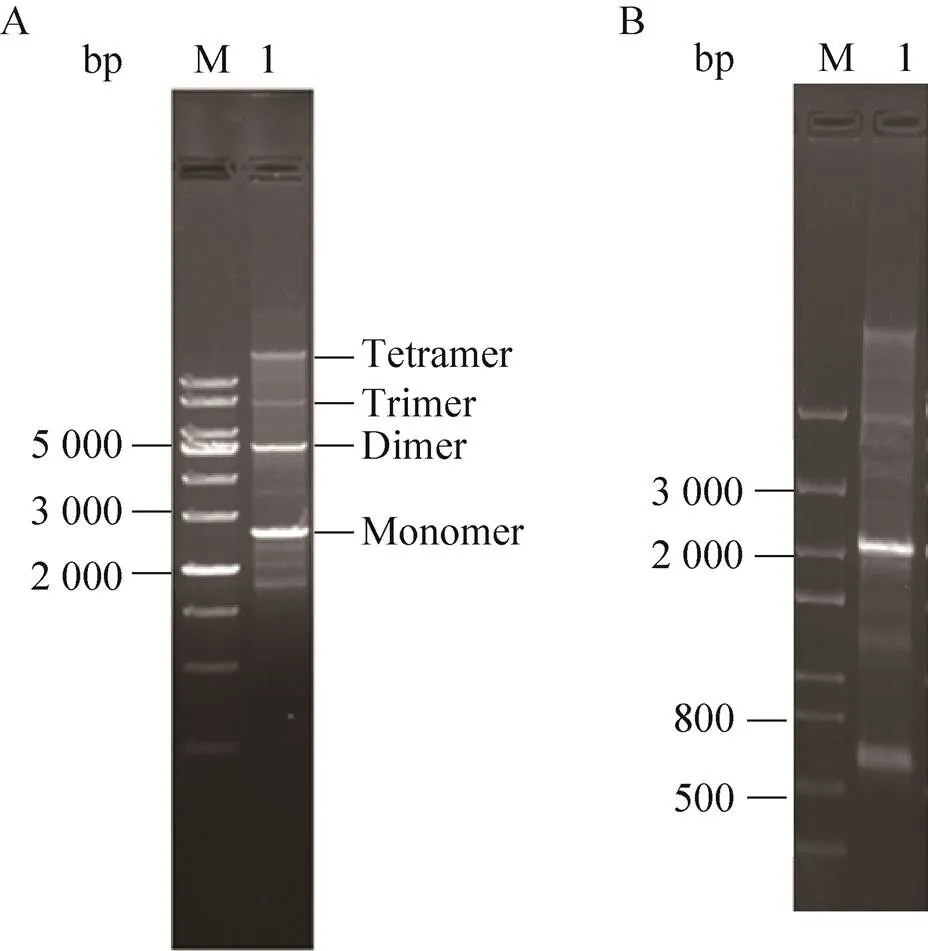
图5 AAV-ITR-EGFP基因表达微载体鉴定
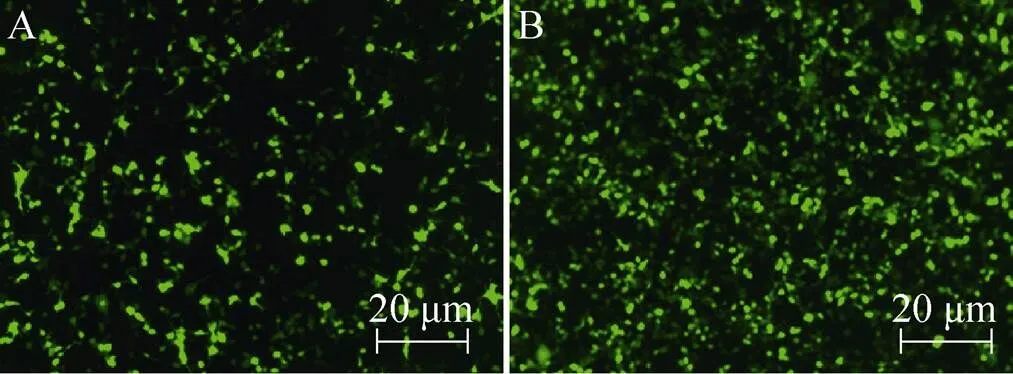
图6 AAV-ITR-EGFP基因表达微载体转染HEK 293T细胞
3 讨论
rAAV病毒载体对人体无明显致病性,能够有效转导分裂细胞以及为分裂细胞,能够定点整合到人的19号染色体上,转导效率高,能够在动物模型体内长期表达。同时,该载体也存在安全性、免疫原性以及生产成本高的缺点。在中制备得到的pDNA通常都会含有很多原核生物扩增的必需序列,会引起DNA结构发生修饰比如N6-甲基腺嘌呤和N5-甲基胞嘧啶[4],甚至会引起转染细胞的细胞毒性[2]。基因表达微载体是指,不含有或很少含有细菌复制子序列、抗生素抗性基因序列等pDNA序列,仅保留基因表达所需要的顺式元件,如基因表达启动子、目的基因和加尾序列 (poly A),其外源基因能有效表达的环状的DNA分子[16-17]。因此,我们制备得到的基因表达微载体免疫原性低,制备简单快速,避免了病毒载体和非病毒载体的缺陷。
Urabe等[18]利用杆状病毒表达系统得到3种杆状病毒:重组杆状病毒Bac-Rep、重组杆状病毒Bac-VP和含有被AAV-ITR阅读框架包裹的目的基因的重组杆状病毒,共感染昆虫细胞Sf9,制备rAAV载体。其中,重组杆状病毒Bac-Rep中表达的Rep 78和Rep 52为AAV复制关键蛋白,用于DNA的自我修复、复制和包装[19]。但是,由于和r2序列重复可导致rep表达不稳定,表达量降低,从而影响大规模生产的产量[20-21]。我们总结前人经验,在两个启动子之间插入人工内含子,保证Rep蛋白的稳定表达,有利于微载体的合成。Western blotting 鉴定Rep蛋白结果中除了目的蛋白Rep 78和Rep 52外还有很多小蛋白,其中Rep 40为Rep 52的剪切体,推测其他蛋白是Rep蛋白剪切过程中的中间体。
AAV-ITR基因表达微载体仅保留了制备微载体所必需的ITR顺式作用元件,在昆虫细胞中制备得到的基因表达微载体主要由单体和二聚体形式存在,无pDNA中CpG序列、抗菌素的抗性基因序列,因此可以减少基因治疗过程中所引起的机体免疫反应、细胞毒性等不良副作用以及抗生素基因产生的抗药性,且由于分子量小,可以提高转染效率[22]。
AAV-ITR基因表达微载体相对于AAV病毒载体具有如下优点:首先,不含有AAV病毒包膜蛋白Cap,安全性高,免疫原性低;其次,AAV基因载体最大插入基因仅4.5 kb,AAV-ITR基因表达微载体插入外源基因大小不受AAV包装容量的限制;此外利用杆状病毒表达系统制备基因表达微载体具有产量高、易于纯化的优点。
制备得到的AAV-ITR基因表达微载体能够成功转染HEK 293T细胞。后续将进一步探讨AAV-ITR基因表达微载体在体内表达的效果以及在其他细胞中的毒性验证。
综上所述,制备得到的AAV-ITR基因表达微载体有望成为一种更有前景的基因治疗 载体。
[1] Seow Y, Wood MJ. Biological gene delivery vehicles: beyond viral vectors. Mol Ther, 2009, 17(5): 767–777.
[2] Wang D, Zhong L, Nahid MA, et al. The potential of adeno-associated viral vectors for gene delivery to muscle tissue. Expert Opin Drug Deliv, 2014, 11(3): 345−364.
[3] Dismuke DJ, Tenenbaum L and Samulski RJ. Biosafety of recombinant adeno-associated virus vectors. Curr Gene Ther, 2013, 13(6): 434–452.
[4] Ratel D, Ravanat JL, Berger F, et al. N6-methyladenine: the other methylated base of DNA. Bioessays, 2006, 28(3): 309–315.
[5] Bigger BW, Tolmachov O, Collombet JM, et al. An araC-controlled bacterial cre expression system to produce DNA minicircle vectors for nuclear and mitochondrial gene therapy. J Biol Chem, 2001, 276(25): 23018–23027.
[6] Wicks IP, Howell ML, Hancock.T, et al. Bacterial lipopolysaccharide copurifies with plasmid DNA: implications for animal models and human gene therapy. Hum Gene Ther, 1995, 6(3): 317–323.
[7] Mayrhofer T, Schleef M and Jechlinger W. Use of minicircle plasmids for gene therapy. Methods Mol Biol, 2009, 542: 87–104.
[8] Rybchin VN and Svarchevsky AN. The plasmid prophage N15: a linear DNA with covalently closed ends. Mol Microbiol, 1999, 33(5): 895–903.
[9] Dalpke A, Frank J, Peter M, et al. Activation of toll-like receptor 9 by DNA from different bacterial species. Infect Immun, 2006, 74(2): 940–946.
[10] Kay MA, He CY, Chen ZY. A robust system for production of minicircle DNA vectors. Nat Biotechnol, 2010, 28(12): 1287–1289.
[11] Chen ZY, He CY, Meuse L, et al. Silencing of episomal transgene expression by plasmid bacterial DNA elements. Gene Ther, 2004, 11(10): 856–864.
[12] Chen ZY, Riu E, He CY, et al. Silencing of episomal transgene expression in liver by plasmid bacterial backbone DNA is independent of CpG methylation. Mol Ther, 2008, 16(3): 548–556.
[13] Li TM, Ping H, Zhang C. Construction of a new gene delivering mini vector based on AAV-ITR. PharmacBiotechnol, 2013, 20(4): 318–321 (in Chinese).李泰明, 平菡, 张春. 基于AAV-ITR的基因表达微载体. 药物生物技术, 2013, 20(4): 318–324.
[14] Li L, Dimitriadis EK, Yang Y, et al. Production and characterization of novel recombinant adeno-associated virus replicative-form genomes: a eukaryotic source of DNA for gene transfer. PLoS ONE, 2013, 8(8): e69879.
[15] Chen H. Intron splicing-mediated expression of AAV Rep and Cap genes and production of AAV vectors in insect cells. Mol Ther, 2008, 16(5): 924–930.
[16] Chen ZY, He CY, Ehrhardt A, et al. Minicircle DNA vectors devoid of bacterial DNA result in persistent and high-level transgene expression. Mol Ther, 2003, 8(3): 495–500.
[17] Chen ZY, He CY and Kay MA. Improved production and purification of minicircle DNA vector free of plasmid bacterial sequences and capable of persistent transgene expression. Hum Gene Ther, 2005, 16(1): 126–131.
[18] Urabe M, Ding C and Kotin RM. Insect cells as a factory to produce adeno-associated virus type 2 vectors. Hum Gene Ther, 2002, 13(16): 1935–1943.
[19] Pereira DJ, McCarty DM and Muzyczka N. The adeno-associated virus (AAV) Rep protein acts as both a repressor and an activator to regulate AAV transcription during a productive infection. J Virol, 1997, 71(2): 1079–1088.
[20] Negrete A, Yang LC, Mendez AF, et al. Economized large-scale production of high yield of rAAV for gene therapy applications exploiting baculovirus expression system. J Gene Med, 2007, 9(11): 938–948.
[21] Kohlbrenner E, Aslanidi G, Nash K, et al. Successful production of pseudotyped rAAV vectors using a modified baculovirus expression system. Mol Ther, 2005, 12(6): 1217–1225.
[22] Kreiss P, Cameron B, Rangara R, et al. Plasmid DNA size does not affect the physicochemical properties of lipoplexes but modulates gene transfer efficiency. Nucleic Acids Res, 1999, 27(19): 3792–3798.
(本文责编 陈宏宇)
Preparation of a novel AAV-ITR gene expression mini vector in Sf9 insect cells via baculovirus
Taiming Li1, Junjie Pan1, Jing Qi2, and Chun Zhang2
1,,210009,,2,,215163,,
AAV-ITR gene expression mini vector is a double-strand or single-strand DNA that only contains inverted terminal repeats of adeno-associated virus, cis-elements and gene of interest and does not contain any other foreign DNA sequences. We prepared Bac-ITR-EGFP and Bac-inrep. Spodoptera frugiperda cells were infected with Bac-ITR-EGFP (P3) and Bac-inrep (P3). Up to 100 μg of AAV-ITR-EGFP gene expression mini vectors were extracted from 2×107cells of Sf9 72 h after infection. The gel electrophoresis analysis shows that most forms of AAV-ITR-EGFP gene expression mini vector were monomer and dimer. The mini vector expression efficacy was examinedwith HEK 293T cells. The EGFP expression was observed at 24 h after transfection, and the positive ratio reached 65% at 48 h after transfection.
gene therapy, gene expression mini vector, Bac-to-Bac baculovirus expression system, non-viral vector
10.13345/j.cjb.140485
September 16, 2014; Accepted:December 1, 2014
National Natural Science Foundation of China (No. 81371670), Graduate Training Innovation Project of Jiangsu Province (No. SJLX_0285).
Chun Zhang. Tel: +86-512-69588327, E-mail: chunzhangspring@gmail.com.
国家自然科学基金 (No. 81371670),江苏省研究生培养创新工程 (No. SJLX_0285) 资助。
2015-01-14
http://www.cnki.net/kcms/detail/11.1998.Q.20150114.1355.001.html

