光照强度对葡萄愈伤组织形成过程中相关酶活性和基因表达的影响
刘蓉,杨国伟,吴月燕,饶慧云,李学孚,2,李美芹,2,钱萍仙
光照强度对葡萄愈伤组织形成过程中相关酶活性和基因表达的影响
刘蓉1,杨国伟1,吴月燕1,饶慧云1,李学孚1,2,李美芹1,2,钱萍仙1
1 浙江万里学院生物与环境学院,浙江 宁波 315100 2 上海海洋大学水产与生命学院,上海 201306

刘蓉, 杨国伟, 吴月燕, 等. 光照强度对葡萄愈伤组织形成过程中相关酶活性和基因表达的影响. 生物工程学报, 2015, 31(8): 1219–1229.Liu R, Yang GW, Wu YY, et al. Effects of light intensity on associated enzyme activity and gene expression during callus formation of Vitis vinifera. Chin J Biotech, 2015, 31(8): 1219–1229.
文中分析了葡萄愈伤组织诱导和继代培养的最佳光照强度并探索葡萄愈伤组织褐变的机理。以金手指葡萄的幼嫩茎段为材料,设置0、500、1 000、1 500、2 000、2 500、3 000和4 000 Lx等8个光照强度,研究不同光照强度对葡萄愈伤组织的诱导率、褐化率及相关酶活性和基因表达的影响。结果表明,在0、500、1 000和1 500 Lx光照强度处理下,愈伤组织的诱导率均达到92%以上,显著高于其他处理 (<0.05),其中 1 000和1 500 Lx光照强度处理愈伤组织及其继代培养的生长势良好且褐化程度较轻;绿原酸、咖啡酸、对羟基苯甲酸和香豆酸与葡萄愈伤组织褐变关系密切,其中绿原酸的含量与褐化程度呈显著正相关(<0.05);POD和PPO酶活性与褐化率呈极显著负相关 (<0.01);、和酶基因的表达量与褐化率呈显著(<0.05) 或极显著(<0.01) 正相关。因此,葡萄愈伤组织诱导和继代培养适宜的光照强度为1 000−1 500 Lx,光照强度过高或过低对其正常的生理生长都有较大负面影响。
葡萄,愈伤组织,光照强度,诱导率,褐化率,酶活性,基因表达
葡萄枝、叶富含酚类化合物,利用嫩枝和幼叶进行愈伤组织的诱导容易产生褐化现象,有效控制愈伤组织的褐化是葡萄组织培养成功的关键。葡萄组织培养中的褐变主要是由酶促反应引起,而酶促反应必须具有底物、酶和氧等3个条件[1]。一般认为酚酸类物质是外植体酶促褐变过程中的底物,主要包括苯基羧酸 (邻羟基苯酚、儿茶酚、没食子酸、莽草酸等)、苯丙烷衍生物 (绿原酸、肉桂酸、香豆酸、咖啡酸、单宁、木质素等)、黄烷衍生物 (花青素、黄酮、芸香苷等),其含量与外植体褐变密切相关[2]。引起酶促褐变的几个关键酶有多酚氧化酶 (Polyphenol oxidase,PPO)、过氧化物酶 (Peroxidase,POD) 和苯丙氨酸解氨酶(Phenylalanine ammonialyase,PAL)[3]。PPO是催化褐变反应的关键酶,能催化酚类物质到联苯酚的羟基化以及羟基酚到醌的脱氢反应,醌在植物体内自身聚合,或与细胞内的蛋白质反应,产生黑色或褐色的沉积物,被认为是植物体酶促褐变的主要原因[4];POD是植物防御中的第一道防线,有报道表明POD和PPO共同氧化酚成醌,醌转变成缩合型鞣质,最后形成褐色的聚合体[2]。研究表明POD酶活性与愈伤组织的褐化率呈负相关,PPO和PAL酶活性与其褐化程度呈正相关[5-7];亦有报道表明褐化程度与和酶基因的表达呈正相关[7-8],与酶基因的表达有关[9-10]。引起葡萄愈伤组织褐化的因素复杂,如品种、外植体的类型和环境条件 (如氧气、温度和光照)等,其中外界环境条件的调控是降低愈伤组织褐化率的重要手段。作者在葡萄组织培养试验中发现,适当的光照强度能有效地降低愈伤组织的褐化,但目前光照对植物愈伤组织褐化影响的机理鲜有报道。
本文通过分析不同光照强度下葡萄愈伤组织诱导和继代培养过程中生长以及相关酚酸类物质酶的活性和基因表达量的变化,探索光照强度导致葡萄愈伤组织褐化的机理,为葡萄愈伤组织诱导提供基础资料。
1 材料与方法
1.1 材料
供试葡萄品种为“金手指” (Gold finger),采自宁波市镇海区长石村浙江万里学院葡萄试验基地 (29°96〞N, 121°72〞E)。
1.2 方法
1.2.1 愈伤组织的诱导和继代培养
根据前期研究,本试验愈伤组织诱导和愈伤组织继代培养基分别为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L和MS+6-BA 1.0 mg/L+IBA 0.1 mg/L,培养基中的蔗糖和琼脂浓度分别为3%和0.6%,pH为5.8−5.9。
愈伤组织的诱导主要参考前人的研究方法[11]结合前期试验结果确定试验设置0、500、1 000、1 500、2 000、2 500、3 000和4 000 Lx等8个处理。愈伤组织诱导时取葡萄的幼嫩茎段接种于诱导培养基中,每瓶5段外植体,每个处理10瓶,重复3次,28 d后观察愈伤组织的生长情况并统计其诱导率、褐化率及生长状况等;同时选取生长状况基本一致的愈伤组织接种于继代培养基中继续进行继代培养试验,每瓶5块愈伤,每块愈伤大小约1.0 cm2,每个处理6瓶,重复3次,20 d后观察其生长状况并统计褐化率;分析不同处理酚酸类成分、相关的酶活性及酶基因的表达。用SPSS18.0对试验数据进行方差分析和相关性分析。
愈伤组织的诱导率=(长出愈伤组织的外植体块数/总接种的外植体块数)×100%;
愈伤组织的褐化率=(褐化的愈伤组织块数/总接种的愈伤组织块数)×100%。
培养室25 ℃恒温、16 h/8 h的光/暗条件。
1.2.2 酚类的定性定量测定
采用液相色谱,色谱系统为1100高效液相色谱仪 (美国Agilent 公司)。乙酸和甲醇均为色谱纯;没食子酸、绿原酸、咖啡酸、儿茶酚、香豆酸、对羟基苯甲酸和阿魏酸为标准品 (≥99%,Sigma公司)。水用Mill-iQ (美国Millipore公司) 超纯水仪处理 (18 M);流动相经0.45 μm滤膜过滤。标准溶液和样品溶液的制备参考吕海涛等[12]的方法。
色谱柱:EclipseXDB-C18 (150 mm×4.6 mm .i d.,5 μL),流动相:A为甲醇;B为1%乙酸水溶液();梯度洗脱程序:溶剂A在40 min内由5%上升到30%,然后变为100%,并维持5 min,最后再返回到初始状态。柱温:30 ℃;流速:1.0 mL/min;检测波长:280 nm;进样量:20 μL。
1.2.3 酶活性的测定
POD酶活性参考魏建梅等[13]的方法,以每分钟吸光度变化值表示酶活性的大小,酶活性单位为Δ470/(min·g);PPO酶活性参考郑小林等[14]的方法,以每分钟吸光度变化值表示酶活性的大小,酶活性单位为Δ420/(min·g);PAL酶活性参考王勇等[15]的方法测定,以每分钟吸光度变化值表示酶活性的大小,酶活性单位为Δ290/(min·g)。
1.2.4、、酶基因的qRT-PCR测定
qRT-PCR主要参考前人的研究方法[16]适当改进。总RNA提取所用试剂盒购于Genotheramics公司;DNaseⅠ酶液购于康为世纪公司。对所提取RNA进行琼脂糖凝胶电泳,共3条谱带 (28S rRNA、18S rRNA和5S rRNA) 且28S rRNA和18S rRNA亮度比约为2∶1,紫外分光光度计检测260/280在1.8−2.0之间,表明所提取RNA完整性好、无降解且纯度较好,可以进行后续实验。提取的RNA保存在–80 ℃冰箱中备用。按康为世纪公司的SuperRT cDNA第一链合成试剂盒的方法合成cDNA第一链。反转录反应体系 (20 μL)为:dNTPs 4 μL,混合引物2 μL,RNA模板5 μL,反转录缓冲液 (5×) 4 μL,反转录酶1 μL,无RNA酶水4 μL。根据葡萄、和基因的全长序列,按照相对荧光定量RT-PCR引物设计原则在基因3′区设计3对特异引物,以为内参设计一对特异引物 (表1),分别用于不同光照条件下各基因表达分析。反应在Invitrogen公司ABI 7500 FAST实时定量PCR仪上进行,方法参照全式金生物技术有限公司荧光定量试剂盒TransStart Green qPCR SuperMix UDG说明书。荧光定量PCR扩增体系为:cDNA模板1 μL,上游引物0.4 μL,下游引物0.4 μL,酶液 (含UDG) 10 μL,校准液 (50×) 0.4 μL,加水补足至20 μL。扩增程序采用两步法:50 ℃ UDG孵育2 min,94 ℃ 10 min UDG失活,94 ℃变性5 s,60 ℃复性34 s,共40个循环,反应结束后分析荧光值变化曲线和融解曲线。每个反应3个重复,采用ABI 7500分析软件中Comparative CT (ΔΔCT) 法分析试验结果。

表1 荧光定量PCR引物序列
:;:;:;:.
2 结果与分析
2.1 不同光照强度对愈伤组织诱导的影响
如图1和表2所示,光照强度对愈伤组织的诱导率、褐化程度及生长状况均有一定程度的影响。光照强度为0、500、1 000和1 500 Lx处理的诱导率显著高于2 000、2 500、3 000和4 000 Lx光照强度处理 (<0.05),其中光照强度1 500 Lx处理诱导率达到最高,为98.69%,光照强度4 000 Lx处理诱导率最低,仅为32.93%;光照强度对褐化率的影响则相反,光照强度0、500、1 000和1 500 Lx处理褐化率分别为2.56%、3.05%、5.23%和3.56%,显著低于2 000、2 500、3 000和4 000 Lx光照处理 (<0.05),其中光照强度4 000 Lx处理褐化率最高达到93.22%;试验亦表明光照强度对愈伤组织的生长状况有较大的影响,0 Lx和500 Lx光照处理愈伤组织呈乳白色和淡黄色,生长势一般,褐化程度较轻,1 000 Lx和1 500 Lx光照强度处理愈伤组织分别为黄绿色和浅绿色,且生长势良好,光照强度大于1 500 Lx时愈伤组织呈雪花状或松散雪花状且生长势较差。因此,葡萄愈伤组织诱导的适宜光照强度为1 000−1 500 Lx。
2.2 不同光照强度对愈伤组织继代培养的影响
如图2和表3所示,不同光照强度对继代培养的愈伤组织褐化率影响差异显著(<0.05),光照强度0、500、1 000和1 500 Lx处理褐化率显著低于2 000、2 500、3 000和4 000 Lx光照强度处理 (<0.05),其中光照强度为1 500 Lx时愈伤组织的褐化率最低,仅为8.15%,光照强度达到4 000 Lx处理褐化率最高达到98.44%。试验亦表明光照强度对继代后的愈伤组织生长亦有一定程度的影响,光照强度0 Lx和500 Lx处理愈伤组织呈乳白色和淡黄色,生长势一般;光照强度 1 000和1 500 Lx处理愈伤组织呈淡黄色和黄绿色,生长势较好,且褐化率较低;光照强度为2 000 Lx强度处理,愈伤组织呈黄绿色,褐化率显著高于1 500 Lx处理 (<0.05),且生长势一般;光照强度大于2 000 Lx时愈伤组织呈雪花状或松散雪花状,生长势较差,褐化程度显著高于0、500、1 000、1 500和2 000 Lx处理。因此,葡萄愈伤组织继代培养的适宜光照强度条件为1 000−1 500 Lx。

图1 不同光照强度对愈伤组织诱导的影响

表2 不同光照强度对愈伤诱导的影响


图2 不同光照强度下的愈伤组织生长状况

表3 不同光照强度下愈伤继代的生长情况

2.3 不同光照强度下愈伤组织中酚类物质的变化
图3是多酚标准品HPLC色谱图和样品中多酚类物质HPLC色谱图。由标准品图谱可知,7种酚类物质得到了很好的分离,且峰形对称;从样品色谱图可以看出,未检测到没食子酸和儿茶酚,其余5种酚类物质出峰时间与混标原液的出峰时间基本一致,所检测到的5种酚类物质彼此完全分离,分离效果良好。

图3 多酚标准品HPLC色谱(A)和样品HPLC色谱图 (B)
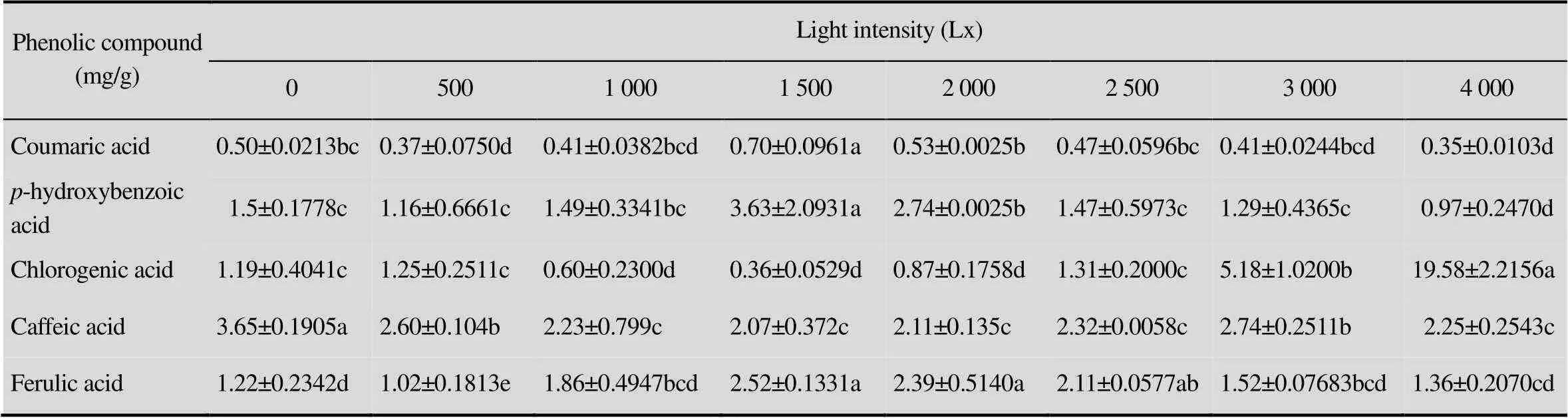
表4 不同光照条件下愈伤组织中酚类物质的含量

由表4可知,1 500 Lx强度处理香豆酸的含量最高达到0.70 mg/g,显著高于其他处理(<0.05),0、1 000、2 000、2 500、3 000 Lx次之,且各处理之间差异不显著 (0.05),4 000 Lx光照强度处理香豆酸的含量最低仅为0.35 mg/g;1 500 Lx光照强度处理对羟基苯甲酸的含量最高达到3.63 mg/g,显著高于其他处理 (<0.05),2 000 Lx光照强度处理次之,4 000 Lx光照强度处理最低,仅为0.97 mg/g;4 000 Lx光照强度处理绿原酸的含量达到19.58 mg/g,显著高于其他处理 (<0.05),3 000 Lx光照强度处理次之,1 500 Lx光照强度处理最低,仅为0.36 mg/g;0 Lx光照强度处理咖啡酸的含量显著高于其他处理 (<0.05),500 Lx和3 000 Lx光照强度处理次之,其他处理之间差异不显著 (0.05); 1 500 Lx光照强度处理阿魏酸的含量最高,显著高于0、500、1 000、3 000和4 000 Lx (<0.05) 光照处理,但与2 000 Lx和2 500 Lx光照强度处理差异不显著(0.05),1 000 Lx光照强度处理阿魏酸的含量最低,仅为1.02 mg/g。
2.4 不同光照处理对POD、PPO和PAL酶活性的影响
如图4所示,不同光照强度对POD、PPO和PAL酶活性的影响不同,1 500 Lx光照强度处理POD酶活性最高达到26.4 Δ470/(min·g),与0、2 000、2 500、3 000和4 000 Lx光照强度处理差异极显著 (<0.01),其中光照强度4 000 Lx时POD酶活性降到最低仅为1.2 Δ470/(min·g);4 000 Lx光照强度处理PPO酶的活性最高达到29.2 Δ420/(min·g),极显著高于其他处理(<0.01),其次为2 500 Lx和3 000 Lx,其他处理PPO酶的活性均较低; 0 Lx和1 500 Lx光照强度处理下PAL酶的活性分别为28.2 Δ290/(min·g)和25.1 Δ290/(min·g),极显著低于其他处理 (<0.01),其他处理之间差异不显著。
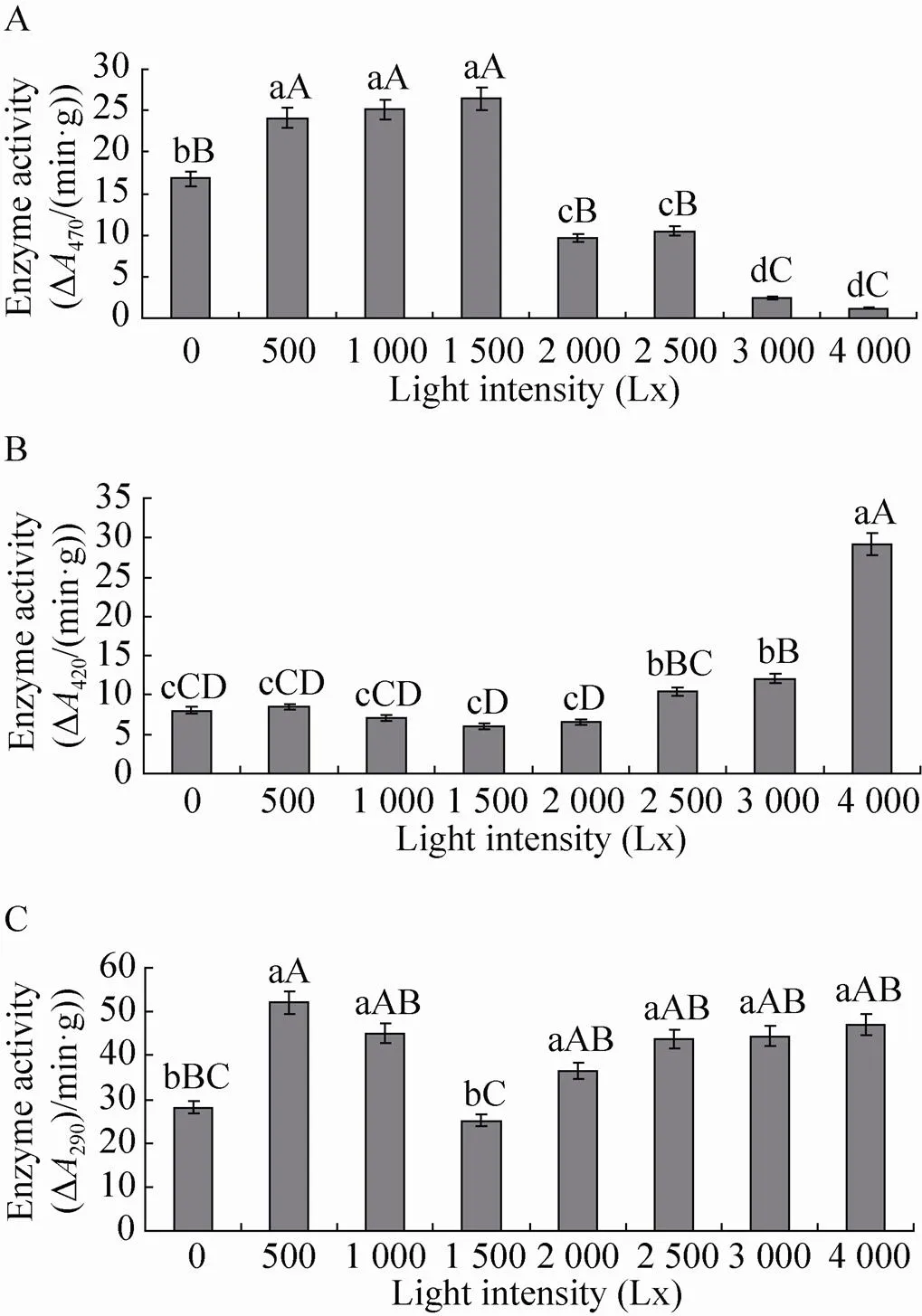
图4 不同光照强度下POD (A)、PPO (B) 和PAL (C)酶的活性
2.5 不同光照处理对POD、PPO和PAL酶基因表达量的影响
如图5所示,不同光照强度对、和酶基因的表达量均有一定程度的影响。 4 000 Lx光照强度处理酶基因表达量最高,与其他光照强度处理差异极显著 (<0.01),其他处理之间差异不显著 (>0.05),且光照强度1 500 Lx处理酶基因表达量仅为4 000 Lx光照强度处理的0.21倍;4 000 Lx光照强度处理酶基因表达量最高,且极显著高于其他处理(<0.01),3 000 Lx次之。0、500、1 000和1 500 Lx光照强度处理表达量较低,分别仅为4 000 Lx光照强度处理的0.18、0.18、0.16和0.19倍; 4 000 Lx光照强度处理酶基因表达量最高,极显著高于其他处理 (<0.01),1 000、2 000、2 500和3 000 Lx次之,0、500、1 500 Lx光照强度处理其表达量最低,其中1 500 Lx光照强度处理基因的表达量仅为4 000 Lx处理的0.48倍。
2.6 愈伤组织褐变率与酶活性及其表达量的相关性分析
如表5所示,褐变率与酶活性及酶基因表达量之间存在一定的相关性。褐变率与POD酶活性呈极显著负相关,与其表达量呈显著正相关,相关系数分别是–0.894和0.765;褐变率与PPO酶活性及其表达量均呈极显著正相关,相关系数分别是0.850和0.919,且PPO酶活性与其表达量亦呈现极显著正相关,相关系数为0.944;褐变率仅与基因表达量呈极显著正相关,相关系数为0.812。
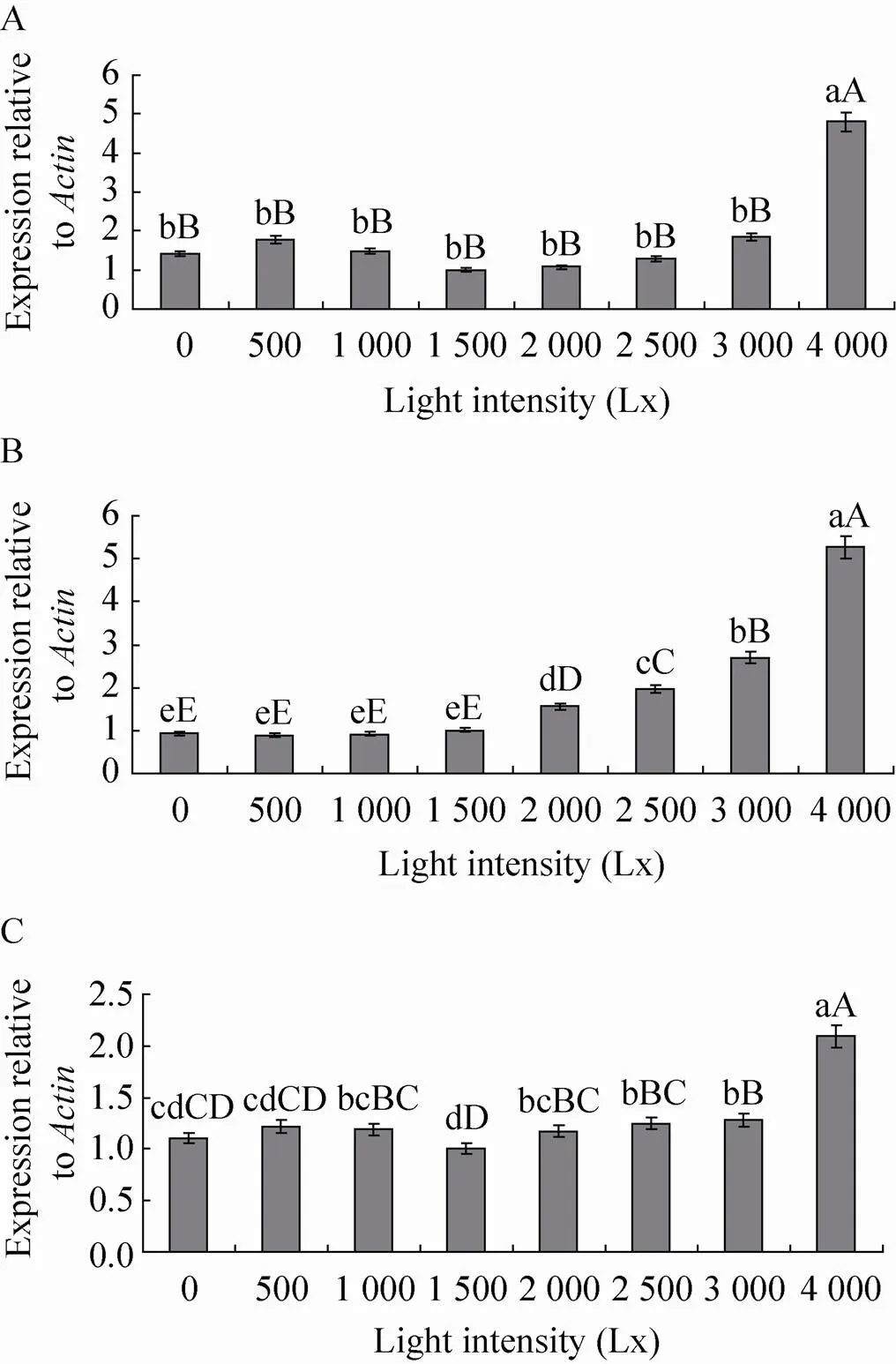
图5 不同光照强度下POD (A)、PPO (B) 和PAL (C)酶基因的表达量

表5 愈伤组织褐变率与酶活性及其表达量的相关性分析
X1: browning rate; X2: activity of POD; X3: expression of POD; X4: activity of PPO; X5: expression of PPO; X6: activity of PAL; X7: expression of PAL. **: correlation is significant at the 0.01 level, *: correlation is significant at the 0.05 level.
3 讨论
外植体褐变是组织培养初期面临的主要问题之一,有研究表明黑暗或者较低光照强度有利于愈伤组织的诱导,但不利于愈伤组织的生长[17-18],这与本试验的研究结果一致,愈伤组织在黑暗或弱光条件下呈乳白色或淡黄色可能由于某些生长相关的内源激素或色素的合成受到了抑制。增加光照强度会提高相关酶的活性,促进植物组织培养中多种酚类物质的氧化导致褐化程度加强[19]。这与酚类物质的合成和氧化相关的酶是光诱导型的有关[20],而酚类物质氧化为醌类物质是导致褐化的最直接原因之一[21]。
试验过程中未检测到没食子酸和儿茶酚,可能因为没食子酸和儿茶酚在葡萄愈伤组织中含量极低或不存在。绿原酸含量与褐化程度呈显著正相关,绿原酸的大量积累可能是造成葡萄愈伤组织褐变的一个重要因素,这与前人研究绿原酸是鲜切荸荠的主要褐变底物结果一致[22-23];对羟基苯甲酸、咖啡酸、香豆酸含量与褐化程度有密切关系,且随着褐化程度的增加对羟基苯甲酸的含量显著降低,这可能是因为对羟基苯甲酸是导致褐变的酚氧化酶的主要作用底物。褐化前后阿魏酸的含量变化不明显表明阿魏酸对愈伤组织褐化影响不大。
在1 000−1 500 Lx光照强度处理下愈伤组织诱导率较高,褐化程度较轻且生长势较好,这可能由于在该光照强度范围内尚未完全激活、和活性基因的表达,引起褐变的主要作用酶活性较小,故褐化程度较弱。当光照强度高于1 500 Lx时愈伤组织的褐化程度增加,此时PPO和PAL酶活性与酶基因的表达量均与褐化率呈极显著正相关。表明和酶基因上调表达可以显著提高PPO和PAL酶活性,PPO和PAL酶活性增强可能是引起愈伤组织褐变的主要原因,这与前人研究结果基本一致[24],但和酶基因是否直接参与了诱导褐变的发生,其作用仍有待进一步的验证。
光照强度是影响葡萄愈伤组织诱导和继代培养重要的外界环境因子,较高的光照强度会导致愈伤组织诱导率下降、褐化率增加;光照强度较低会影响愈伤组织生长情况。本试验条件下葡萄愈伤组织诱导及继代培养的适宜光照强度为1 000−1 500 Lx。
[1] Yao HJ, Luo XF, Tian YT. Development of explant browning researches. J Beijing Forest Univ, 1999, 21(3): 79–84 (in Chinese).姚洪军, 罗晓芳, 田砚亭. 植物组织培养外植体褐变的研究进展. 北京林业大学学报, 1999, 21(3): 79–84.
[2] Zhou JH, Zhou JR, Zeng HS, et al. Advance of studies on browning and antibrowning techniques in the tissue culture of horticultural plants. Acta Horticult Sin, 2000, 27(Suppl): 481–486 (in Chinese).周俊辉, 周家容, 曾浩森, 等. 园艺植物组织培养中的褐化现象及抗褐化研究进展. 园艺学报, 2000, 27(增刊): 481–486.
[3] Yang H, Xiulian G, Ran L, et al. Changes in morphology and biochemical indices in browning callus derived from Jatropha curcas hypocotyls. Plant Cell Tiss Organ Cult, 2009, 98(1): 11–17.
[4] Peter WT, Ian BD. Polyphenol oxidase in potato. Plant Physiol, 1995, 109(2): 525–531.
[5] Li XF, Gong ZH, Sun DQ, et al. The comparison of physiological indexes and the relation with browning in tissue culture about different peony species. Acta Agr Boreali-occidentalis Sin, 2008, 17(1): 142–145 (in Chinese).李新凤, 巩振辉, 孙冬青, 等. 不同品种牡丹几个生理参数的比较及其与组培中褐化的关系. 西北农业学报, 2008, 17(1): 142–145.
[6] Xu CJ, Li L. Changes of total phenol content and the activities of PPO, POD and PAL during the browning in phalaenopsis explant. Acta Horticult Sin, 2006, 33(3): 671–674 (in Chinese).许传俊, 李玲. 蝴蝶兰外植体褐变发生与总酚含量、PPO、POD和PAL的关系. 园艺学报, 2006, 33(3): 671–674.
[7] Coetzer C, Corsini D, Love S, et al. Control of enzymatic browning in potato (L.) by sense and antisense RNA from tomatopolyphenol oxidase. Agr Food Chem, 2001, 49 (2): 652–657.
[8] Liu LM, Liu HY, Tian BM. Analysis of POD activity and gene expression pattern in sesame infected with. J Henan Agr Sci, 2012, 41(8): 93–98 (in Chinese).刘莉铭, 刘红彦, 田保明. 茎点枯病菌诱导后芝麻过氧化物酶活性变化及其基因表达分析. 河南农业科学, 2012, 41(8): 93–98.
[9] Xu CJ, Li H, Li L. Phenylalanine ammonialyase () gene expression correlated withsp. leaf explant browning. J Trop Subtrop Bot, 2007, 15(1): 50–54 (in Chinese).许传俊, 李红, 李玲. 蝴蝶兰叶片外植体褐变过程中基因的表达变化. 热带亚热带植物学报, 2007, 15(1): 50–54.
[10] Hisaminato H, Murata M, Homma S. Relationship between theenzymatic browning and phenylalanine ammonia-lyase activity of cut lettuce, and the prevention of browning by inhibitors of polyphenol biosynthesis. Biosci Biotech Biochem, 2001, 65:1016–1021.
[11] Yu C, Yang X, Wang ZH, et al. Research on preparation method of protoplasts from callus of grape. J Fruit Sci, 2013, 30(3): 433–436 (in Chinese).俞超, 杨潇, 王忠华, 等. 葡萄愈伤组织制备原生质体的影响因素研究. 果树学报, 2013, 30(3): 433–436.
[12] Lü HT, Sun HF, Qu BH, et al. Smiultaneous determ ination of six phenolic compounds in apple juice by high performance liquid chromatography. Chin J Anal Chem, 2007, 35(10): 1425–1429 (in Chinese).吕海涛, 孙海峰, 曲宝涵, 等. 高效液相色谱法同时测定苹果汁中6种酚类物质. 分析化学, 2007, 35(10): 1425–1429.
[13] Wei JM, Zhu XQ, Liu CJ, et al. Changes of LOX, PPO and POD activities in sweet cherry fruit and effects of postharvest treatment on their activities. J Hebei Agr Sci, 2010, 14(1): 25–28, 60 (in Chinese).魏建梅, 朱向秋, 刘长江, 等. 甜樱桃果实LOX、PPO和POD活性变化特性及采后处理效应. 河北农业科学, 2010, 14(1): 25–28, 60.
[14] Zhen XL, Tian SP, Li BQ, et al. Changes in antioxidant systems and polyphenol oxidase activity in peach fruit treated with exogenous oxalic acid during storage at low temperature. Acta Horticul Sin, 2005, 32(5): 788–792 (in Chinese).郑小林, 田世平, 李博强, 等. 草酸对冷藏期间桃果实抗氧化系统和PPO活性的影响. 园艺学报, 2005, 32(5): 788–792.
[15] Wang Y, Xie H, Zhang ZQ, et al. Relationship between chilling injury of banana fruit stored at low temperature and PAL activity and soluble proteins. J Fruit Sci, 2004, 21(2): 149–152 (in Chinese).王勇, 谢会, 张昭其, 等. 香蕉果实贮藏冷害与PAL活性及可溶性蛋白的关系. 果树学报, 2004, 21(2): 149–152.
[16] Mei Z, Ping L, Guanglian Z, etal. Cloning and functional analysis of() genes encoding a key enzyme during abscisicacid biosynthesis from peach and grape fruits. J Plant Physiol, 2009, (166): 1241–1252.
[17] Ge FJ, Liu BY, Lu ZY, et al. Effects of light intensity on growth and phenolic contents of. Environ Sci Technol, 2012, 35(3): 30–34 (in Chinese).葛芳杰, 刘碧云, 鲁志营, 等. 穗花狐尾藻生长及酚类物质含量对光照强度的响应研究. 环境科学与技术, 2012, 35(3): 30–34.
[18] Liu HK, Han MY, Yu T, et al. Factors affecting embryonic callus from leaves of early season nectarine cultivars. J Fruit Sci, 2006, 23(3): 370–374 (in Chinese).刘航空, 韩明玉, 禹婷, 等. 影响油桃叶片产生胚性愈伤组织的因素. 果树学报, 2006, 23(3): 370–374.
[19] Scondahl MMR, Monaco LC, Sharp WR.methods applied to coffee//Trevor AT horpe Ed. Plant Tissue Culture Methods and Application in Agriculture. New York: Academic Press, 1981: 325–348.
[20] Marks TR, Simpson SE. Reduced phenolic oxidation at culture initia-tionin vitrofollowing the exposure of field-grown stock-plants to dark-ness or low level of irradiance. Hort Sci, 1990, 65: 103–111.
[21] Scorza R, Cordts JM, Gray DJ. Producing transgenic ‘Tompson Seedless’. J Amer Soc Hort Sci, 1996, 121(4): 616–619.
[22] Loaiza-Velarde JG, Mangrich ME, Campos-Vargas R, etal. Heat shock reduces browning of resh-cut celery petioles. Postharvest Biol Technol, 2003, 27(3): 305–311.
[23] Yin F, Ge H, Peng KQ, et al. The influence of phenols on tissue browning of. Acta Horticult Sin, 2006, 33(5): 1137–1140 (in Chinese).印芳, 葛红, 彭克勤, 等. 酚类物质与蝴蝶兰褐变关系初探. 园艺学报, 2006, 33(5): 1137–1140.
[24] Jiang CC, Chen GX, Pan DM, et al. Expression of three polyphenol oxidases during vegetative and reproductive development and in response to wounding in the prunus salicina. Acta Horticul Sin, 2012, 39(2): 363–369 (in Chinese).姜翠翠, 陈桂信, 潘东明, 等. 生长发育过程中和受机械损伤后基因的表达. 园艺学报, 2012, 39(2): 363–369.
(本文责编 郝丽芳)
Effects of light intensity on associated enzyme activity and gene expression during callus formation of
Rong Liu1, Guowei Yang1, Yueyan Wu1, Huiyun Rao1, Xuefu Li1,2, Meiqin Li1,2, and Pingxian Qian1
1College of Biology and Environment Sciences,Zhejiang Wanli University, Ningbo 315100,Zhejiang, China 2College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China
We analyzed the best light intensity for callus induction and maintenance inand explored the mechanism of grape callus browning. Tender stem segments of grape cultivar “gold finger” were used to study the effects of different light intensities (0, 500, 1 000, 1 500, 2 000, 2 500, 3 000 and 4 000 Lx) on the induction rate, browning rate and associated enzyme activity and gene expression duringcallus formation. The callus induction rate under 0, 500, 1 000 and 1 500 Lx was more than 92%, significantly higher than in other treatments (< 0.05). A lower browning rate and better callus growth were also observed during subculture under 1 000 and 1 500 Lx treatments. We found that chlorogenic acid, caffeic acid,-hydroxybenzoic acid and coumaric acid contents were correlated with the browning rate of callus, among which chlorogenic acid content was positively correlated with the browning rate (< 0.05). Peroxidase (POD) and polyphenol oxidase (PPO) activities were negatively correlated with the browning rate of callus (< 0.01). The,andphenylalanine ammonialyase () expression levels were positively correlated with the browning rate at< 0.05 or< 0.01. An appropriate light intensity for the tissue culture ofwas 1 000−1 500 Lx, higher or lower light intensities significantly impaired normal callus growth.
, callus, light intensity, induction rate, browning rate, enzyme activity, gene expression
10.13345/j.cjb.140494
October 20, 2014; Accepted:December 1, 2014
Science and Technology Innovation Team of Ningbo City (No. 2013C24002), Science and Technology Department of Zhejiang Province (No. 2011B82019), Major Science and Technology of Ningbo City (No. 2015C110016).
Yueyan Wu. Tel: +86-574-88222235; E-mail: wyynb2009@163.com
浙江省科技厅项目(No. 2013C24002),宁波市科技创新团队项目(No. 2011B82019),宁波市重大科技专项 (No. 2015C110016) 资助。
2015-05-13
http://www.cnki.net/kcms/detail/11.1998.Q.20150513.1529.001.html

