果汁DNA提取方法的比较
齐玲倩,刘秀,丁梦璇,李静媛,刘远远,尹建军
(中国食品发酵工业研究院,北京,100015)
果汁是一种重要的饮品,但如今果汁掺假问题日趋严重,如市场上存在着橙汁掺加柑橘汁、西柚汁、胡柚汁,苹果汁掺加梨汁、白葡萄汁,红色浆果汁掺加苹果汁及相互掺加等问题[1-2]。这损害了消费者的利益,阻碍了果汁行业的发展和国际贸易的进行,因此,果汁中水果成分的检测显得尤为重要。
分子生物学技术具有方便、准确、迅速、简洁的特点,能够准确无误地从基因水平分析果汁的品种和来源,其结果为证明果汁的真伪提供了可靠的依据。目前,分子生物学方法在中草药鉴定、肉类鉴别上均有应用,在果汁鉴伪领域亦有广阔的发展空间[1,3-4]。然而,应用分子生物学技术进行果汁鉴伪的关键是高质量DNA提取方法的建立。由于果汁富含多糖、多酚、单宁、色素及一些次生代谢物质,使得DNA提取困难,如多酚类物质能使DNA氧化成棕褐色凝胶状物,多糖类物质能与DNA结合成黏稠的胶状物[5-7]。目前,常见的果汁DNA提取方法有CTAB法、改良试剂盒法、改良 CTAB 法等[8-10]。李富威等[11-12]应用天根试剂盒提取木瓜汁、香蕉汁及食品中的DNA,建立了食品中木瓜和香蕉成分的基因检测方法,韩建勋等[13]使用改良CTAB法提取梨汁、苹果汁中的DNA,建立了果汁中梨成分的实时荧光PCR检测方法,但是,沈夏艳等[14]采用改良试剂盒法提取的澄清苹果汁DNA浓度较低,且果肉型苹果汁提取纯度也不高,Chang-Chai Ng等[15]采用改良CTAB方法可以提取鲜榨橙汁DNA,但不适合提取果汁饮料等的DNA。虽然从果汁中提取DNA的研究较多,但大部分集中在单一或较少种类的果汁上,且有效性不高,而关于多种果汁的高效通用DNA提取方法研究较少。
本文以汇源100%苹果汁等7种浑浊果汁和百森红苹果汁等6种澄清果汁为研究对象,对比CTAB法、试剂盒法、改良CTAB法提取果汁DNA的浓度、纯度及PCR扩增效率,以期获得高效通用的果汁DNA提取方法。
1 材料与方法
1.1 材料
果实样品1种,桃;浑浊果汁样品7种,包括鲜果粒苹果汁(A)、汇源100%桃汁(B)、汇源山楂汁(C)、兰芝蓝莓原浆(D)、鲜果粒橙汁(E)、茹梦芒果汁(F)、汇源100%梨汁(G);澄清果汁样品6种,包括百森红苹果汁(a)、汇源冰糖葫芦(b)、青苹果蓝莓汁(c)、康师傅鲜果橙(d)、汇源100%葡萄汁(e)、梨工场冰糖雪梨(f),均购于北京超市。
1.2 试剂
DNA提取试剂:CTAB裂解液(20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris-HCl,0.02 mol/L Na2EDTA,pH=8),CTAB 沉淀液(5 g/L CTAB,40 mmol/L NaCl),STE 核分离液(700 mmol/L NaCl,0.1 mol/L Tris-HCl,0.01 mol/L EDTA,20 g/L PVP-40(聚乙烯吡咯烷酮),pH=8),CTAB核裂解液(20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris-HCl,0.05 mol/L EDTA,20 g/L PVP-40,pH=8),1.2 mol/L NaCl溶液,3.2 mol/L NaCl溶液(pH=5.2),Tirs饱和酚/三氯甲烷(体积比25∶24),三氯甲烷/异戊醇(体积比24∶1)。其他试剂或溶剂均为分析纯级或生化纯级。
DP305植物基因组提取试剂盒:天根生化科技有限公司;PCR扩增采用的 Taq DNA聚合酶、Buffer、dNTPs,购于北京全式金生物有限公司;RNaseA,DNA Marker DL 2 000;PCR扩增引物,由英潍捷基(上海)生物有限公司合成。
1.3 主要仪器与设备
微量移液器,德国 Eppendorf公司;离心机(5804R型,5424型),德国 Eppendorf公司;超微量核酸蛋白分析仪(Biodrop),英国柏点公司;普通PCR扩增仪,英国BIOMETRA公司;电泳仪(JY-300C),北京君意仪器公司;凝胶成像仪,法国VILBER公司。
1.4 DNA提取方法
1.4.1 CTAB 法[16]
对于浊汁,取30 mL果汁于50 mL离心管中,8 679 r/min离心10 min,弃上清液;加入5 mL 65℃预热的CTAB提取缓冲液,振荡混匀,65℃温浴1 h,期间混匀几次;8 679 r/min离心15 min,将1 mL上清液移至新的2 mL离心管中,加入700 μL的三氯甲烷,振荡均匀,11 684 r/min离心10 min;吸取650 μL上清液移至2 mL离心管中,加入1.3 mL CTAB沉淀液,剧烈混匀,室温静置1 h;11 684 r/min离心10 min;加入350 μL NaCl(1.2 mol/L)溶液,剧烈振荡,再加入350 μL三滤甲烷,剧烈振荡,11 684 r/min离心10 min,吸取上清移至新的离心管中,加入0.8倍体积的异丙醇,-20℃静置30 min;11 684 r/min离心20 min,弃上清液,加入500 μL体积分数70%乙醇洗涤沉淀,11 684 r/min离心20 min;弃上清,将离心管倒置于超净工作台上10~15 min,吹干沉淀;用50 μL无菌超纯水溶解沉淀,-20℃保存备用。
对于清汁,取30 mL果汁至洁净培养皿中,真空干燥至剩余1 mL液体(若不足,加无菌超纯水补足),将液体转移至15 mL离心管中,加入5 mL 65℃预热的CTAB提取缓冲液,振荡混匀,65℃温浴1 h,期间混匀几次;其余步骤同浊汁。
1.4.2 试剂盒法
对于浊汁,取果汁1 mL装入2 mL离心管中,加入700~800 μL缓冲液GP1,涡旋振荡30 s。随后按照天根生化科技有限公司的植物基因组DNA提取试剂盒的步骤对样品进行DNA提取。
对于清汁,取30 mL果汁至洁净培养皿中,真空干燥至剩余1 mL液体(若不足,加超纯水补足),将液体转移至2 mL离心管中,加入700~800 μL缓冲液GP1,涡旋振荡30 s。随后按照天根生化科技有限公司的植物基因组DNA提取试剂盒的步骤对样品进行DNA提取。
1.4.3 改良CTAB法
对于浊汁,取果汁1 mL于2 mL离心管中,加入1 mL异丙醇,混匀,-20℃静置30 min,12 000 r/min,4 ℃,离心10 min,弃上清,在沉淀中加入600 μL STE核分离液,混匀,4℃,12 000 r/min离心10 min,弃上清,在沉淀中加入700 μL CTAB核裂解液,14 μL β-巯基乙醇,混匀,65℃温浴1 h,期间不时轻轻摇动离心管几次,取出后,加入等体积Tirs饱和酚/三氯甲烷,振荡混匀,静置5 min,4℃,12 000 r/min离心10 min,取上清,加入等体积的三氯甲烷/异戊醇,振荡混匀,静置5 min,4℃,12 000 r/min离心10 min,取上清,加入1/10体积3.2 mol/L NaCl,等体积预冷的异丙醇,混匀,-20℃静置1 h,4℃,12 000 r/min离心15~20 min,弃上清,70%乙醇洗沉淀2次,倒置晾干后加入50 μL无菌超纯水,混匀,-20℃保存。
对于清汁,取30 mL果汁于50 mL离心管中,11 000 r/min,4 ℃,离心 10 min,弃上清;向沉淀中加入3 mL STE核分离液,混匀,分2次转入2 mL离心管,4℃,12 000 r/min离心10 min,弃上清,在沉淀中加入 700 μLCTAB 核裂解液,14 μL β-巯基乙醇,混匀,65℃温浴1 h,期间不时轻轻摇动离心管几次,其余步骤同浊汁。
1.5 DNA提取质量的测定
取DNA溶液1 μL,用超微量核酸蛋白分析仪(Biodrop)测定以上3种方法提取的DNA在光波260 nm和280 nm处的紫外吸收值,通过OD260/OD280和浓度值判断DNA的纯度和浓度,每份样品重复测定3次。
用通用引物18SrDNA基因对提取的样品DNA进行扩增,以验证提取的果汁DNA分子是否适合于PCR分析,扩增片段长度为137 bp。
引物序列为:
18S rDNA-F:TCTGCCCTATCAACTTTCGATGGTA;
18S rDNA-R:AATTTGCGCGCCTGCTGCCTTCCTT。
扩增体系:DNA模板2 μL;10×PCR反应缓冲液2.5 μL;dNTPs(10 mmol/l)2 μL;上、下游引物(10 μmol/L)0.5 μL;Taq DNA 聚合酶 (5 U/μL)0.25 μL,用无菌水补至总体积为25 μL。扩增反应程序为:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,共40个循环;72℃延伸5 min。反应结束后,用2%琼脂糖凝胶电泳分析结果。
2 结果与分析
2.1 果汁DNA提取效率的比较
2.1.1 浑浊果汁DNA提取效率比较
用CTAB法、试剂盒法法以及改良CTAB法提取7 种浑浊果汁饮料(A、B、C、D、E、F、G)的基因组,用Biodrop超微量核酸蛋白分析仪测定以上3种方法提取的DNA的纯度和浓度,结果列于表1。
用超微量核酸蛋白分析仪测定在260 nm和280 nm处的紫外吸收值分别代表核酸、蛋白质等有机物的吸光度值。对于高质量的DNA样品,OD260/OD280应在1.8左右。当 OD260/OD280小于1.8时,说明DNA中存在蛋白质和酚类物质的污染;反之,说明DNA样品存在RNA或小分子核酸污染。从表1数据可以看出,除茹梦芒果汁(F)外,试剂盒法(天根植物基因组提取试剂盒)在其余浑浊果汁饮料的核酸提取上,效果不理想。CTAB法在提取鲜果粒橙汁(E)、茹梦芒果汁(F)DNA时,浓度较高,但纯度较差,而在其他果汁样品DNA提取时,浓度较低。改良CTAB法提取的DNA样品的OD260/OD280,相对另2种方法更接近1.8,且DNA浓度更高,说明使用改良CTAB法更适合提取浑浊果汁DNA,其中,应用改良CTAB法提取兰芝蓝莓原浆(D)的DNA时,浓度较低,可能是由于蓝莓中花青素含量过多,影响了核酸的释放。

表1 不同方法提取的浑浊果汁DNA浓度和纯度的比较(a±SD,n=3)Table 1 Comparison of purity and concentration of DNA extracted from juice nectar by different methods(a±SD,n=3)
2.1.2 澄清果汁DNA提取效率的比较
用CTAB法、试剂盒法以及改良CTAB法提取6种澄清果汁饮料(a,b,c,d,e,f)的基因组,用 Biodrop超微量核酸蛋白分析仪测定以上3种方法提取的DNA的纯度和浓度,结果列于表2。
从表2数据可以看出,试剂盒法(天根植物基因组提取试剂盒)无法提取到6种澄清果汁饮料中的核酸。CTAB法提取的青苹果蓝莓汁(c)和康师傅鲜果橙(e)DNA,浓度相对较高,但纯度较差,而提取的其他澄清果汁样品DNA,浓度较低,纯度也较差,且无法提取到汇源100%葡萄汁(e)的DNA。改良CTAB法提取的澄清果汁的 DNA,浓度相对更高,OD260/OD280相对更接近1.8,说明改良CTAB法是较为合适的澄清果汁DNA提取方法。其中,应用改良CTAB法提取百森红苹果汁(a)和梨工场梨汁(f)的DNA时,浓度较低,可能是由于多酚类物质氧化物的存在,影响了核酸的释放。
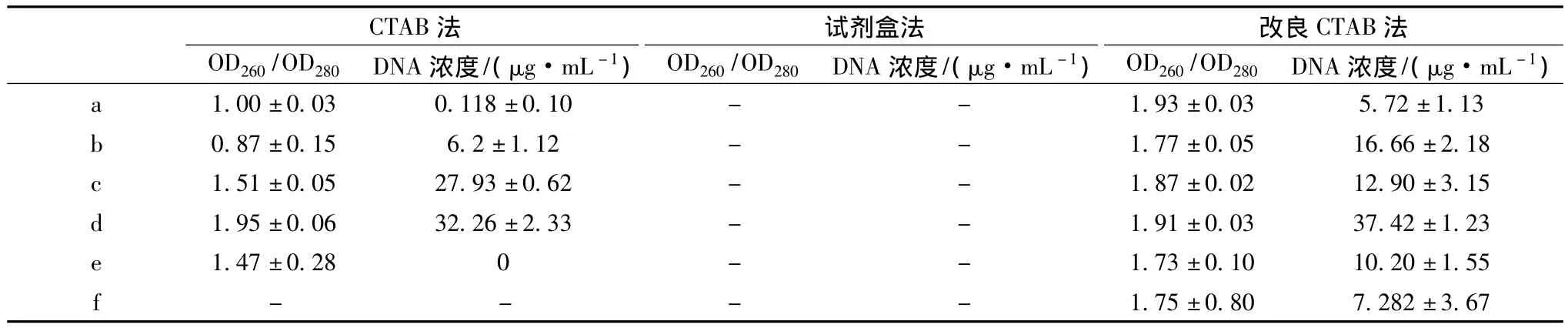
表2 不同方法提取的澄清果汁DNA浓度和纯度的比较(a±SD,n=3)Table 2 Comparison of purity and concentration of DNA extracted from clarified fruit juice by different methods(a±SD,n=3)
2.2 PCR扩增结果
以桃果肉DNA作为阳性对照,细菌DNA作为阴性对照,用通用引物18Sr DNA基因对CTAB法、试剂盒法和改良CTAB法提取的7种浑浊果汁饮料和6种澄清果汁饮料的基因组DNA进行PCR检测,琼脂糖凝胶电泳结果见图1~图3。
对比图1~图3可知,相对于CTAB法和试剂盒法,改良CTAB法提取的浑浊果汁DNA样品,均可扩增出18SrDNA基因的对应条带,且条带较为清晰、明亮,但3号、4号条带相对较暗,这可能是汇源山楂汁(C)和兰芝蓝莓原浆(D)相对较低的DNA浓度导致的;同时,3种方法中,只有改良CTAB法提取的澄清果汁DNA样品,对18Sr DNA基因的137 bp大小的目的片段均出现阳性扩增,但由于澄清果汁DNA含量普遍较低,故扩增出的目的条带较阳性条带暗。
综上,改良CTAB法提取的浑浊果汁和澄清果汁基因组DNA均可用于后续的PCR检测研究。
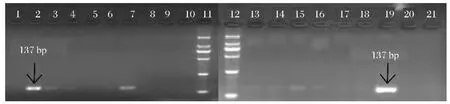
图1 CTAB法提取的果汁基因组18SrDNA基因PCR电泳检测图谱注:1.空白对照:无菌超纯水;2.阳性对照:桃;3.汇源100%苹果汁(A);4.汇源100%桃汁(B);5.汇源山楂汁(C);6.兰芝蓝莓原浆(D);7.鲜果粒橙汁(E);8.茹梦芒果汁(F);9.汇源100%梨汁(G);10.阴性对照:细菌;11、12.DNA相对分子质量标记(2000);13.百森红苹果汁(a);14.汇源冰糖葫芦(b);15.青苹果蓝莓汁(c);16.康师傅鲜果橙(d);17.汇源100%葡萄汁(e);18.梨工场冰糖雪梨(f);19.阳性对照:桃;20.阴性对照:细菌;21.空白对照:无菌超纯水。Fig.1 Electrophoresis profile of PCR productsof 18SrDNA gene primer in different juice DNA samples extracted by the CTAB method
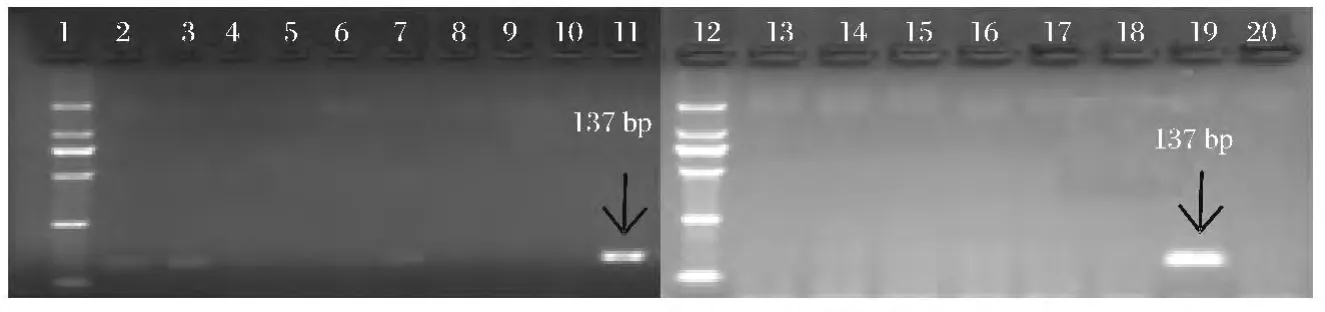
图2 试剂盒法提取的果汁基因组18SrDNA基因PCR电泳检测图谱注:1.DNA相对分子质量标记(2000);2.汇源100%苹果汁(A);3.汇源100%桃汁(B);4.汇源山楂汁(C);5.兰芝蓝莓原浆(D);6.鲜果粒橙汁(E);7.茹梦芒果汁(F);8.汇源100%梨汁(G);9.空白对照:无菌超纯水;10.阴性对照:细菌;11.阳性对照:桃;12.DNA相对分子质量标记(2000);13.百森红苹果汁(a);14.汇源冰糖葫芦(b);15.青苹果蓝莓汁(c);16.康师傅鲜果橙(d);17.汇源100%葡萄汁(e);18.梨工场冰糖雪梨(f);19.阳性对照:桃;20.空白对照:无菌超纯水。Fig.2 Electrophoresis profile of PCR products amplifiedby 18SrDNA gene primer in different juice DNA samples extracted by the DNA extraction kit method
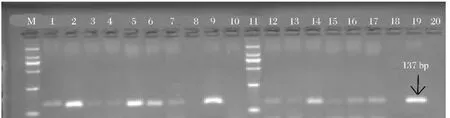
图3 改良CTAB法提取的果汁基因组18SrDNA基因PCR电泳检测图谱注:M.DNA相对分子质量标记(2000);1.汇源100%苹果汁(A);2.汇源100%桃汁(B);3.汇源山楂汁(C);4.兰芝蓝莓原浆(D);5.鲜果粒橙汁(E);6.茹梦芒果汁(F);7.汇源100%梨汁(G);8.空白对照:无菌超纯水;9.阳性对照:桃;10.阴性对照:细菌;11.M.DNA相对分子质量标记(2000);12.百森红苹果汁(a);13.汇源冰糖葫芦(b);14.青苹果蓝莓汁(c);15.康师傅鲜果橙(d);16.汇源100%葡萄汁(e);17.梨工场冰糖雪梨(f);18.空白对照:无菌超纯水;19.阳性对照:桃;20.阴性对照:细菌。Fig.3 Electrophoresis profile of PCR products amplifiedby 18SrDNA gene primer in different juice DNA samples extracted by the modified CTAB method
3 讨论
本实验采取3种DNA提取方案从浑浊果汁和澄清果汁中提取DNA,通过比较DNA的纯度、浓度,检验DNA的PCR扩增效率,确定了提取效率较高的方法-改良CTAB法,该方法从前处理方法、裂解液成分和异丙醇沉淀时间等方面对DNA提取方法存在的问题进行了改进。首先,考虑到果汁中DNA含量相对较少,故对浑浊果汁采用异丙醇沉淀的方法对DNA进行富集,对澄清果汁采取离心浓缩的方法进行富集,简单易行,且提高了DNA的得率。其次,果汁样品受次生代谢物质的影响,致使DNA有限释放,故在果汁样品裂解前,预加核分离液去除部分多糖、多酚、色素等杂质,方便有效。再次,为抑制果汁中的多酚氧化并与DNA结合造成的褐变,在裂解液(700 μL)中加入20g/L PVP-40与体积分数2%β-巯基乙醇,从而提高样品DNA的质量以及PCR扩增效率。最后,异丙醇沉淀时间对DNA纯度有重要影响[17],沉淀时间越长,DNA浓度越高但纯度越低,考虑到果汁DNA的浓度、纯度以及提取过程的时耗,选择在-20℃下沉淀1 h。
最终建立的浑浊果汁和澄清果汁DNA的有效提取方法,简化了实验步骤和时间,提高了DNA的提取效率,可为以后的果汁真实性基因检测提供参考。
[1] 苏光明,胡小松.果汁鉴伪技术研究新进展[J].食品与发酵工业,2009,35(6):151-156.
[2] 陈颖.话说我国果汁业中的掺假问题[J].中国果业信息,2013,30(6):39-41.
[3] 陈颖,吴亚君.基因检测技术在食品物种鉴定中的应用[J].色谱,2011,29(7):594-600.
[4] HAN Jian-xun,WU Ya-jun,HUANG Wen-sheng,et al.PCR and DHPLC methods used to detect juice ingredient from 7 fruits[J].Food Control,2012,25(2):696-703.
[5] 段婧婧,肖琳,陈军.用于转基因检测的水果果肉总DNA 提取法[J].食品科学,2009,30(3):231-234.
[6] 沈夏艳,陈颖,黄文胜,等.果汁鉴伪技术及其研究进展[J].检验检疫科学,2007,4(17):63-66.
[7] 高媛,杜国强,师校欣.适于转基因苹果种子和果肉总DNA提取的方法[J].中国农学通报,2010,26(16):238-241.
[8] 刘伟红,许文涛,商颖,等.果汁DNA提取方法比较及柑橘属植物分子生物学检测技术的研究[J].中国食品学报,2012,12(4):195-201.
[9] 任君安,王国兰,程曦,等.果蔬汁饮料DNA提取方法的比较研究[J].食品科技,2013,38(2):42-45.
[10] 孙建霞,白卫滨,曹春廷,等.苹果汁和桃汁种类特异性PCR检测方法的研究[J].食品工业科技,2014,35(7):288-291.
[11] 李富威,张舒亚,叶军,等.食品中木瓜成分实时荧光PCR检测方法[J].食品研究与开发,2013,34(11):51-56.
[12] 李富威,张舒亚,叶军,等.实时荧光聚合酶链式反应检测食品中香蕉成分[J].食品科学,2013,34(12):243-246.
[13] 韩建勋,黄文胜,吴亚军,等.果汁中梨成分分子生物学鉴伪-实时荧光PCR方法研究[J].中国食品学报,2010,10(1):207-213.
[14] 沈夏艳,陈颖,葛毅强,等.苹果汁中DNA提取方法的比较及 RAPD扩增研究[J].中国食品学报,2008,8(2):18-23.
[15] NG Chang-chai,CHANG Chen-chin,WU Chi-chi,et al.Rapid molecular identification of freshly squeezed and recon-stituted orange juice[J].Int J Food Sci Technol,2006,41(6):646-651.
[16] SN/T 3729-2013.出口食品及饮料中常见水果品种的鉴定方法[S].
[17] Sonia Ramos-Gómez,María D.Busto,Manuel Perez-Mateos,et al.Development of a method to recovery and amplification DNA by real-time PCR from commercial vegetable oils[J].Food Chemistry,2014,158(5):374-383.

