粪肠球菌耐热型保护剂的筛选及加速储存稳定性研究
李卫娟,王计伟,王宇霄,刘春雪,洪平
(安佑生物科技集团股份有限公司,江苏 太仓,215437)
粪肠球菌是从动物肠道里分离出来的一种具有良好生物安全性及益生特性的肠道益生菌,可直接参与宿主的物质代谢。其生长速度快,每19 min分裂1次,代谢过程中会分泌L-型乳酸、肠球菌素等非特异性免疫调节因子,并产生多种对动物生长有利的营养物质[1-2],因而常作为微生物饲料添加剂来增强动物肠道健康。然而其耐热稳定性较差,经饲料高温制粒及贮藏后,活菌数大大下降。一般来讲,饲料中益生菌的数量应在106/g以上才能使其顺利到达肠道并发挥作用[3],因此需要对提高粪肠球菌耐热稳定性的技术进行研究。
目前国内外在提高益生菌热稳定性方面已开展了大量的研究,主要包括菌种诱变、基因改造、微胶囊、保护剂等技术。关于保护剂方面的研究多集中于液态发酵的益生菌,关于固态发酵的益生菌保护剂的研究则相对较少。采用固态发酵生产的益生菌在稳定性方面通常较液态发酵的益生菌要好,一方面固态发酵基质可作为营养基质,另一方面可作为包埋基质对菌体进行包埋保护[4]。为了验证保护剂的保护效果,最可靠的方法是常温贮藏。但历时较长,为了快速获得结果,常采用加速储存稳定性试验。加速储存稳定性试验常用于预测冻干的动植物病毒及不同的微生物储藏稳定性,以便在短时间内获得储藏数据[5-6]
本研究在固态发酵的基础上优化粪肠球菌耐热型保护剂配方,并通过加速储存试验,建立储存稳定性方程来预测其储存寿命,为工业化生产中该产品有效活菌数的快速预测提供理论依据。
1 材料与方法
1.1 试验材料
粪肠球菌(Enterococcus faecalis):中国工业微生物菌种保藏管理中心。
海藻糖为食品级,美国RSG公司;抗坏血酸钠、甘油为分析纯;脱脂奶粉,伊利高蛋白脱脂高钙奶粉。
种子培养基(g/L):蛋白胨10.0,牛肉膏10.0,酵母膏5.0,柠檬酸氢二铵2.0,葡萄糖20.0,乙酸钠5.0,K2HPO42.0,MgSO40.58,MnSO40.25,蒸馏水1 L,加入吐温80 1.0 mL,pH 6.26,121 ℃灭菌15 min。
固态发酵培养基(g/kg):麦麸940,豆粕40,玉米粉20,121℃灭菌30 min。
营养液(g/kg固态发酵培养基):酵母膏2.5,蛋白胨 5.0,葡萄糖 10.0,牛肉膏 3.0,MgSO40.5,K2HPO40.5,500 mL自来水溶解,121℃灭菌15 min。
检测培养基(g/L):蛋白胨10,牛肉膏5,葡萄糖20,NaCl 5,琼脂粉15,pH 6.5,121 ℃灭菌 15 min。
1.2 粪肠球菌耐热型保护剂的筛选
1.2.1 粪肠球菌固态发酵样品制备
将活化后的种子液以10%的接种量与营养液一起接种至固态发酵培养基中,混匀后于37℃培养12 h。
1.2.2 保护剂的优化
根据前期试验结果及文献资料[7-12],选用甘油、海藻糖、脱脂奶粉、抗坏血酸钠作为保护剂的成分,采用正交试验对保护剂的配比进行优化。试验设计见表1。将各组成分以少许等量无菌水溶解后,分别与发酵完毕的粪肠球菌样品混匀,40℃烘干收集。
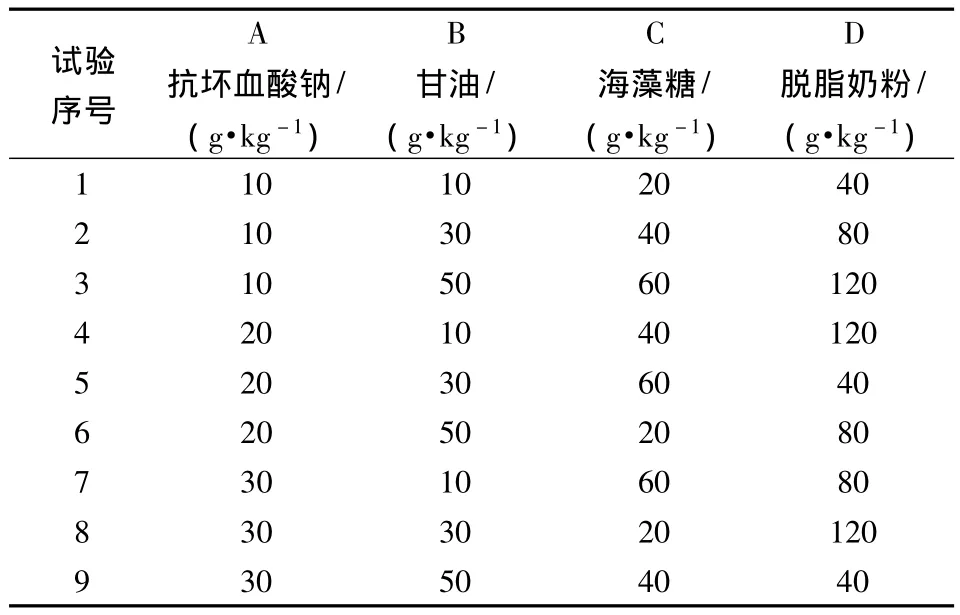
表1 保护剂筛选正交试验设计Table 1 The orthogonal experimental design for protectants screen
1.2.3 耐热型复合保护剂保护效果评价
采用人工耐热性试验对上述各试验组保护剂的保护效果进行评价。测定方法:将含有225 mL无菌生理盐水的三角瓶置于60℃水浴锅中预热20~30 min,使瓶内温度与水浴锅温度一致,分别称取25 g样品加至相应的三角瓶中,处理5 min后迅速冰浴冷却,20℃ 200 r/min 0.5 h后通过梯度稀释法测定活菌数。以未经水浴处理的作为对照组。

1.3 粪肠球菌加速储存稳定性试验
将加入最佳保护剂配方的粪肠球菌样品置于不同温度下储存,按照试验设计(见表2)中的时间取样测定活菌数。
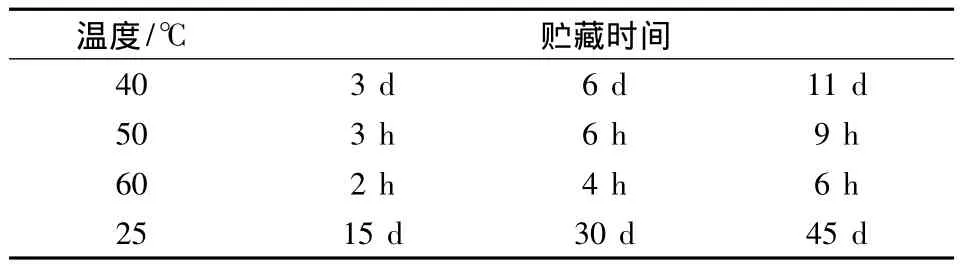
表2 加速储存稳定性试验分组Table 2 The experimental design for the accelerated storage test
以40、50、60℃下样品的残余菌数的对数值为纵坐标,放置时间为横坐标作图,得到该粪肠球菌样品的模拟一级热降解图,由此得到对应温度下样品的热降解速率K。以热降解速度K的对数值为纵坐标,温度(绝对温度)的倒数为横坐标作图,得到一元线性回归方程,继而推算出某一温度下的热降解速率常数,结合一级反应动力学方程推导出该温度下贮存一段时间后的残余菌数。为验证方程的有效性,将添加保护剂的粪肠球菌固态发酵样品于25℃贮藏,分别于15、30、45天取样测定活菌数以验证方程的有效性。
2 结果与讨论
2.1 粪肠球菌耐热型保护剂的筛选
本研究选用脱脂奶粉、海藻糖、甘油、抗坏血酸钠4种保护剂,根据参考文献常见添加水平设计正交试验,结果见表3。从表3可以看出,各因素对粪肠球菌稳定性的影响水平大小为:脱脂奶粉>抗坏血酸钠>海藻糖>甘油,最佳组合为A1B2C2D2,即抗坏血酸钠 10 g/kg、海藻糖 30 g/kg、甘油 40 g/kg、脱脂奶粉80 g/kg。经验证,60℃水浴处理5 min后平均存活率为75%(3个平行存活率分别为71%,76.74%,78%),与未添加保护剂的对照组(3个平行存活率分别为51.92%,49%,46.29%)相比差异极显著(P=0.000 6<0.01)。

表3 粪肠球菌耐热型保护剂筛选正交试验结果Table 3 Results of the orthogonal experiment for protectants screen of E.faecalis
目前可作为微生物保护剂的物质通常包括脱脂奶粉、明胶、蔗糖、海藻糖、甘油、谷氨酸钠等。研究表明,脱脂奶粉中的乳清蛋白尤其是酪蛋白在干燥时,可以在菌体表面形成一层蛋白膜,对细胞加以保护。而抗坏血酸钠则作为水溶性强抗氧化剂,减少菌体在干燥或贮存过程中环境中氧气对菌体的影响[13]。甘油作为一种可渗透至细胞内部的保护剂,通过进入细胞内部,维持细胞内外渗透压平衡,从而减轻细胞由于温度升高引起的细胞损伤。在多种保护剂的共同作用下,菌体在干燥及保存过程中受外界不良环境的影响降低。孙盈等人对混合乳酸菌的最佳耐热冻干保护剂进行了研究,确定其最佳冻干保护剂配方为脱脂奶粉10%、聚乙烯吡咯烷酮5%、海藻糖5%、VC0.5%,冻干存活率预测值可达93.05%[9]。
2.2 粪肠球菌加速储存稳定性试验
低温留样观察是测定产品储存稳定性的一种重要方法,但储存时间往往较长,可通过加速储存稳定性试验来对产品的稳定性进行初步研究。按照1.3中的试验方法进行试验,以储存一段时间后的菌数N的对数值为纵坐标,储存时间为横坐标作图,结果见图1。从图1可以看出,添加保护剂的粪肠球菌固态发酵样品在40,50,60℃的热降解速度 K分别为-0.002,-0.009,-0.061。

图1 粪肠球菌残余菌数与贮藏温度和时间的关系图Fig.1 Graphic correlation between survival of E.faecalis and the time at different temperature
以添加保护剂的粪肠球菌固态发酵样品在40,50,60℃的热降解速度K的对数值为纵坐标,温度(绝对温度)的倒数为横坐标作图(见图2),得到一元线性回归方程:lgK=-7 730/T+21.95,通过该方程可计算出25℃下粪肠球菌固态发酵样品的热降解速率常数为-1.06×10-4,4℃热降解速率常数为-1.15×10-6。张英华等[12]对加入冷冻干燥保护剂的乳酸菌进行了加速储存稳定性研究,通过方程推导出4℃的热降解速率为-1.656×10-4,本研究中粪肠球菌4℃的热降解速率约为其1/100,具有更好的热稳定性。

图2 粪肠球菌热降解速率与温度的关系图Fig.2 The correlation between the thermal degradation rate and temperature of Enterococcus faecalis
为验证方程的有效性,将添加保护剂的粪肠球菌固态发酵样品于25℃分别贮存15,30,45 d并测定残余活菌数,与预测结果进行比较,结果见表4。从表4可以看出,贮存15,30天的实际结果与预测结果极为接近,精确率接近100%,贮存45天的实际结果与预测结果相比,精确率达到为90.6%,因此可用该方程来预测某一温度下储藏一定时间之后样品的残余菌数。
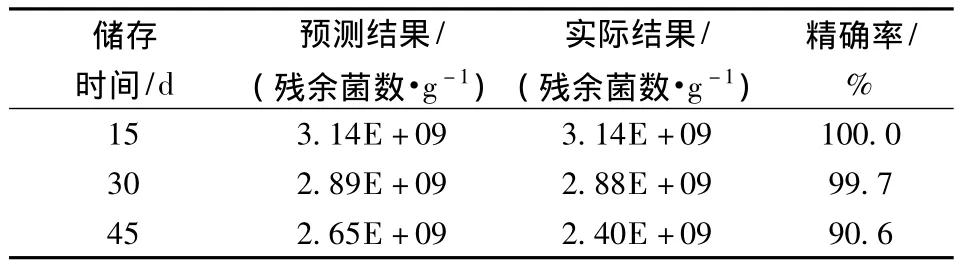
表4 25℃下储存稳定性方程有效性验证结果Table 4 The results of validity verification for the storage stability equation at 25℃
3 结论
通过正交试验优化结果,确定粪肠球菌耐热型保护剂配方为:抗坏血酸钠10 g/kg、海藻糖30 g/kg、甘油40 g/kg、脱脂奶粉80 g/kg。加入该保护剂的粪肠球菌样品经60℃处理5 min后平均存活率为75%,与未添加保护剂的对照组相比差异极显著(P<0.01)。分别于40,50,60℃对添加保护剂的粪肠球菌样品进行加速储存试验,并建立了储存稳定性方程:lgK=-7 730/T+21.95,根据该方程可知粪肠球菌25℃热降解速率为-1.06×10-4。将样品于25℃分别贮存15,30,45 d,测定残余活菌数,并与预测理论值比较,接近程度在90%以上,验证了方程的有效性。
[1] 丁岚峰,时胜远.赐美健SF68在饲料业中的应用[J].黑龙江畜牧兽医,1998(12):17-18.
[2] 李毅,王国良,赵海明,等.粪肠球菌优C100在肉鸡生产中的应用效果试验[J]中国畜牧业,2013(23):54-55.
[3] 刘文彬,马秋刚,邓程君,等.微囊包被处理屎肠球菌制粒耐受性的评价[J]中国农业科学2012,45(6):1 169-1 175.
[4] 钟启平,杨林海.高密度粪肠球菌及其发酵培养工艺[P].中国:102286417A,2011-12-21.
[5] Yordanova A,Stoimenova E,Donev T.Prediction of the preservation of freeze-dried cucumber mosaic virus[J].Biotechnology Letters,2000,22(22):1 779-1 782.
[6] Koshelev A V,Nestorov A.In express test for predicting the survival of freeze-dried methanotrophous bacterial cul-tures[J].Mikrobiologia,1987(56):492-496.
[7] 骆承庠,吕加平.乳酸菌发酵剂冻干保护剂筛选及应用的研究[J].东北农业大学学报,1998,29(4):371-379.
[8] 苏萍,董英,程新,等.植物乳杆菌冻干保护剂的优化及其保护机制[J].中国食品学报,2014,14(11):56-63.
[9] 孙盈,黄金海,李莹,等.耐热型复合乳酸菌冻干保护剂的研究[J].中国乳品工业,2011,39(4):12-15.
[10] 胥振国,蔡玉华,向敏,等.冻干高活力纳豆芽胞杆菌菌粉保护剂的筛选和优化[J].微生物学通报,2013,40(5):822-828.
[11] 徐丽萍.嗜酸乳杆菌冻干菌粉保护剂选择的研究[J].食品工业科技,2007(5):119-122.
[12] 张英华,霍贵成,郭鸰.乳酸菌冷冻干燥保护剂的筛选及加速储存稳定性试验[J].中国乳品工业,2007,35(2):8-10.
[13] WANG W.Lyophilization and development of solid protein pharmaceuticals[J].International Journal of Pharmaceutics,2000,203(1-2):1-60.

