泡菜中1株高产γ-氨基丁酸且具有抗菌性乳酸菌株的筛选和鉴定*
刘文丽,刘洪霞,张传香,柳全文,贡汉生,邢少华
1(鲁东大学食品工程学院,山东 烟台,264025)
2(深圳市华测检测技术股份有限公司上海分公司,上海,201206)
泡菜是一种传统的乳酸发酵食品,具有维持人体消化道健康、减肥、抗肿瘤、抗病毒、预防心脑血管疾病等功能[1]。乳酸菌是泡菜自然发酵过程中最重要的优势菌群,其种类和数量对泡菜的品质起到了关键性作用[2-3]。泡菜中含有许多功能性乳酸菌株,包括产胞外多糖菌株、抗菌性菌株、耐酸性菌株、抗氧化菌株等[4-5],泡菜的许多功能性被认为与乳酸菌及其代谢产物息息相关[2,6]。
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种天然存在的四碳非蛋白质氨基酸[7],对中枢神经性疾病、高血压、癌症、糖尿病、人体免疫力等都具有调节作用[8-11]。2009年9月,卫生部批准GABA为新资源食品,可用于饮料、可可制品、焙烤食品及膨化食品等,为GABA在国内的应用提供了依据[12]。GABA在动植物组织中分布广泛,但含量较低[13]。除植物富集外,食品级GABA主要通过微生物谷氨酸脱羧酶(glutamate decarboxylase,GAD)作用底物谷氨酸生产[14]。利用乳酸菌发酵生产GABA是一种比较安全理想的生产方式,而且越来越多的乳酸菌株被发现具有GAD酶活性,如短乳杆菌(Lactobacillus brevis),乳酸乳球菌(Lactococcuslactis),副干酪乳杆菌(Lactobacillus paracasei),植物乳杆菌(Lactobacillus plantarum),布氏乳杆菌(Lactobacillus buchneri),米酒乳杆菌(Lactobacillus sakei)以及唾液链球菌嗜热亚种(Streptococcus salivarius ssp.thermophilus)等[15],这些菌株分别分离自泡菜、新鲜牛奶、奶酪、发酵鱼肉、马奶酒等不同的食品。利用微生物发酵生产GABA,具有成本低、含量高及安全可用于食品的优点[8]。筛选具有产GABA能力的乳酸菌株,并将其重新应用于发酵食品,或利用优良菌株生产GABA作为功能性食品因子[8]具有非常重要的意义。
乳酸菌发酵过程中产生多种天然抑菌物质,包括酸类、醇类、双乙酰、过氧化氢和乳酸菌素等[16]。乳酸菌发酵形成的酸性环境和产生的抗微生物活性物质对腐败菌和致病菌具有较强的控制作用[2]。由于乳酸菌的这些特性,可以将乳酸菌或其相关代谢产物应用于发酵食品中腐败菌或致病菌的控制,以及各种食品的贮藏保鲜中[17]。
本研究从泡菜中分离筛选出高产GABA的乳酸菌株,对其抗菌特性进行了研究,以期为食品级GABA的生产以及相关发酵食品的开发提供理论基础。
1 材料与方法
1.1 实验菌株
实验室保藏乳酸菌82株,均分离自泡菜。
抑菌用指示菌株:藤黄微球菌(Micrococcus luteus)ATCC13513、枯草芽孢杆菌(Bacillus subtilis)ATCC6633、蜡状芽孢杆菌(Bacilluscereus)ATCC27348、植物乳杆菌(Lactobacillus plantarum)ATCC8014、单增李斯特菌(Listeria monocytogenes)ATCC19113、副溶血性弧菌(Vibrio parahaemoliticus)ATCC27969、大肠杆菌(Escherichia coli)ATCC25922。
1.2 培养基
乳酸菌选用MRS培养基:葡萄糖20.0 g/L,蛋白胨10.0 g/L,牛肉膏10.0 g/L,酵母提取物 5.0 g,吐温-80 1.0 g/L,乙酸钠5.0 g/L,磷酸二钠2.0 g/L,柠檬酸三铵2.0 g/L,MgSO40.1 g/L,MnSO40.05 g/L;调pH值至6.5左右,121℃灭菌15 min。
单增李斯特菌选用BHI培养基、副溶血性弧菌选用TSA培养基,青岛海博生物技术有限公司;其他指示菌选用营养肉汤培养基,北京奥博星公司。
1.3 试剂
过氧化氢酶、胃蛋白酶、GABA(纯度≥99%)、异硫氰酸苯酯(protein sequencing grade)、三乙胺(纯度≥99%),美国Sigma公司;谷氨酸钠(生化试剂纯),国药集团化学试剂有限公司;乙腈(色谱纯),美国Fisher公司;其他试剂均为国产分析纯。
1.4 仪器与设备
pB-10型pH计,新锐仪表仪器有限公司;薄层层析硅胶板,青岛海洋化工厂分厂;高效液相色谱系统,日本岛津公司;C18色谱柱(250 mm×4.6 mm I.D.,particle size 5 μm),美国 Phenomenex 公司;游标卡尺,哈尔滨量具刃具集团有限责任公司;PCR扩增仪,杭州博日科技有限公司;细菌基因组提取试剂盒,天根生化科技有限公司。
1.5 实验方法
1.5.1 菌株活化及培养
将-80℃冰箱内保藏的乳酸菌株在4℃下融化,在MRS固体培养基上划线培养,30℃下培养48 h,挑取单一菌落接种于MRS液体培养基中,30℃培养24 h。
1.5.2 产GABA乳酸菌的筛选
将活化后的菌株按体积分数1%的接种量接种于含10 g/L谷氨酸钠(sodium glutamate,MSG)的MRS培养基中,30℃培养24 h。将培养液在6 000×g条件下离心10 min,收集上清液。利用薄层层析法定性测定上清液中GABA的生产情况,展开剂为V(正丁醇)∶V(醋酸)∶V(水)=4∶1∶5,显色剂为 5 g/L的茚三酮-乙醇溶液[18]。
1.5.3 菌株的一般特性
对菌株进行过氧化氢酶试验;革兰氏染色后用显微镜观察其形态并记录。
将活化后的菌株接种于MRS液体培养基中,30℃培养24 h,用PB-10型pH计测定培养液的pH值。
1.5.4 GABA 的定量测定[18]
将产GABA的乳酸菌株按体积分数为1%的接种量,接种于含10 g/L或50 g/L MSG的MRS液体培养基中,30℃下分别培养24、48和72 h,将培养液在6 000×g条件下离心10 min,收集上清液。上清液经异硫氰酸苯酯(phenylisothiocyanate,PITC)衍生并通过0.45 μm滤膜过滤,采用高效液相色谱法测定GABA的含量。色谱柱为C18(250 mm×4.6 mm,5 μm);流动相A为1.4 mmol/L乙酸钠、体积分数为0.1%的三乙胺和体积分数为6%的乙腈(调节pH为6.1),流动相B为体积分数为60%的乙腈;流速为1.0 mL/min;流动相B按线性梯度0~100%洗脱20 min。柱温46℃;紫外检测波长为254 nm。
GABA转化率按(1)式计算:

式中,MS0为底物中MSG的摩尔数;MS为产物中MSG的摩尔数。
1.5.5 抗菌性实验
采用滤纸片-琼脂扩散法[19]筛选具有抑菌活性的菌株,无菌水作为阴性对照。指示菌选用藤黄微球菌、枯草芽孢杆菌、蜡状芽孢杆菌、植物乳杆菌、单增李斯特菌、副溶血性弧菌和大肠杆菌。抑菌环直径用游标卡尺测量,抑菌环直径3~6 mm、6~10 mm、10 mm,以上3个范围分别用+、++、+++表示其抑菌能力。
1.5.6 抑菌物质的初步鉴定[20-21]
使用3 mol/L的NaOH调PD1-2发酵上清液pH值至7.0,排除有机酸干扰。将1 mol/L的过氧化氢酶、胃蛋白酶分别加入PD1-2发酵上清液中,37℃培育2 h,以枯草芽孢杆菌为指示菌,通过1.5.5的抗菌性实验,观察处理前后发酵上清液抑菌情况的变化。
1.5.7 糖发酵实验
将筛选的乳酸菌株接种于MRS培养基中,30℃培养24 h。培养液于6 000×g条件下离心10 min,收获菌体并用无菌生理盐水洗涤、重悬菌体制成细胞悬液。根据API 50 CHL系统说明书进行操作。将结果输入系统测定软件API plus中,通过归纳菌株可发酵糖的种类初步确定其归属种类。
1.5.8 16S rDNA序列分析
应用天根公司的基因组提取试剂盒说明书方法提取菌株的基因组DNA,使用细菌一般通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和 1492R(5'-GGTTACCTTGTTACGACTT-3')扩增[22]。PCR 产物送交上海生工生物工程技术服务有限公司进行纯化测序。得到的基因序列通过BLAST在GenBank中进行同源性比较,并将其鉴定到种。
2 结果与分析
2.1 产GABA乳酸菌株的筛选
将实验室保藏的82株乳酸菌进行编号,通过薄层层析法初筛,产GABA的菌株结果如图1所示。与GABA及MSG标准品比较Rf值,结果表明,层析编号为30的乳酸菌具有生产GABA的能力,被命名为PD1-2。
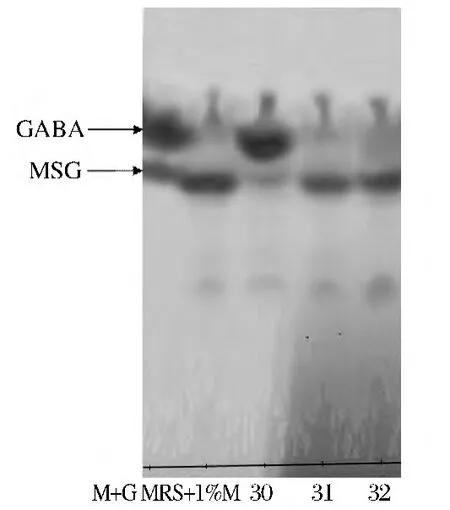
图1 菌株产GABA的薄层层析定性检测Fig.1 Qualitative detection of GABA by TLC
2.2 PD1-2菌株的一般特性
通过革兰氏染色和过氧化氢酶试验发现,PD1-2菌株为革兰氏阳性、过氧化氢酶阴性菌,测定菌液pH值为4.68,产酸性良好,结果如表1所示。经革兰氏染色显微镜观察后发现,PD1-2菌株为杆状菌,单一或成对存在,不产芽孢,无鞭毛,不运动,显微图片如图2所示。

表1 产GABA菌株的生化特性Table 1 Biological characteristics of GABA producers
2.3 GABA的定量测定
GABA和MSG标样经衍生化后在上述色谱条件下进样20 μL,图3 中(A)、(B)分别为GABA 和MSG标准品的高效液相色谱图谱,GABA的保留时间为13.409 min,MSG的保留时间为9.180 min。
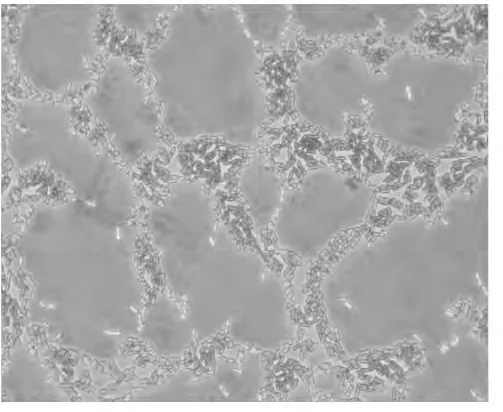
图2 PD1-2的革兰氏染色形态特征Fig.2 Microscopic picture of PD1-2 after gram staining
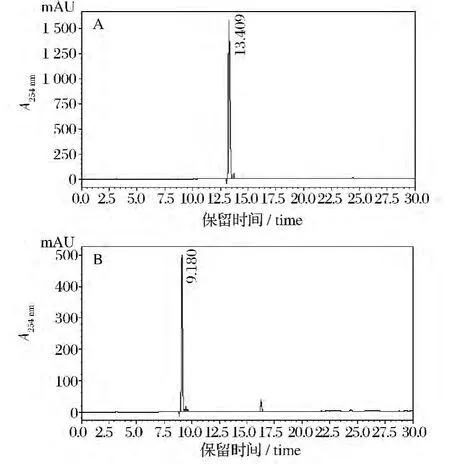
图3 GABA(A)和MSG(B)标准品的高效液相色谱图Fig.3 RP-HPLC chromatogram of GABA(A)and MSG(B)standard
将PD1-2的发酵液样品在相同条件下衍生处理并通过高效液相色谱检测,计算MSG的转化率。结果如表2所示,底物MSG质量浓度为10 g/L时,菌株培养24 h,GABA转化率达到75.6%;菌株培养48 h后,GABA转化率达到100%,GABA产量达到53.4 mmol/L。底物MSG质量浓度为50 g/L时,菌株培养24 h、48 h后,GABA转化率分别达到7.1%、72.6%,并于发酵72 h达到93.7%,GABA产量达到250.3 mmol/L。

表2 PD1-2发酵产GABA的转化率Table 2 GABA conversion rate of PD1-2 analyzed by HPLC
2.4 抗菌性实验结果
PD1-2对7种不同的革兰氏阳性菌及阴性菌的抗菌结果如表3所示,PD1-2对藤黄微球菌、枯草芽孢杆菌、蜡状芽孢杆菌和单增李斯特菌4株革兰氏阳性菌均具有抗菌性;对革兰氏阴性菌的大肠杆菌具有抗菌性;对植物乳杆菌和副溶血性弧菌不具有抗菌性。

表3 PD1-2抗菌性结果Table 3 Antimicrobial activity of PD1-2
调节PD1-2发酵上清液的pH值至7.0,抑菌效果无明显差别,排除了有机酸的干扰;经过氧化氢酶处理后,抑菌效果也无明显差别,排除了过氧化氢的干扰。发酵上清液经胃蛋白酶处理后,抑菌圈显著减小,从而可以初步判定该菌株产生的抑菌物质为细菌素。
2.5 糖发酵结果
按照API 50 CHL试剂条使用说明对菌株PD1-2进行糖发酵实验,结果如表4所示。将表4中的鉴定结果用API plus软件进行分析,结果表明,菌株PD1-2与短乳杆菌(Lactobacillus brevis)有88.1%的同源性。

表4 菌株PD1-2的API 50 CHL反应结果Table 4 The carbohydrate utilization of PD1-2 using API 50 CHL test
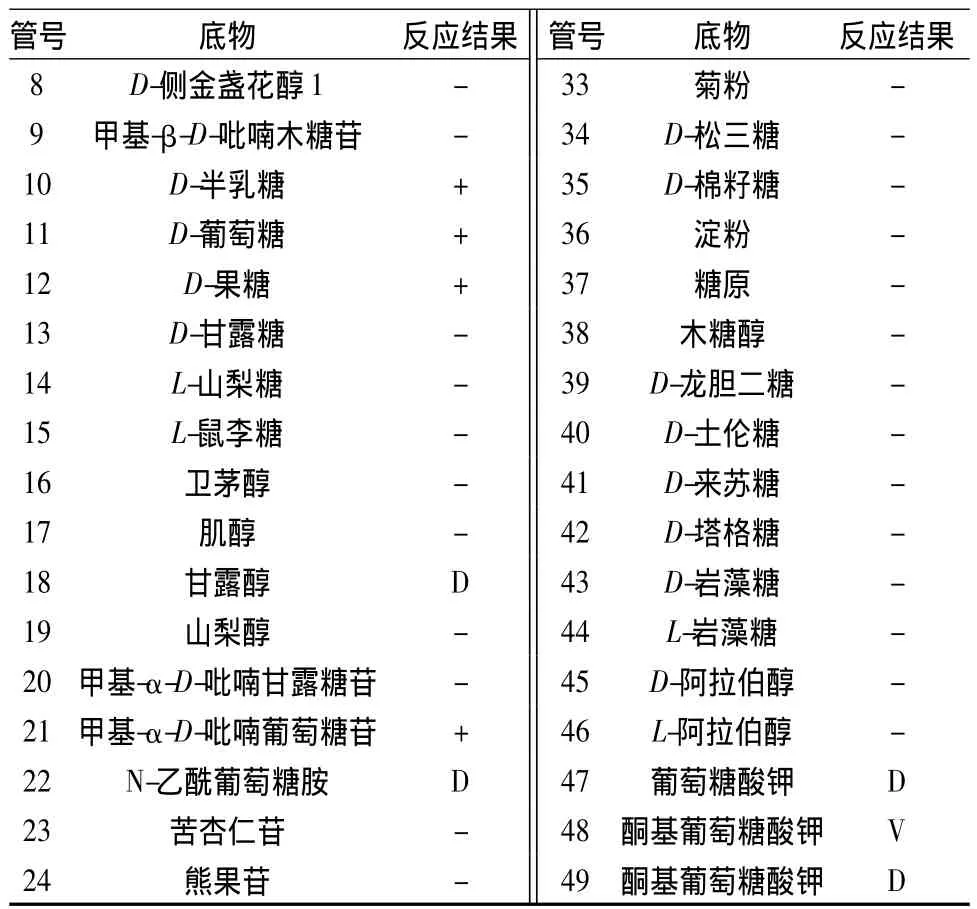
续表4
2.6 16S rDNA菌株鉴定结果
16S rDNA测序结果表明,PD1-2菌株与Lactobacillus brevis ATCC14869(T)的同源性达到99%以上,确定该菌株为乳杆菌属(Lactobacillus)的短乳杆菌(Lactobacillus brevis),将其命名为:Lactobacillus brevis PD1-2。
3 结论及讨论
本研究从泡菜中分离的82株乳酸菌中筛选出1株具有产GABA的菌株,经抗菌性实验测定,该菌同时对革兰氏阳性菌的蜡样芽孢杆菌、枯草芽孢杆菌、藤黄微球菌、单增李斯特菌和革兰氏阴性菌大肠杆菌具有抗菌性。通过API 50CHL糖发酵测定、16S rDNA序列分析鉴定该菌为短乳杆菌,命名为Lactobacillus brevis PD1-2。
通过与文献中其他泡菜源乳酸菌产GABA的能力进行比较,Lactobacillus buchneri MS在底物MSG质量浓度为50 g/L,优化后的MRS培养基中发酵48 h,GABA的转化率达到94%[18];Lactobacillus brevis BH2可将50 g/L的MSG在48 h内转化73%(72 h未检测)[23];Lactobacillus plantarum K154 在含 10 g/L、20 g/L和30 g/L MSG的MRS培养基中GABA的转化量分别为 154.86 μg/mL、170.42 μg/mL 和 201.78 μg/mL[24]。本研究中,PD1-2在未经优化的 MRS培养基中发酵,不仅在较低底物质量浓度(10 g/L)条件下,达到了100%的转化率,而且在较高底物质量浓度(50 g/L)条件下,72 h发酵后GABA转化率达到了93.7%,相比其他乳酸菌具有较高的生产GABA的能力,同时,可以通过菌株诱变或发酵条件优化等方法进一步提高GABA的产量[25]。除了将乳酸菌生产的GABA应用于食品及医药行业之外,近年来,将具有益生作用的产GABA的乳酸菌直接应用于发酵食品中,生产功能性发酵食品也越来越受到人们的关注。如薛玉清等利用蒙古发酵乳制品中分离出的高产GABA的乳酸菌株与传统发酵酸奶的菌株相结合,研制出GABA发酵乳[26]。有研究利用乳酸菌发酵生产富含GABA的大豆制品,研制出功能性的酱类或大豆酸奶等[27-28]。利用乳酸菌发酵研制自然产生GABA的功能性食品,具有工艺简单、成本低廉、食用方便、安全等优点[26]。
乳酸菌发酵过程中,会产生许多抗菌物质,抗菌性对于发酵过程中防止其他有害微生物的生长繁殖具有十分重要的意义。本研究中PD1-2对多种革兰氏阳性菌和革兰氏阴性菌都具有抑菌性,且通过实验证明其产生的主要抑菌物质为细菌素。细菌素无毒、无副作用、无污染性、无抗药性、无残留,而且加入食品后不影响食品感官,而受到食品工业的青睐,目前已成功应用于乳制品、肉制品、果蔬制品等食品的防腐处理上[21]。同时,有研究利用泡菜中筛选出的产细菌素乳酸菌作为发酵菌种生产泡菜,从而提高泡菜的货架期[29-30]。
本研究从泡菜中筛选出具有抗菌性的高产GABA乳酸菌株PD1-2,可利用该菌株生产GABA和细菌素应用于功能性食品的添加及食品的贮藏保鲜,另外,也可作为发酵剂生产贮藏性良好的功能性发酵食品,为今后开发功能性食品提供基础。
[1] 李文斌,唐中伟,宋敏丽.韩国泡菜营养价值与保健功能的最新研究[J].农产品加工·学刊,2006,73(8):83-84,102.
[2] 杜静芳,白凤翎,励建荣.传统韩国泡菜中的乳酸菌研究进展[J].食品与发酵工业,2014,40(11):188-194.
[3] 徐丹萍,蒲彪,敖晓琳,等.传统泡菜中乳酸菌的研究现状[J].食品工业科技,2013,34(19):369-372;377.
[4] Jung J,Lee S,Jeon C.Kimchi microflora:history,current status,and perspectives for industrial kimchi production[J].Applied Microbiology and Biotechnology,2014,98(6):2 385-2 393.
[5] LIU Shan-na,HAN Ye,ZHOU Zhi-jiang.Lactic acid bacteria in traditional fermented Chinese foods[J].Food Research International,2011,44(3):643-651.
[6] 胡书芳,王雁萍.乳酸菌在泡菜生产中的应用[J].安徽农业科学,2008,36(21):9 275-9276;9 327.
[7] Roverts E,Frankel S.γ-Aminobutyric acid in brain:its formation from glutamic acid[J].Journal of Biological Chemistry,1950,187(1):55-63.
[8] 江波.GABA(γ-氨基丁酸)——一种新型的功能食品因子[J].中国食品学报,2008,8(2):1-4.
[9] Adeghate E,Ponery A S.GABA in the endocrine pancreas:cellular localization and function in normal and diabetic rats[J].Tissue and Cell,2002,34(1):1-6.
[10] Jakobs C,Jaeken J,Gibson K.Inherited disorders of GABA metabolism[J].Journal of Inherited Metabolic Disease,1993,16(4):704-715.
[11] Abdou A,Higashiguchi S,Horie K,et al.Relaxation and immunity enhancement effects of γ-Aminobutyric acid(GABA)administration in humans[J].Biofactors,2006,26(3):201-208.
[12] 卫生部关于批准γ-氨基丁酸等6种物质为新资源食品的公告.卫生部公告(2009)12号.
[13] Oh S,Moon Y,Oh C.γ-aminobutyric acid(GABA)content of selected uncooked foods[J].Nutraceuticals and Food,2003(8):75-78.
[14] Nanga R,DebrosseC,Singh A,et al.Glutaminase catalyzes reaction of Glutamate to GABA[J].Biochemical and Biophysical Research Communications,2014,448(4):361-364.
[15] LI H,CAO Y.Lactic acid bacteria cell factories for gamma-aminobutyric acid[J].Amino Acids,2010,39(5):1 107-1 116.
[16] Helander I,von Wright A,Mattila-Sandholm T.Potential of lactic acid bacteria and novel antimicrobials against Gram-negative bacteria[J].Trends in Food Science &Technology,1997(8):146-150.
[17] Stiles M.Biopreservation by lactic acid bacteria[J].Antonie Van Leeuwenhoek,1996,70(2-4):331-345.
[18] Cho Y,Chang J,Chang H.Production of γ-aminobutyric acid(GABA)by Lactobacillus buchneri isolated from Kimchi and its neuroprotective effect on neuronal cells[J].Journal of Microbiology and Biotechnology,2007,17(1):104-109.
[19] Ko K,Liu W,Lee H,et al.Biological and functional characteristics of lactic acid bacteria in different Kimchi[J].Journal of the Korean Society of Food Science and Nutrition,2013,42(1):89-95.
[20] Hwanhlem N,Chobert J,H-Kittikun A.Bacteriocin-producing lactic acid bacteria isolated from mangrove forests in southern Thailand as potential bio-control agents in food:Isolation,screening and optimization[J].Food Control,2014,41(1):202-211.
[21] 吴轶,贡汉生,刘文丽,等.一株产细菌素乳杆菌的鉴定及其细菌素编码基因的获得[J].食品科学,2015,36(11):110-113.
[22] Yoon J,LeeS,Kim S,et al.Restriction fragment length polymorphisms analysis of PCR-amplified 16S ribosomal DNA for rapid identification of Saccharomonospora strains[J].International Journal of Systematic Bacteriology,1997,47(1):111-114.
[23] Kim S,Shin B,Kim Y,et al.Cloning and expression of a full-length glutamate decarboxylase gene from Lactobacillus brevis BH2[J].Biotechnology and Bioprocess Engineering,2007(12):707-712.
[24] Park S,Lee J,Lim S.The probiotic characteristics and GABA production of Lactobacillus plantarum K154 isolated from Kimchi[J].Food Science and Biotechnology,2014,23(6):1 951-1 957.
[25] 葛菁萍,程明,宋明明,等.产GABA的乳酸菌菌株的选育及最佳发酵条件研究[J].中国食品学报,2013,13(9):48-55.
[26] 薛雨清,单艺,满朝新,等.γ-氨基丁酸发酵乳的研制[J].食品与发酵工业,2013,39(11):85-90.
[27] 郭元新,杨润强,顾振新,等.采用生物转化技术富集大豆制品γ-氨基丁酸研究进展[J].食品与发酵工业,2011,37(11):154-158.
[28] LI Hai-ping,YAN Li-ya,WANG Ji-cheng,et al.Fermentation characteristics of six probiotic strains in soymilk[J].Annals of Microbiology,2012,62(4):1 473-1 483.
[29] Chang J,Chang H.Improvement in the quality and shelf life of kimchi by fermentation with the induced bacteriocin-producing strain,Leuconostoc citreum GJ7 as a starter[J].Journal of Food Science,2010,75(2):M103-110.
[30] Park J,Shin J,Bak D,et al.Effet of a Leuconostoc mesenteroides strain as starter culture isolated from the kimchi[J].Food Science and Biotechnology,2013,22(6):1 729-1 733.

