类芽孢杆菌发酵液提取凝乳酶方法研究*
杭锋,王钦博,刘沛毅,洪青,齐晓彦,刘振民,陈卫
1(江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡,214122)
2(乳业生物技术国家重点实验室,光明乳业股份有限公司乳业研究院,上海,200436)
凝乳酶是干酪生产过程中起凝乳作用的关键性酶,通过水解k-酪蛋白中的Phe105-Met106肽键导致牛乳凝结[1]。近年来有关凝乳酶的来源、凝乳机理及小牛皱胃酶替代物均有较详细的报道研究[2-3]。随着世界干酪产业规模的不断扩大和小牛皱胃酶的短缺,微生物来源凝乳酶因其产量大、成本较低、经济效益高的优势越来越广泛地应用于工业化生产中[4-8]。目前相关微生物产凝乳酶及其提纯研究报道多集中在 Rhizomucor spp.、Mucor spp.、Aspergillus spp.和Bacillus spp.等[9-12],而有关Paenibacillus spp.凝乳酶及多糖类物质对提取工艺的影响等方面研究鲜有报道。
前期试验发现,Paenibacillus sp.BD3526除了拥有很高的凝乳酶生产能力外,同时其胞外多糖合成能力也很强。由于发酵液中的多糖类大分子物质在盐析及有机溶剂沉淀过程中,易伴随蛋白质沉淀析出,导致沉淀物中多糖含量较高、黏度较大,为后续凝乳酶的分离纯化带来一定的困难。此外通过研究发现,高通氧环境有利于微生物胞外多糖这类生物大分子的合成[13]。本文对 Paenibacillus sp.BD3526发酵过程进行研究,通过改变摇床转速、接种量以及发酵时间,最大程度地降低发酵上清液中的多糖含量,并利用该胞外多糖和凝乳酶在不同硫酸铵饱和度下溶解性的细微差异,实现凝乳酶较高的回收率,为后期的分离纯化、酶学性质研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌种
Paenibacillus sp.BD3526(CGMCC No.8333=DSM No.28815),从西藏羌塘草原牧民牦牛乳中分离。
1.1.2 主要仪器和试剂
冻干机12L型,Labconco公司;恒温摇床HZQX500C,上海一恒科学仪器公司;离心机 D-37520,Kendro公司;黏度计R180型,ProRheo公司;分光光度计Specord205,Analytik Jena公司;小牛皱胃酶,上海阿敏生物公司;Rhizomucor miehei凝乳酶Marzyme® 150 MG,美国杜邦丹尼斯克公司;Aspergillus niger var.awamori重组凝乳酶Chy-Max®,丹麦Chris Hansen公司;脱脂奶粉,Fonterra公司;葡萄糖标准样品为色谱分析纯;小麦麸皮(蛋白质 18.6%,脂肪6.20%,总碳水化合物63.9%,水分7.89%,灰分3.38%)购于农贸市场;其余试剂及培养基均为国产分析纯,购于国药集团。
1.2 培养基及培养方法
麸皮培养基:小麦麸皮质量百分含量为2%,余量为水,装样量50 mL于,121℃灭菌20 min后,待用。
TYC液体培养基:称取酪朊水解物(或胰胨)15.0 g,酵母膏5.0 g,L-胱氨酸0.2 g,乙酸钠20.0 g,Na2SO40.1 g,NaCl 1.0 g,NaHPO4·12H2O 2.0 g,NaHCO32.0 g,蔗糖50.0 g,溶解于1 L蒸馏水中,调节pH7.3,121℃灭菌20 min,待用。
1.3 BD3526麸皮发酵上清液制备
将类芽孢杆菌BD3526接种于无菌TYC液体培养基中,30℃、180 r/min摇床培养20 h后,作为种子液(约5×108CFU/mL);将种子液按2%(v/v)接种于灭菌后的麸皮培养基,30℃、180 r/min摇床培养48 h后,于4℃、15 000 g离心15 min收集发酵上清液。
1.4 样品凝乳酶活力测定
凝乳酶活力测定方法参照Van等人的方法并做适当调整[14]。将脱脂奶粉以 1∶10(g∶mL)的比例配置成pH 6.0含有0.01 mol/L CaCl2的溶液,在35℃水浴中孵育10 min,分别加入500 μL稀释酶液,每5 s将样品取出并倾斜45°观察样品组织状态,以形成不连续颗粒的时间计作凝乳时间。按公式(1)计算样品中凝乳酶活力(SU/mL),按公式(2)计算其酶活回收率RE(%)。
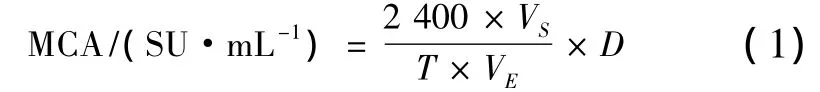
式中,T—凝乳时间,s;VS—脱脂乳体积,mL;VE—酶液体积,mL;D—稀释倍率。
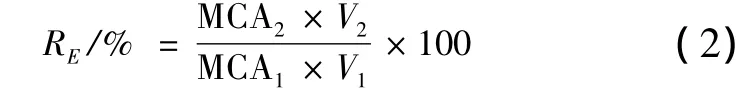
式中,MCA1—发酵液上清酶活,SU/mL;V1—发酵液上清体积,mL;MCA2—硫酸铵沉淀溶解后样品酶活,SU/mL;V2—硫酸铵沉淀溶解后样品体积,mL。
1.5 样品总糖含量测定
参照Taylor[15]苯酚硫酸法测样品糖含量,并做部分调整。葡萄糖标准曲线的制作:配制1 mg/mL的葡萄糖溶液,分别吸取 0、2、5、10、50 及 100 μL 葡萄糖标准液,以蒸馏水补至200 μL,加入5%苯酚0.4 mL和浓硫酸2 mL,摇匀,室温放置20 min后于490 nm测吸光值,得标准曲线 y=0.002x+0.043,R2=0.9984(横坐标为糖浓度)。
样品糖含量的测定:分别吸取稀释后的样品200 μL,加入5%苯酚0.4 mL及2 mL浓硫酸,摇匀,室温放置20 min后于490 nm测吸光值,以200 μL蒸馏水作为空白,依据标准曲线分别测定发酵上清液和硫酸铵沉淀后溶液糖含量(mg/mL)。
糖含量回收率RP按公式(3)计算:
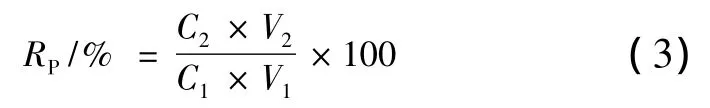
式中,C1—发酵上清液糖浓度,mg/mL;V1—发酵液上清体积,mL;C2—硫酸铵沉淀复溶样品糖浓度,mg/mL;V2—硫酸铵沉淀复溶样品体积,mL。
1.6 样品黏度的测定
使用proRheo-R180型黏度计,调节转速1 000 r/min,操作环境温度10℃,分别取少量样品溶液倒入样品槽内,转子旋转10 s后度数即为黏度值(mPa·s)。
1.7 BD3526产凝乳酶条件优化
1.7.1 不同培养时间对发酵上清液的影响
将种子液按2%(v/v)接种于灭菌后的麸皮培养基,30 ℃、180 r/min 摇床培养12、24、48、72、84 h 后,取BD3526麸皮发酵液,于4℃、15 000 g离心15 min收集上清发酵液,并分别测定发酵液上清液凝乳酶活性、糖含量及黏度值。
1.7.2 不同摇床转速对发酵上清液的影响
将种子液按2%(v/v)接种于灭菌后的麸皮培养基,分别在140、160、170、180、300 r/min,30 ℃摇床培养48 h后,取BD3526麸皮发酵液,于4℃、15 000 g离心15 min收集上清发酵液,并分别测定发酵液上清液凝乳酶活性、糖含量及黏度值。
1.7.3 不同接种量对发酵上清液的影响
将种子液分别按体积分数为0.4%、0.8%、1.6%、2.0%、2.4%、3.2%接种于麸皮培养基,30℃、180 r/min摇床培养48 h后,于4℃、15 000 g离心15 min收集上清发酵液,并分别测定发酵液上清液凝乳酶活性、糖含量及黏度值。
1.8 粗凝乳酶提取方法
按“1.7发酵BD3526产凝乳酶条件优化”后的试验方法,收集并测量发酵上清液的总体积,在具有机械搅拌的情况下,将硫酸铵粉末缓慢加入发酵上清液中溶解,分别加至硫酸铵的浓度达到饱和度(25℃)为 50%、55%、60%、65%、70%、75% 和80%,4℃静置2 h后,于4℃、15 000 g离心15 min,收集沉淀物,使用0.02 mol/L PBS对沉淀进行溶解,于4℃、15 000 g离心15 min条件下去除不溶物质,收集并测量离心上清液的MCA和体积。将沉淀上清液冻干得到BD3526凝乳酶的粗提物。
1.9 凝乳酶活力的对比
分别取60%硫酸铵沉淀冻干后粗提物及商业化凝乳酶chymosin、小牛皱胃酶、R.miehei凝乳酶各5 mg,使用0.02 mol/L磷酸盐缓冲溶液(PBS)溶解至10 mL,按“1.4样品凝乳酶活力测定”方法,比较不同样品之间凝乳酶活力差异。
1.10 数据分析
所有实验均重复3次,实验数据均用平均值±标准偏差(SD)表示,并使用SAS 9.2软件进行统计分析。
2 结果与讨论
2.1 培养时间对发酵上清液的影响
发酵时间对发酵上清液中的凝乳酶活力、糖含量和黏度的影响如图1所示。培养12~24 h时,发酵上清液中凝乳酶酶活力呈较高水平,24 h时凝乳酶活力最高达到(3 209.09±85.64)SU/mL,这与微生物蛋白酶主要在对数生长后期或稳定期积累的报道相一致[16];发酵培养至72 h时,发酵液中凝乳酶活力仍维持较高水平为(2 545.67±57.34)SU/mL,此时黏度及糖含量均显著下降(P<0.01);发酵84 h后,凝乳酶活力较低仅为(1 814.52±21.38)SU/mL。
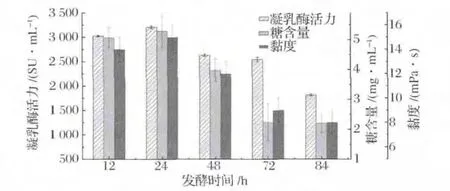
图1 发酵时间对发酵上清液凝乳酶活力、糖含量和黏度的影响Fig.1 Effect of fermentation time on the milk-clotting activity,exopolysaccharides content and viscosity in the supernatant
发酵上清液中的糖含量及黏度值随发酵时间的变化趋势与凝乳酶活力一致,均随着时间的延长呈下降趋势。24 h时糖含量和上清液黏度值最高,分别为(5.29±0.57)mg/mL和(15±1)mPa·s;发酵72 h后,糖含量和黏度值变化显著,均维持在较低水平,分别为(2.24±0.62)mg/mL和(9±1)mPa·s。该结果与 Thiry[17]、Wernersson[18]和 Calik[19]的报道研究相似,通过延长培养时间,可以有效降低培养液内多糖含量,减小发酵液的黏度,原因可能是随着发酵时间的延长,菌种对多糖类物质的进行了消耗。因此,选择发酵时间为72 h,不仅其凝乳酶活力维持较高水平,且其糖含量及黏度值均较低。
2.2 摇床转速对发酵上清液的影响
在接种量为2%(v/v),培养温度为30℃的情况下,摇床转速(140~300 r/min)对发酵上清液的影响如图2所示。
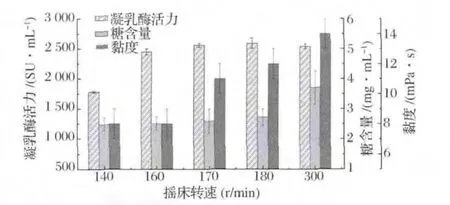
图2 摇床转速对发酵上清凝乳酶活力、糖含量和黏度的影响Fig.2 Effect of shaking speed on the milk-clotting activity,exopolysaccharides content and viscosity in the supernatant
由图2可知,随着转速的增加,发酵上清液的凝乳酶活、糖含量以及黏度值均有不同程度的提高。转速在140~160 r/min时,凝乳酶活力增加较快,糖含量和黏度值较低;当转速超过160 r/min后,凝乳酶活力变化不大,糖含量缓慢上升,且黏度显著提高(P<0.01)。转速达到300 r/min时,发酵上清液中糖含量较高为(3.71±0.55)mg/mL,黏度为(14±1)mPa·s。原因是摇瓶培养中的氧传递系数(KLa)随着装液量的增加而降低、转速的提高而增加[20]。摇床转速过快,提高了培养基中溶解氧含量,可能促进了大分子糖类物质的产生[21-22]。在160 r/min时,其凝乳酶活力为(2 449.25±49.88)SU/mL,且发酵液中糖含量(2.51±0.23 mg/mL)和黏度(8±1 mPa·s)均维持较低的水平,因此,选择该转速作为进一步优化的培养条件。
2.3 接种量对发酵上清液的影响
在培养温度为30℃、摇床转速为160 r/min的条件下,接种量(0.4% ~3.2%)对发酵上清液的影响如图3所示。由图3可知,当接种量在1.6%(v/v)时,发酵液中凝乳酶活力达到最大值;而发酵上清液的糖含量与接种量呈正相关,当接种量超过1.6%时,糖含量明显增加,接种量为3.2%时,糖含量为最高(3.59±0.31)mg/mL;黏度值亦随接种量的增大而逐渐增大,在0.4%和0.8%的接种量下,黏度值较低,且均为(8±1)mPa·s,接种量超过1.6%时黏度值均高于(10±1)mPa·s。接种量的不同造成发酵上清液中糖含量和黏度发生显著变化,原因可能是TYC种子液中带入的蔗糖促进了多糖的合成,使得发酵上清液中多糖积累量增多。因此,选择0.8%(v/v)的接种量,在此条件下,发酵上清中凝乳酶活力可以达到(2 685.71±34.78)SU/mL,而糖含量和黏度均保持在较低水平。
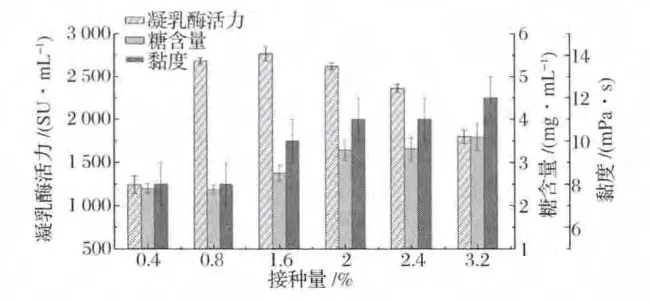
图3 接种量对发酵上清液中凝乳酶活力、糖含量和黏度的影响Fig.3 Effect of inoculum size on the milk-clotting activity,exopolysaccharides content and viscosity in the supernatant
2.4 优化后发酵工艺验证
按照单因素实验结果,选择接种量体积分数为0.8%、摇床转速为160 r/min、发酵时间为72 h,其余步骤参照“1.3 BD3526麸皮发酵及制备”操作,比较优化前后凝乳酶活力、糖含量及黏度值差异,结果如表1所示。
由表1可知,通过优化发酵过程中的接种量、摇床转速以及发酵时间等因素,能获得较高酶活(2 685.71±35.35 SU/mL);糖含量相对优化前降低了52.32%,有效降低发酵液中的多糖含量;黏度也较优化前(接种量体积分数为2%),摇床转速180 r/min,发酵时间48 h)有了明显的降低。因此通过发酵条件的优化,可有效减少糖类对后续分离纯化的干扰影响。

表1 优化前后BD3526上清液发酵液结果比较Table 1 Comparison of the milk-clotting activity,exopolysaccharides content and viscosity in the supernatant before and after the optimization
2.5 硫酸铵饱和度对凝乳酶提取效果的影响
分别使用50%~80%饱和度的硫酸铵对优化发酵条件制备的发酵上清液中的凝乳酶进行盐析沉淀,并分别测定不同饱和度硫酸铵条件下,凝乳酶活力和糖含量的回收率,以筛选出硫酸铵提取凝乳酶较佳的饱和度。实验结果如表2所示。

表2 不同饱和度硫酸铵对发酵上清液中凝乳酶和多糖沉淀效果Table 2 Effect of ammonium sulfate saturation on the recoveries of milk-clotting enzyme and exopolysaccharidesin the supernatant
由表2可知,随着硫酸铵饱和度不断升高(50%~60%),其凝乳酶回收率也不断增大,当加入硫酸铵饱和浓度超过65%时,多糖伴随凝乳酶大量沉淀,导致其凝乳酶回收率逐渐降低,这有可能是发酵体系中的多糖具有悬浮和稳定作用所致;而沉淀物的糖含量回收率则与硫酸铵饱和度呈正相关,沉淀中的糖含量随硫酸铵饱和度的增大也不断变大,当硫酸铵饱和浓度超过60%,沉淀中糖含量回收率增加较快。
目前对发酵上清液的目的蛋白的提取方法较常用的有盐析法(硫酸铵等)和有机溶剂沉淀法(乙醇、丙酮等)等,本实验前期采用乙醇沉淀方法(乙醇与发酵液的体积比为3∶1)可实现37.52% ±5.89%的回收率,但多糖的回收率达到了80%以上。本文利用60%硫酸铵沉淀法获得了凝乳酶粗提物,其酶活回收率最高为32.08%,糖类物质的回收率也仅为16.76%,有效避免了糖类物质的大量沉淀,实现了BD3526凝乳酶和多糖的有效分离。
通过发酵条件及提取方法的优化,将冻干所得的粗凝乳酶与目前商业化用酶进行比较(表3)。结果发现,优化后的样品凝乳酶活力为(188.45±5.71)SU/mg,虽然较Hansen、Danisco等商业化凝乳酶活力低,但高于商业化小牛皱胃酶的酶活,达到了商业化应用的水平。因而,优化BD3526的发酵条件及提取方式,获得较低糖含量的粗凝乳酶,对于后期酶的分离纯化和酶学性质研究具有重要意义。

表3 BD3526与商业化凝乳酶活力的对比Table 3 Comparison of milk-clotting activity between commercial coagulants and BD3526 MCE
3 结论
本文对Paenibacillus spp.BD3526发酵小麦麸皮生产凝乳酶发酵条件进行了优化,在保证凝乳酶活力未明显降低的前提下,通过对培养过程中的摇床转速、接种量以及发酵时间的改变,降低发酵上清液中的多糖类含量和黏度值。在此基础上,选用合适饱和度的硫酸铵进一步实现对凝乳酶和多糖进行分离。结论如下:
(1)当接种量体积分数为0.8%、摇床转速为160 r/min、发酵时间为72 h时,发酵上清液中的糖和黏度均降低到了最低值,分别为1.33 mg/mL和8 mPa·s,而上清液凝乳酶活力未显著降低。在保证酶活力及其回收率的前提下,有效降低了发酵上清液中多糖的含量。
(2)利用该菌株胞外多糖和凝乳酶在不同硫酸铵饱和度下的溶解性差异,选择了饱和度60%的硫酸铵提取发酵液中的凝乳酶可实现了较高的酶活回收率,制备的凝乳酶粗提物,其凝乳酶活力为(188.45±5.71)SU/mg,达到了商业化应用的水平。
(3)优化后所得的凝乳酶粗提物,糖含量少,粗酶黏度较低,便于后续凝乳酶的进一步分离和纯化。
[1] Bruno M A,Lazza C M,Errasti M E,et al.Milk clotting and proteolytic activity of an enzyme preparation from Bromelia hieronymi fruits[J].LWT-Food Science and Technology,2010,43(4):695-701.
[2] Starovoitova V V,Velichko T I,Baratova L A,et al.A comparative study of functional properties of calf chymosin and its recombinant forms[J].Biochemistry(Moscow),2006,71(3):320-324.
[3] Grappin R,Rank T C,Olson N F.Primary proteolysis of cheese proteins during ripening.A review[J].Journal of Dairy Science,1985,68(3):531-540.
[4] Haard N F.A review of proteotlytic enzymes from marine organisms and their application in the food industry[J].Journal of Aquatic Food Product Technology,1992,1(1):17-35.
[5] Tavares J F P,Baptista J A B,Marcone M F.Milk-coagulating enzymes of tuna fish waste as a rennet substitute[J].International Journal of Food Sciences and Nutrition,1997,48(3):169-176.
[6] Reis P M,LourenÇo P L,Domingos A,et al.Applicability of extracts from Centaurea calcitrapa in ripening of bovine cheese[J].International Dairy Journal,2000,10(11):775-780.
[7] 普燕,张富春.干酪用牛凝乳酶替代品的研究进展[J].食品与发酵工业,2015,41(5):41.
[8] 朱仁俊,石振兴,甘伯中,等.凝乳酶的研究进展[J].中国乳品工业,2010,38(1):39-42.
[9] De Lima C J B,Cortezi M,Lovaglio R B,et al.Production of rennet in submerged fermentation with the filamentous fungus Mucor miehei NRRL 3420[J].World App Sci J,2008,4:578-585.
[10] Venera G D,Machalinski C,Zum’arraga H,et al.Further characterization and kinetic parameter determination of a milk-clotting protease from Mucor bacilliformis[J].Applied Biochemistry and Biotechnology,1997,68(3):207-216.
[11] Fazouane-Naimi F,Mechakra A,Abdellaoui R,et al.Characterization and cheese-making properties of rennetlike enzyme produced by a local Algerian isolate of Aspergillus niger[J].Food Biotechnology,2010,24(3):258-269.
[12] LI Y,LIANG S,ZHI D,et al.Purification and characterization of Bacillus subtilis milk-clotting enzyme from Tibet Plateau and its potential use in yak dairy industry[J].European Food Research and Technology,2012,234(4):733-741.
[13] Sutherland I W.Novel and established applications of microbial polysaccharides[J].Trends in Biotechnology,1998,16(1):41-46.
[14] Van den Berg J A,van der Laken K J,van Ooyen A J J,et al.Kluyveromyces as a host for heterologous gene expression:expression and secretion of prochymosin[J].Nature Biotechnology,1990,8(2):135-139.
[15] Taylor K A C C.A modification of the phenol/sulfuric acid assay for total carbohydrates giving more comparable absorbances[J].Applied Biochemistry and Biotechnology,1995,53(3):207-214.
[16] Alvarez V M,Von der Weid I,Seldin L,et al.Influence of growth conditions on the production of extracellular proteolytic enzymes in Paenibacillus peoriae NRRL BD‐62 and Paenibacillus polymyxa SCE2[J].Letters in Applied Microbiology,2006,43(6):625-630.
[17] Thiry M,Cingolani D.Optimizing scale-up fermentation processes[J].TRENDS in Biotechnology,2002,20(3):103-105.
[18] Wernersson E S,Trägrdh C.Scaling of turbulence characteristics in a turbine-agitated tank in relation to agitation rate[J].Chemical Engineering Journal,1998,70(1):37-45.
[19] Çalık P,Çalık G,Özdamar T H.Oxygen-transfer strategy and its regulation effects in serine alkaline protease production by Bacillus licheniformis[J].Biotechnology and Bioengineering,2000,69(3):301-311.
[20 ] LIU Y S,WU J Y,HO K.Characterization of oxygen transfer conditions and their effects on Phaffia rhodozyma growth and carotenoid production in shake-flask cultures[J].Biochemical Engineering Journal,2006,27(3):331-335.
[21] Eickenbusch H,Brunn P O,Schumpe A.Mass transfer into viscous pseudoplastic liquid in large-diameter bubble columns[J].Chemical Engineering and Processing:Process Intensification,1995,34(5):479-485.
[22] Bandaiphet C,Prasertsan P.Effect of aeration and agitation rates and scale-up on oxygen transfer coefficient,k L a in exopolysaccharide production from Enterobacter cloacae WD7[J].Carbohydrate Polymers,2006,66(2):216-228.

