泡菜中乳酸菌的分离鉴定及其耐NaCl胁迫与产酸能力研究*
杨振泉,张咪,王晓霖,梅秋艳,周海波
(扬州大学食品科学与工程学院,江苏扬州,225127)
蔬菜泡制不仅是一种良好的蔬菜保藏途径,而且形成的泡菜产品清淡爽口、具有独特的风味。蔬菜泡制可以直接添加有机酸进行酸化,也可以通过微生物厌氧发酵酸化,我国泡菜主要是通过后者形成[1]。发酵酸化不仅对蔬菜的营养物质破坏较小,而且发酵过程中形成的多种氨基酸、维生素、酶,以及对人体健康有益的乳酸菌可以提高发酵蔬菜的营养价值[2-3]。泡菜发酵中盐浓度控制是产品品质和安全性的重要影响因素。高浓度盐产生的高渗透压作用能够使微生物细胞发生质壁分离,导致微生物生长抑制或者死亡,从而有效控制蔬菜中有害微生物的数量[4]。另一方面,高浓度的盐对蔬菜携带的发酵菌区系(主要是乳酸菌)的生长繁殖产生抑制,导致产酸量减少,发酵周期延长[5]。近年来接种发酵技术被应用于泡菜的生产,接种纯乳酸菌或者复合菌种发酵剂比自然发酵产酸的能力强,大大缩短了泡菜的生产周期,保持了产品质量的稳定性[6-7]。筛选繁殖快、产酸能力强并且对发酵蔬菜环境适应性好的菌种是制备高品质泡菜发酵剂的前提。微生物的耐盐胁迫能力与其在含盐环境中的繁殖和代谢能力密切相关[8-10],研究耐盐性微生物在泡菜发酵过程中的消长规律可以指导泡菜工艺的改进,同时有利于获得适合不同盐含量泡菜发酵的优良菌种。本文研究了不同盐浓度的泡菜在自然发酵过程中pH值、菌落总数、大肠菌群以及乳酸菌数的变化规律,并对高盐泡菜中的乳酸菌进行分离鉴定,探讨不同分离株在蔬菜汁模型中耐NaCl胁迫能力与产酸特性,为提高不同盐度泡菜发酵产酸速度、缩短成熟周期提供合适菌种。
1 材料与方法
1.1 材料
1.1.1 原料
泡菜制备所需新鲜胡萝卜、黄瓜、白菜以及食盐均采购于扬州当地市场。
1.1.2 培养基与试剂
营养肉汤琼脂培养基、伊红美蓝琼脂、MRS培养基均为广州环凯生物试剂有限公司产品;分子生物学试剂蛋白酶 K、10 ×Buffer、dNTPs、Taq酶、DNA Marker等购自上海生工生物工程有限公司;细菌16S rDNA扩增引物8F:5’-AGAGTTTGATCCTGGCTCAG-3’和 15R:5’-AAGGAGGTGATCCAGCCGCA-3’,由上海生工生物工程有限公司合成;其他化学试剂均为国产分析纯。
1.1.3 主要仪器与设备
PHS-3C pH计,上海精密科学仪器有限公司;FP-110-C自动生长曲线分析仪,芬兰Bioscreen公司;XSP-BM-12CAC显微镜,上海彼爱姆光学仪器制造公司;UV-2401PC紫外分光光度计,日本岛津公司;TG16-WS型台式高速离心机,湘仪离心机仪器有限公司;DGX-9053B-2型生化培养箱,上海福玛实验有限公司;PTC-100型PCR仪,美国MJ公司;DYY-SB型稳压稳流电泳仪,北京市六一仪器厂;Tanon-2500凝胶成像系统,上海天能科技有限公司。
1.2 方法
1.2.1 泡菜自然发酵
挑选新鲜、没有蛀虫及腐烂现象的蔬菜,切除头部用清水洗净、晾干。将白菜和配料切成3~4 cm的长条或薄片,混合均匀,放入泡菜坛,压实。将已经冷却的20 g/L和80 g/L的盐水倒入坛中,盐水高出料面2 cm,将泡菜坛的盖紧,在室温下自然发酵,定期取样分析,第1天的0~12 h每隔2 h取样1次,24 h后每隔1天取样1次。
1.2.2 pH值测定
用无菌吸量管取10 mL的泡菜卤水,用pH计测量泡菜的pH值,取3组平行的平均值描述泡菜pH随时间的变化趋势。
1.2.3 菌落总数测定
无菌吸取泡菜卤水1 mL注入含有9 mL灭菌生理盐水的试管中,经充分振摇后做成1∶10的均匀稀释液。再按上述方法,做10倍递增稀释。选择5个适宜的稀释度,取250 μL的稀释液于营养肉汤琼脂培养基,每个稀释度做两个培养皿,将营养肉汤琼脂板倒置于37℃培养箱培养24 h后,人工计数并计算菌落总数 (CFU/mL)。
1.2.4 大肠菌群测定
无菌吸取泡菜卤水1 mL注入含有9 mL灭菌生理盐水的试管中,经充分振摇后做成1∶10的均匀稀释液,10倍递增稀释。选择3个合适的稀释度接种于乳糖胆盐发酵管内,每个稀释度接种3管,置于37℃培养箱培养24 h。产气管划线接种于伊红美蓝琼脂平板,37℃培养箱培养24 h,观察菌落形态,挑取典型菌落做革兰氏染色和证实试验,根据大肠菌群阳性管数,查MPN检索表报告大肠菌群的最大可能数(MPN/100 mL)。
1.2.5 乳酸菌分离与鉴定
1.2.5.1 乳酸菌的计数与分离
发酵卤水样品充分混匀后用灭菌生理盐水10倍稀释。吸取250 μL不同稀释度样品液涂布含有0.75%CaCO3的MRS平板,放入厌氧罐,37℃恒温培养48 h,选择分离程度较好的平板对有溶钙圈的菌落计数,计算乳酸菌数量(CFU/mL)。取菌落进行革兰氏染色,镜检细胞形态,挑取单菌落在MRS平板上反复划线纯化,挑取单菌落接种于MRS液体培养基,置于37℃培养箱厌氧培养24 h后,-20℃冻存备用。
1.2.5.2 乳酸菌生理生化鉴定
按文献[11]所述的方法对接触酶阴性、产酸的革兰氏阳性菌进行耐盐性、温度、耐酸碱、动力学以及糖和氨基酸发酵试验,细菌的细胞微观形态采用显微镜拍摄观察。
1.2.5.3 16S rDNA扩增及测序鉴定
乳酸菌基因组DNA的提取方法参照文献[12]所述的CTAB法提取。以基因组DNA为模板进行16S rDNA的PCR扩增。PCR反应体系(50 μL)包括:模板(50 ng/μL)2.0 μL、dNTPs(10 mmol/L)2.0 μL、25 pmol/μL 引物 8F 和 15R 各 2.0 μL、10 × Buffer 5.0 μL、MgCl2(25 mmol/L)2.0 μL、Tag 酶(5 U/μL)0.3 μL,最后加 ddH2O 补足至 50 μL。热循环参数为:94℃预变性5 min;94℃变性40 s,50℃退火50 s,72℃延伸2.0 min,35次循环;72℃延伸10 min。取7.0 μL PCR产物用1.0%的琼脂糖凝胶电泳检测片段大小,其余PCR产物委托上海生物工程有限公司测序,所得序列在GenBank(http://www.ncbi.nlm.nih.gov)数据库中进行在线比对,序列同源性大于99%设为相同种。
1.2.6 乳酸菌在不同盐浓度黄瓜汁中的生长曲线测定
从-70℃冰箱里取出菌种,0℃解冻,无菌吸取200 μL菌液于5 mL MRS液体培养基中,37℃厌氧培养36 h后取培养物划线接种MRS固体平板,37℃厌氧培养36 h,挑取单菌落接种于培养基中,37℃厌氧培养24 h,离心取菌体,灭菌生理盐水洗涤2次后,调节OD600nm=0.5。取菌悬液进行梯度稀释后涂布MRS平板,37℃厌氧培养36 h后进行菌落计数。分别取15 mL澄清透明的黄瓜汁(50%,V/V)于7根试管中,分别加入0、0.3、0.6、0.9、1.2 和 1.5 g NaCl于试管中振荡溶解,用0.45 μm滤器过滤除菌,分装备用。取20 μL不同菌悬液接种2.0 mL不同NaCl浓度的黄瓜汁中充分混匀,转移至多孔培养板,每孔400 μL,每样3孔平行,未接种黄瓜汁作为空白对照;将接菌后的培养板盖上盖子,放入Bioscreen自动生长曲线分析仪中,参数设置为30℃培养60 h,波长580 nm,每60 min读取1次数据。以OD580nm平均值为纵坐标,时间为横坐标,绘制生长曲线。
1.2.7 乳酸菌的生长动力学参数计算
生长动力学参数计算参考文献[13]进行,通过Sigmaplot 10.0软件中的非线性拟合程序中的参数Gompertz模型对生长曲线进行拟合,拟合方程转换成Nt=A+C ×exp{-exp[-B(t-M)]},菌株最大生长速度μmax=B×C/e,其中e取2.718,单位h-1;最大群体密度Nmax=A+C,单位OD580nm。
1.2.8 乳酸菌分离株产酸能力测定
乳酸菌复苏、培养以及悬液制备同1.2.6,将用于自然发酵的泡菜原料匀浆制成蔬菜汁培养基,起始盐浓度为8%(W/V),每管分装15 mL用于接种发酵,每管接种浓度分别为106和108CFU/mL,分为对照组(未接种);M0、M1、M3、M4和 M6单独接种组;M0+M3(1∶3)、M0+M3(1∶1)、M0+M3(3∶1)、M0+M6(1∶3)、M0+M6(1∶1)和 M0+M6(3∶1)组合接种组。每隔24 h各取3管测量pH,取平均值描述pH随发酵时间的变化。
2 结果与讨论
2.1 盐含量对泡菜发酵过程中pH值变化的影响
对低盐和高盐泡菜在发酵过程中pH值变化的测定结果如图1所示。高浓度盐(8.0%)可明显减缓泡菜的pH值的下降,延长泡菜的发酵周期。一般来说,泡菜液pH值达到3.5~3.8即可认为泡菜已发酵成熟[14]。本研究中起始盐含量为2.0%的泡菜产酸速度较快,在24 h卤水pH下降了3.0个单位,发酵72 h后pH维持在3.5左右;而起始盐含量8%的泡菜产酸速度显著减小,发酵至144 h卤水pH值才降低到3.6,结果表明高浓度盐抑制了乳酸菌的生长代谢,导致酸化速度减慢。

图1 盐含量对泡菜发酵过程中pH变化的影响Fig.1 The effect of salt concentration on pH change during pickle fermentation
2.2 盐含量对泡菜发酵过程中菌落总数变化的影响
对不同盐含量的泡菜在发酵过程中的菌落总数变化测定结果如图2所示。结果显示盐含量为2%的泡菜的起始菌落总数为6.92 lg CFU/mL,发酵24 h菌落总数上升至8.05 lg CFU/mL,之后随着pH下降菌落总数迅速下降到4.45 lg CFU/mL,表明有机酸的产生使酸敏感菌群迅速下降。在盐含量为8%的泡菜卤水中,起始菌落总数为3.11 lg CFU/mL,随发酵进行(0~120 h)菌落总数缓慢上升到5.56 lg CFU/mL,在144 h开始下降,最终降到4.67 lg CFU/mL。结果表明:尽管8.0%NaCl导致原料中盐敏感细菌的死亡,减少细菌的初始数量,但耐盐性细菌在8.0%NaCl条件下仍会缓慢生长,同时高浓度盐也抑制了乳酸菌的生长和产酸,最终导致菌落总数下降趋势并不明显。
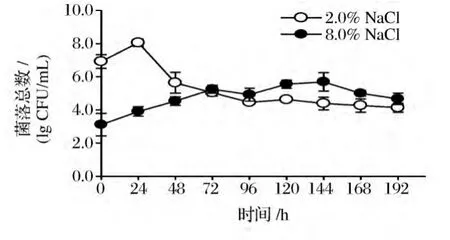
图2 盐含量对泡菜发酵过程中菌落总数变化的影响Fig.2 The effect of salt concentration on the total number of colonies during pickle fermentation
2.3 盐含量对泡菜发酵过程中乳酸菌总数变化的影响
应用改良的MRS平板厌氧培养法测定泡菜卤水中的乳酸菌总数变化,结果如图3所示。
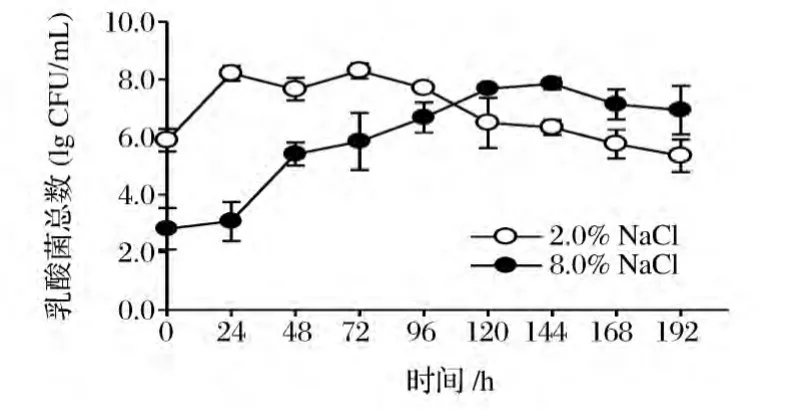
图3 盐含量对泡菜发酵过程中乳酸菌总数的影响Fig.3 The effect of salt concentration on the lactic acid bacteria number during pickle fermentation
起始盐含量为2.0%和8.0%泡菜在发酵过程中乳酸菌数量变化趋势存在明显差异。在起始盐含量为2.0%的泡菜中,乳酸菌数量总体上呈先增大后减小的趋势,起始数量为5.89 lg CFU/mL,发酵24 h后上升到最高(8.21 lg CFU/mL),72 h开始逐渐下降,到192 h减低至5.35 lg CFU/mL,表明发酵后期有机酸的累积导致部分兼性厌氧菌的消亡。而8%盐浓度的泡菜在发酵0~144 h阶段,乳酸菌浓度从起始2.92 lg CFU/mL上升到7.85 lg CFU/mL,随后缓慢下降,至192 h减低到6.93 lg CFU/mL。结果表明,高浓度的盐抑制了泡菜原料中携带的盐敏感性菌群及乳酸菌的生长速度,但原料中存在的部分耐盐性乳酸菌仍然能够生长和产酸。
2.4 盐含量对泡菜发酵过程中大肠菌群变化的影响
对高盐和低盐泡菜发酵过程中大肠菌群测定结果如表1所示。不同盐含量泡菜发酵过程中大肠菌群数量随时间变化趋势均呈先增大后减小的趋势,在NaCl浓度为2.0%泡菜中,起始大肠菌群数为110 000 MPN/100 g,第24 h上升到最高(2.4×107MPN/100g),随后逐渐下降到40 MPN/100 g;在NaCl浓度为8.0%泡菜中,起始大肠菌群数为﹤30,第72 h>24 000,在96~192 h逐渐下降到 90 MPN/100 g,基本趋势与菌落总数的变化一致。结果表明8.0%NaCl对大肠菌群中的大多数种属具有抑制作用,但也存在少数耐盐性菌群早期缓慢生长,发酵后期随着酸度增加逐渐消亡,产酸速度是影响大肠菌群数量的主要因素。
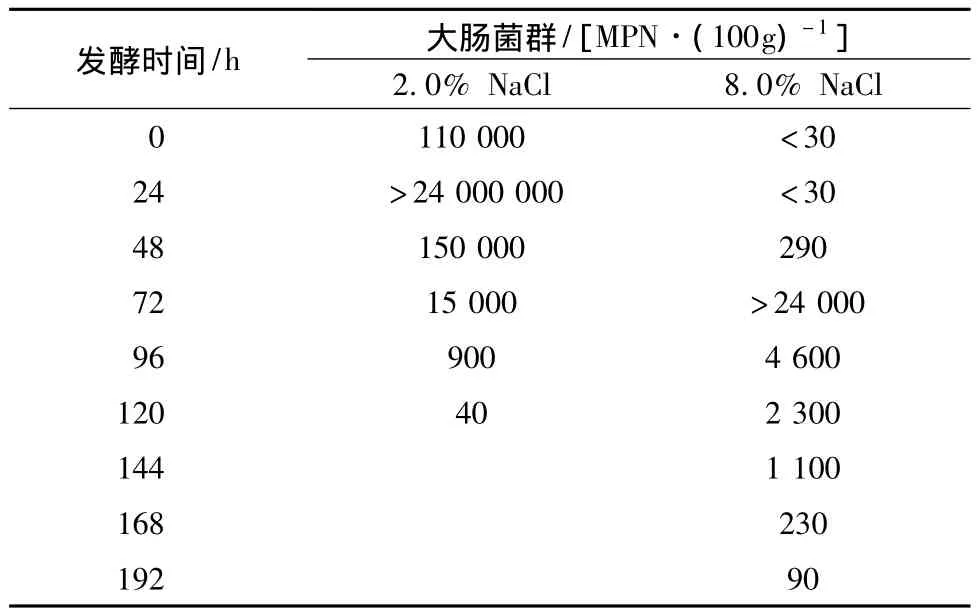
表1 盐浓度对泡菜发酵过程中大肠菌群的影响Table 1 The effect of salt concentration on coliform during pickle fermentation
2.5 乳酸菌分离与生理生化鉴定结果
从8%NaCl泡菜卤水中分离得到5株乳酸菌,分别为 M0、M1、M3、M4和 M6,所有菌株革兰氏染色均为阳性,无芽孢,其中M0为球菌,其余4株均为杆菌,参照常见细菌系统鉴定手册[11]中乳酸菌的特征进行生理生化试验,结果如表2所示,M0各项特征与屎肠球菌(Enterococcus faecium)相符,M1、M3、M4 和M6符合植物乳杆菌(Lactobacillus plantarum)的特征描述。
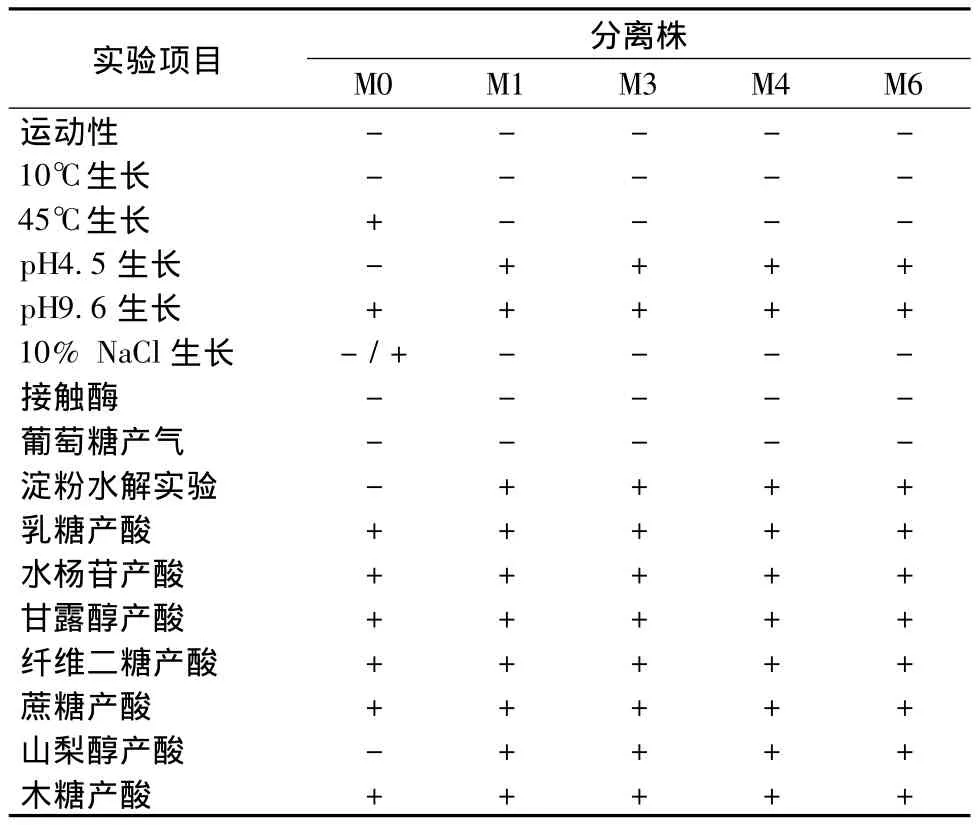
表2 乳酸菌分离株的生理生化鉴定结果Table 2 Physiological and biochemical characteristics of lactic acid bacteria isolates
2.6 乳酸菌的16S rDNA测序鉴定结果
以5株乳酸菌分离株的基因组DNA为模板,应用引物8F和15R进行PCR扩增,结果扩增产物大小均在1500 bp左右。将16S rDNA扩增产物测序结果在GenBank上进行Blasten对比分析,结果如表3所示,M0 为屎肠球菌(Enterococcus faecium),M1、M3、M4和M6均鉴定为植物乳杆菌(Lactobacillus plantarum),序列同源性均大于99%,结果与生理生化鉴定结果一致。已有的研究结果显示泡菜中存在着丰富的乳酸菌种群,主要包括乳杆菌属、肠球菌属、葡萄球菌属、片球菌属以及明串珠菌属等,其中植物乳杆菌为优势菌[15]。本研究中从8%NaCl泡菜发酵卤水中分离到屎肠球菌和植物乳杆菌,表明这两个种群的一些菌株具有较高的耐盐性。
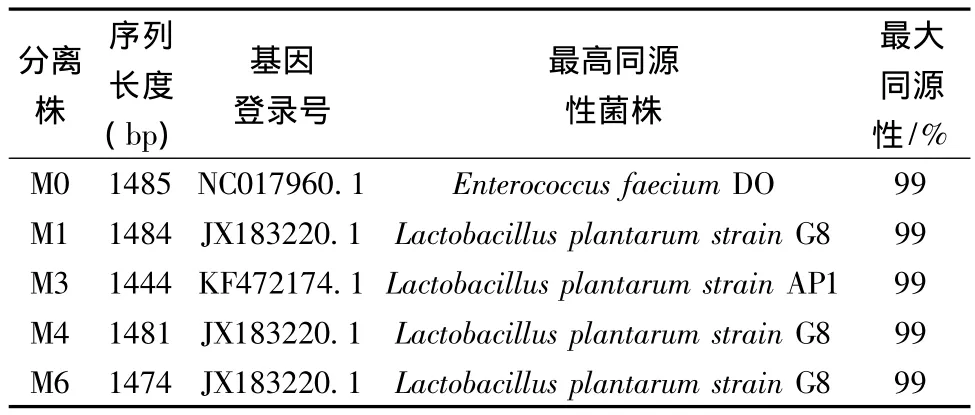
表3 分离株16S rDNA序列同源性分析结果Table 3 Results of 16S rDNA sequence homology analysis for isolates
2.7 乳酸菌分离株在不同盐浓度蔬菜汁模型中的生长动力学参数测定结果
将乳酸菌分离株E.faecium M0和L.plantarum M1、M3、M4和M6按1.0%接种量接种不同NaCl含量的黄瓜汁,应用Bioscreen自动生长曲线分析仪测定60 h生长曲线(结果未列出),通过Gompertz方程拟合曲线计算最大生长速率(μmax)和最大群体密度(Nmax)结果如表4所示。结果表明NaCl对乳酸菌的生长能力具有明显的抑制作用,4%NaCl对大多数菌株显示出明显的抑制,使μmax和Nmax显著下降,随着NaCl浓度升高,生长抑制作用逐步增强。不同菌株具有不同的耐盐特征,其中E.faecium M0生长快、耐盐性最好,在2.0%NaCl的黄瓜汁中生长最快(μmax=0.064 h-1,Nmax=0.588),随着 NaCl浓度的上升,μmax和Nmax逐渐下降,但最终能在10%NaCl黄瓜汁中显示了微弱的生长(μmax=0.006 h-1,Nmax=0.185);L.plantarum生长速度相对较慢,耐盐性较弱,但具有菌株差异性,在8%NaCl的黄瓜汁中M4不能生长,M1显示了微弱生长(μmax=0.007,Nmax=0.122),而M3和 M6能较好的生长,μmax值分别为0.016和0.015 h-1。
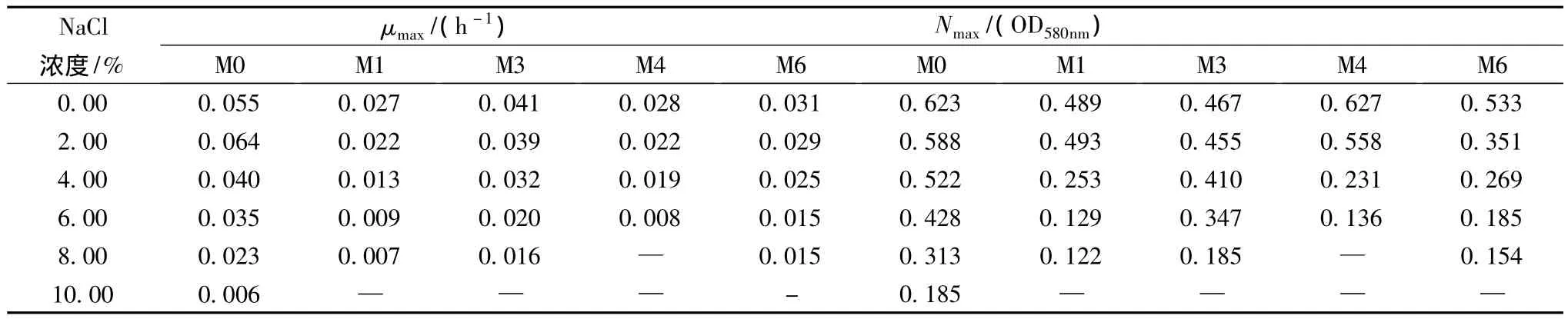
表4 起始NaCl浓度对不同乳酸菌分离株的生长动力学参数的影响Table 4 The influence of initial NaCl concentration on the growth kinetic parameters of different lactic acid bacteria isolates
乳酸菌对NaCl的耐受能力具有种属特异性,研究表明植物乳杆菌能耐受9.1%NaCl[16],但是细菌对盐的耐受性取决于菌株及其生理状态[17]。本研究中发现L.plantarum M3和M6能在8.0%NaCl的黄瓜汁中较好的生长,但M1生长微弱,M4不能生长,在不同盐浓度下最大生长速率和群体密度也显著不同,表明植物乳杆菌菌株之间对NaCl的耐受能力存在差异。肠膜明串珠菌是泡菜发酵中的优势菌,但研究显示6.4%NaCl就能抑制肠膜明串珠菌生长[16],屎肠球菌属于同型发酵乳酸菌,产酸快,被广泛用于改善食品、饲料的质量[18-19]。本研究发现M0生长快、耐盐性最好,能在10%NaCl黄瓜汁中生长,在高盐泡菜发酵早期屎肠球菌可能发挥了重要作用。
2.8 分离株及其组合接种发酵对泡菜pH变化的影响
以8%NaCl蔬菜汁作为模型,以自然发酵作为对照,研究了接种106CFU/mL和108CFU/mL单菌种增效发酵后的酸化趋势,结果乳酸菌接菌量为106CFU/mL组与未接乳酸菌的自然发酵的pH值下降趋势没有显著区别(结果未列出)。当乳酸菌接种量为108CFU/mL时,pH值下降显著快于对照组。接入球菌M0蔬菜汁在起始48 h内,pH值下降显著快于3株植物乳杆菌,但在48 h之后,M0产酸减弱,但其余3株植物乳杆菌产酸增强,其中M3和M6接种组尤为明显,在72 h后pH后显著低于M0接种组。选择球菌M0和杆菌M3和M6进行不同的配比,接种后pH变化趋势结果如图4所示。
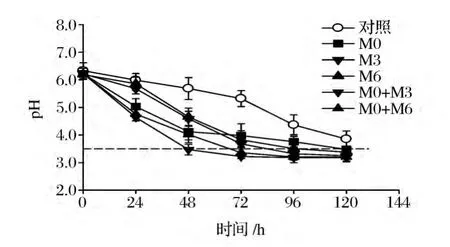
图4 不同分离株及其组合接种发酵对泡菜pH变化的影响Fig.4 The effects of isolates and their combinations on the pH change during fermentation
结果显示,组合接种组M0+M3(1∶1接种)产酸速度高于 M0和 M3单独接种组,在 48 h达到pH3.5,M0+M6(1∶1接种)在 72 h 达到 pH3.5,两个组合均显著低于对照组和单独接种组(P<0.05),但是与其他接种比例的组合(结果未列出)的pH变化趋势没有显著差异(P>0.05)。结果表明M0+M3组合接种组产酸最快,适合作为高NaCl浓度泡菜发酵剂的进一步研究。
3 结论
论文对起始盐浓度为2.0%(低盐)和8.0%(高盐)泡菜发酵过程中pH、总酸、细菌菌落总数、乳酸菌总数以及大肠菌群的变化规律进行了测定与分析,并从盐浓度为8.0%的泡菜发酵卤水中分离得到5株乳酸菌,并对菌株在不同盐含量的蔬菜汁中的生长动力学参数及其产酸特性进行了分析,结果表明:
(1)高盐泡菜发酵产酸速度显著低于低盐泡菜,但在发酵后期两者均能达到pH3.5~3.8。高盐泡菜起始菌落总数、乳酸菌总数以及大肠菌群数均显著低于低盐泡菜。发酵过程中,菌群变化呈先上升后下降趋势,其中8.0%盐浓度泡菜菌落总数及大肠菌群数缓慢上升,144 h后开始缓慢下降,而在低盐泡菜中24 h后迅速下降,结果表明蔬菜携带的自然菌群中包含耐盐性和盐敏感性群体,高浓度盐对盐敏感性乳酸菌的抑制是发酵周期延长的主要原因,通过提高起始耐盐性乳酸菌数量可以加快高盐泡菜成熟。
(2)从高盐泡菜发酵卤水中分离获得1株球菌(M0)和4株杆菌(M1、M3、M4 和 M6),经生理生化和分子鉴定,球菌M0属于屎肠球菌(Enterococcus faecium),4株杆菌均鉴定为植物乳杆菌(Lactobacillus plantarum)。5株乳酸菌分离株在含0~10%NaCl的黄瓜汁中的最大生长速率、最大群体密度、以及耐盐特性呈现菌株差异性。菌株M0能够在10%NaCl的黄瓜汁中生长,显示了良好的耐盐性,而在8%NaCl的黄瓜汁中,菌株M3和M6能较好生长,而M4不能生长。结果表明菌株M0、M3和M6具有良好的耐NaCl胁迫的能力,可能是高盐泡菜中的优势乳酸菌。
(3)5株乳酸菌在含8%NaCl的蔬菜汁中呈现不同的产酸特性,球菌M0前期产酸速度快,而杆菌在发酵后期产酸速度快,球菌M0和杆菌M3和M6按不同的配比接种8%NaCl的蔬菜汁,其中M0+M3(1∶1)接种组产酸最快,在48 h达到pH3.5,显著低于对照组和单独接种组(P<0.05),适合用于高盐泡菜发酵剂制备。
[1] 郑炯,黄明发.泡菜发酵生产的研究进展[J].中国调味品,2007(5):22-25.
[2] 李书华,陈封政.泡菜的研究进展及生产中存在的问题[J].食品科技,2007(3):8-11.
[3] 卢晓黎,尼海峰.发酵蔬菜功能菌研究与应用进展[J].中国食品学报,2012,12(2):1-4.
[4] 杨瑞,张伟,陈炼红,等.发酵条件对泡菜发酵过程中微生物菌系的影响[J].食品与发酵工业,2005,31(3):91-92
[5] ZHAO D,DING X.Studies on the low-salt Chinese potherb mustard(Brassica juncea,Coss.)pickle.I—The effect of a homofermentative L(+)-lactic acid producer Bacillus coagulans on starter culture in the low-salt Chinese potherb mustard pickle fermentation [J].LWT,2008,41:474-482.
[6] 孙力军,李正伟,孙德坤,等.纯种接种和促菌物质的添加对苔菜泡菜发酵过程及其品质的影响[J].食品与发酵工业,2003,29(8):103-105.
[7] 李文婷,车振明,雷激,等.乳酸菌制剂发酵泡菜品质及安全性研究[J].西华大学学报(自然科学版),2011,30(3):97-100;112.
[8] 吴丹,陈健初,叶兴乾,等.榨菜腐败微生物的分离、鉴定及生物学特性研究[J].浙江大学学报(农业与生命科学版),2009,35(2):135-140.
[9] 徐婷,张成杰,张桂敏.襄阳孔明菜卤水中耐盐污染菌的分离与鉴定[J].湖北大学学报(自然科学版),2013,35(1):24-28.
[10] Romero-Gil V,Bautista-Gallego J,Rodríguez-Gómez F,et al.Evaluating the individual effects of temperature and salt on table olive related microorganisms[J].Food Microbiology,2013,33:178-184.
[11] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[12] 奥斯伯.精编分子生物学指南 (第五版)[M].北京:科学出版社,2008.
[13] Gupta S,Cox S,Rajauria G,et al.Growth inhibition of common food spoilage and pathogenic microorganisms in the presence of brown seaweed extracts[J].Food Bioprocess Technol,2012,5:1907-1916.
[14] 熊涛,关倩倩,谢明勇.直投式与传统发酵泡菜工艺中病原菌的变化规律[J].食品科学,2012,33(13):140-143.
[15] 盛海圆,郭艳萍,常艳,等.传统泡菜中乳酸菌多样性的分析[J].中国微生态学杂志,2010,22(7):580-582;586.
[16] 杨瑞鹏,赵学慧.几种乳酸菌的生理特性研究[J].中国调味品,1991(11):15-17.
[17] Hajmeer M,Ceylan E,Marsden JL,et al.Impact of sodium chloride on Escherichia coli O157:H7 and Staphylococcus aureus analysed using transmission electron microscopy[J].Food Microbiology,2006,23(5):446-452.
[18] 王晓丽,王永山,诸玉梅,等.5株乳酸菌的分离鉴定与生物学特性研究[J].江苏农业科学,2011(1):390-392.
[19] 赵树田,张士青,顾欣,等.十种可制作酸奶的乳酸菌体外降解草酸能力评价[J].上海交通大学学报(医学版),2009,29(12):1 463-1 466.

