重组蔗糖异构酶的制备及应用条件优化*
程胜,段绪果,吴敬
1(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
2(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)
异麦芽酮糖(isomaltulose),又称帕拉金糖,是蔗糖的同分异构体,是一种功能性二糖,与蔗糖有着相似的物理性质和口感[1-3]。不同于蔗糖,异麦芽酮糖作为一种新型甜味剂,它具有甜度低、非致龋齿性[4],被人体食用后,在血液中释放单糖的速度缓慢且不刺激胰岛素的分泌,因而有益于糖尿病的防治并可防止脂肪过多的积累,适合糖尿病和肥胖人群食用[5]。与蔗糖相比,异麦芽酮糖具有良好的酸稳定性、极低的吸湿性和无毒性,非常适合在食品上应用。与蔗糖不同的是,异麦芽酮糖作为一种还原糖,可以作为前体继续加氢生成异麦芽酮糖醇,相比于异麦芽酮糖,异麦芽酮糖醇有着更优良的性质,是一种新型的功能性食用糖醇,更是一种最理想的代糖品[6-7]。
蔗糖异构酶(EC 5.4.99.11),也称异麦芽酮糖合酶,是生物法转化蔗糖生成异麦芽酮糖和海藻酮糖最合适的酶,该酶转化蔗糖的主产物是异麦芽酮糖,同时转化过程中伴随少量单糖(葡萄糖和果糖)的生成[8-14]。1995年,Ralf等人首次将来源于 Protaminobacter rubrum CBS 547.77的蔗糖异构酶在E.coli中进行了成功的表达[15];2010年,Park等实现了Enterobacter sp.的蔗糖异构酶编码基因在Lactococcus lactisMG1363中异源表达,并实现该酶的胞外分泌[16];Lee等在2011年将来源于 Enterobacter sp.的蔗糖异构酶在Saccharomyces cerevisiae EBY100进行成功的表达,并且实现此酶在酵母细胞的表面展示[17]。异麦芽酮糖的生产目前主要有3种方法:单酶转化、游离细胞转化和固定化细胞[13-14,18-20]。1999年,Veronese等[13]用来源于 Serratia plymuthica ATCC 15928蔗糖异构酶,以10%蔗糖为底物,转化5 h,异麦芽酮糖的转化率为 72.6%。Amornrat[12]以20%蔗糖为底物,用Klebsiella pneumoniae NK33-98-8来源的蔗糖异构酶进行催化,最终异麦芽酮糖的转化率为76.8%。Lee等[21]以20%蔗糖为底物,用Protaminobacter rubrum CBS 547.77来源的蔗糖异构酶进行催化,得到异麦芽酮糖的转化率为88.5%。Cha等[14]将来源于Enterobacter sp.FMB-1蔗糖异构酶在E.coli里进行表达,利用游离细胞进行催化,以6%蔗糖为底物,转化16 h,异麦芽酮糖的转化率为78%。
本研究将前期构建的表达质粒pET-24a/palI转化Escherichia coli BL(DE3),构建得到产重组Serratia plymuthica AS9蔗糖异构酶的重组菌株。在摇瓶和3 L发酵罐条件下对重组菌产酶情况进行初步考察基础上,对转化工艺进行优化,以获得高效生产异麦芽酮糖的最优方法。
1 材料与方法
1.1 材料
1.1.1 菌株
大肠杆菌(Escherichia coliBL21(DE3))和重组菌E.coli BL21(DE3)/pET-24a-palI为本实验室保藏[22]。
1.1.2 培养基
LB种子培养基(g/L):蛋白胨 10,酵母粉 5,NaCl 10,卡那霉素的终浓度为30 μg/mL。
TB发酵培养基(g/L):蛋白胨12,酵母粉24,甘油5,K2hpo412.54,KH2PO42.31,甘氨酸 0.75%,卡那霉素终浓度为30 μg/mL。
3 L罐发酵培养基(g/L):甘油8,工业蛋白胨1,工业酵母粉 2,柠檬酸 1.7,(NH4)2HPO44.0,KH2PO413.5,MgSO4·7H2O 1.39,微量元素液 10 mL,调 pH 到7.0
微量元素液 (g/L):FeSO4·7H2O 10.0,ZnSO4·7H2O 5.25,CuSO4·5H2O 3.0,MnSO4·4H2O 0.5,Na2B4O7·10H2O 0.23,CaCl22.0,(NH4)6Mo7O240.1。
补料液 (g/L):甘油 500,MgSO4·7H2O 15,工业级酵母粉4,工业级蛋白胨1.0。
1.1.3 试剂
质粒小量提取试剂盒购于天根生化科技有限公司;卡那霉素购自上海生工生物有限公司;蛋白电泳试剂和蛋白分子质量标准购自南通碧云天技术研究所;酵母粉、蛋白胨购自Oxoid(英国)公司;异麦芽酮糖、海藻酮糖标样购自Sigma公司;其他试剂为国产分析纯。
1.1.4 主要仪器
凝胶成像仪、蛋白电泳仪,美国Bio-Rad公司;Agilent 1100高效液相色谱仪,美国安捷伦公司;细胞破碎仪,浙江宁波新芝生物科技股份有限公司;3 LInfors全自动发酵罐,伊孚森生物技术有限公司(中国)。
1.2 方法
1.2.1 摇瓶发酵产蔗糖异构酶
种子培养:从-80℃保存的甘油管接2%菌液至LB培养基,37℃、200 r/min,培养8 h。培养基使用前添加30 μg/mL卡那霉素。
摇瓶发酵:将种子液以5%的接种量接入添加了30 μg/mL卡那霉素的TB培养基,37℃培养至OD600约为1.5 h,加入终浓度为0.2 mmol/L的IPTG同时降温至25℃进行诱导,在200 r/min条件下继续培养24 h。发酵结束后离心收集发酵上清液,即为蔗糖异构酶粗酶液。
超声破壁:用50 mmol/L,pH 7.0的 Na2HPO4-柠檬酸缓冲液将细胞沉淀复溶到OD600为5,用超声波细胞破碎仪进行破壁处理,离心收集破壁上清检测蔗糖异构酶胞内表达情况。
1.2.2 重组菌在3 L发酵罐的高密度发酵培养
从-80℃保藏的甘油管中以2%的接种量将种子接种于含有30 μg/mL卡那霉素的工业级LB液体培养基中,37℃、200 r/min培养8~10 h。将种子液以8%的接种量接入3 L Infors全自动发酵罐中,初始装液量为1.2 L,初始pH为7.0,初始溶氧校为100%,30 μg/mL的卡那霉素以1.5 mL/L加入发酵罐中,初始转速设为200 r/min。33℃恒温发酵,控制转速与溶氧偶联,维持溶氧水平在30%左右,用25%氨水控制pH 7.0左右。初始培养基中甘油耗尽后,溶氧开始反弹,将补料液按照比生长速率μ=0.2 h-1进行指数流加。同时每隔12 h加1次灭过菌的30 μg/mL的卡那霉素;当DCW为15 g/L,接入10 g/L甘氨酸;当DCW为50 g/L,恒速0.4 g/(L·h)流加10%的乳糖进行诱导,补料液流量梯度递减,整个发酵过程由发酵罐控制系统软件进行在线控制和数据采集。
1.2.3 蔗糖异构酶酶活测定方法
将100 μL适当稀释的酶液加入到900 μL含有蔗糖的柠檬酸-磷酸氢二钠缓冲液(50 mmol/L,pH 6.0)中,使蔗糖的终质量浓度为100 g/L。振荡混匀后置30℃水浴锅中反应15 min,灭酶,离心。反应样品中蔗糖、异麦芽酮糖、海藻酮糖、葡萄糖和果糖的含量利用HPLC进行检测,检测器为示差检测器。
酶活单位定义:在上述条件下,每分钟释放1 μmol异麦芽酮糖所需要的酶量定义为1个酶活力单位。
1.2.4 酶转化蔗糖生成异麦芽酮糖的反应条件优化
1.2.4.1 pH值对蔗糖异构酶转化蔗糖生产异麦芽酮糖的影响
配制pH 4.0~8.0的柠檬酸-磷酸氢二钠缓冲液,以20%的蔗糖为底物,分别溶解于不同pH的缓冲液,加酶量为1 g蔗糖加酶15 U,置于30℃,150 r/min的水浴摇床,转化8 h,HPLC检测异麦芽酮糖生成量。
1.2.4.2 温度对蔗糖异构酶转化蔗糖生产异麦芽酮糖的影响
以20%的蔗糖为底物,加酶量为15 U/g,反应初始 pH 6.5,分别在20、25、30、35、40 和45 ℃水浴摇床转化8 h,HPLC检测异麦芽酮糖生成量。
1.2.4.3 加酶量对蔗糖异构酶转化蔗糖生产异麦芽酮糖的影响
以20%蔗糖为底物,反应初始pH 6.5,加酶量分别为5、10、15、20、25 和 30 U/g,置于 30 ℃,转速为150 r/min的水浴摇床,转化8 h,HPLC检测异麦芽酮糖生成量。
1.2.4.4 反应时间对蔗糖异构酶转化蔗糖生产异麦芽酮糖的影响
以20%的蔗糖为底物,加酶量为20 U/g,初始pH 6.5,置于30℃,转速为150 r/min的水浴摇床,每2 h取样500 μL,HPLC检测异麦芽酮糖的生产量。
1.2.4.5 底物浓度对蔗糖异构酶转化蔗糖生产异麦芽酮糖的影响
分别配制10%、20%、30%、40%和50%的蔗糖,加酶量为20 U/g,初始 pH 6.5,置于30℃,转速为150 r/min的水浴摇床,转化8 h,HPLC检测异麦芽酮糖生成量。
1.2.5 HPLC检测含量
转化后的样品经过加热灭酶后,12 000 r/min离心10 min,取上清用去离子水适当稀释,备用。HPLC检测色谱条件是:Agilent 1200 HPLC色谱仪,Agilent自动进样器,色谱柱4.6 mm×250 mm 5 μm Syncronis Amino Column;Aginent示差检测器;流动相为V(乙腈)∶V(水)=80∶20,流速为 0.8 mL/min;柱温30℃。

2 结果
2.1 重组菌E.coli BL21(DE3)/pET-24a-palI产蔗糖异构酶
2.1.1 重组蔗糖异构酶的表达及摇瓶产酶曲线
从-80℃保藏的甘油管中以2%的接种量接种至LB液体培养基,培养8~10 h。转接TB培养基,加入IPTG至终浓度为0.2 mmol/L,于25℃进行诱导,诱导后每隔3 h取样测酶活,结果如图1所示。
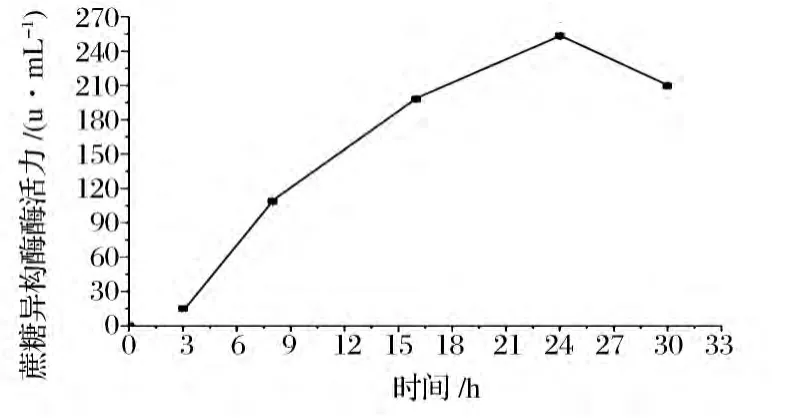
图1 重组菌在TB培养基中的产酶曲线Fig.1 Sucrose isomerase production by E.coli in TB medium
诱导前24 h胞外酶活以较快的速度增加。诱导24 h时,离心取得上清即为粗酶液。菌体沉淀用缓冲液悬浮均匀,超声破碎仪进行细胞破碎,离心取得胞内上清。酶活测定发现,发酵24 h胞外酶活达到最大值为253.1 U/mL,胞内上清酶活为110.2 U/mL。SDS-PAGE电泳(图2)显示,在65 kDa处有目的蛋白条带,与理论的蔗糖异构酶分子质量相符合,表明蔗糖异构酶在E.coli BL(DE3)中成功表达。
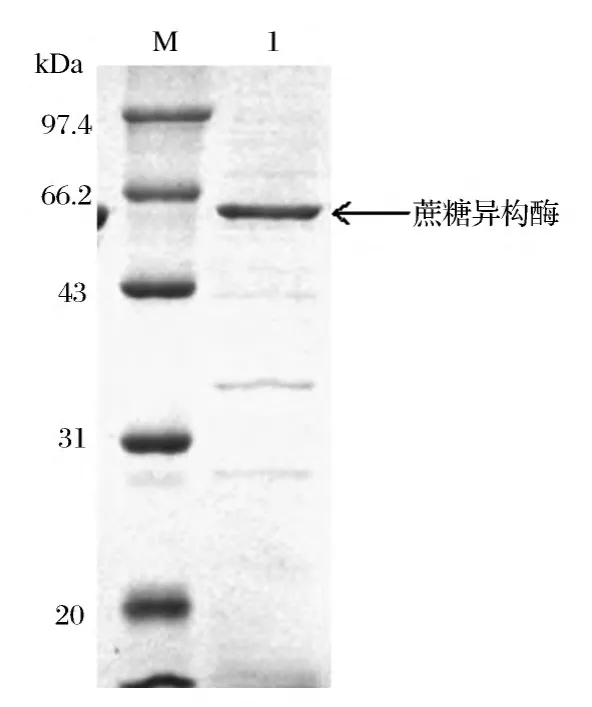
图2 蔗糖异构酶SDS-PAGE分析Fig.2 SDS-PAGE analysis of the sucrose isomerase
2.1.2 3 L罐中高密度发酵生产蔗糖异构酶
重组菌3 L发酵罐条件为:发酵温度33℃,pH 7.0,溶氧水平控制在30%左右,当溶氧迅速反弹时,开始以指数流加方式添加补料液。当DCW为15 g/L,开始加入乳糖诱导,实验中,在其他条件不变下流加乳糖浓度分别为 0.2、0.4、0.8 g/(L·h),诱导发酵33 h。结果如图3所示。
重组菌的胞外酶活如图3所示,其中在0.4 g/(L·h)乳糖诱导浓度下,当诱导30 h时胞外酶活和总酶活均是最高,胞外酶活为654 U/mL,分别是0.2和0.8 g/(L·h)诱导浓度下的1.52和1.43倍;总酶活为1 012 U/mL,分别是0.2和0.8 g/(L·h)诱导浓度下的1.12和1.23倍。此时蔗糖异构酶的胞外酶活占总酶活的61.6%。因此,乳糖的诱导浓度应该选择0.4 g/(L·h)。同时,虽然不同乳糖浓度诱导下酶活力不同,但是其中它们的胞内酶活在诱导18 h均能达到最大值,随着诱导时间的延长,胞内酶活不断分泌到胞外,使得胞内酶活力逐渐下降,而胞外上清酶活继续增大,当诱导30 h,重组菌发酵产酶的胞外酶活均能达到最大值。与摇瓶酶活力相比,重组蔗糖异构酶在3 L罐中最高胞外酶活是摇瓶酶活力的2.58倍。
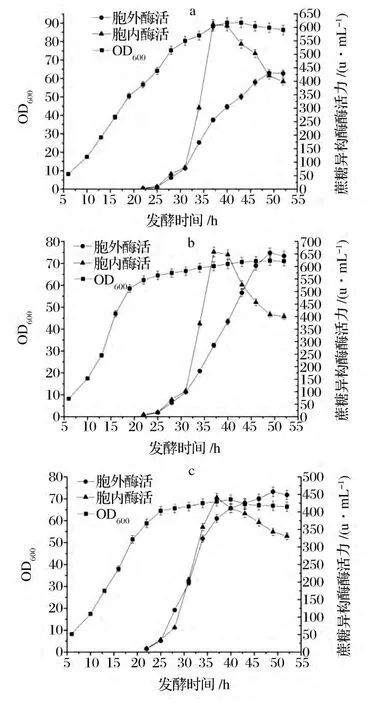
图3 重组菌3 L罐产酶过程Fig.3 Sucrose isomerase production by E.coli in 3 liter fermentor
本实验的研究结果认为重组蔗糖异构酶的乳糖诱导浓度不是越高越好,浓度过高可能会导致蛋白合成速度过快,使得包涵体积累,导致总酶活下降,影响酶的胞外分泌效果。在0.4 g/(L·h)乳糖诱导浓度下,蛋白的表达与分泌得到了较好的协调与统一,因而胞外酶活较其他诱导浓度有较大的提高。
2.2 重组蔗糖异构酶生产异麦芽酮糖转化条件优化
2.2.1 初始pH的影响
如图4所示,当pH为6.5时,异麦芽酮糖转化率最高,达到82.5%。当pH为4.0时,异麦芽酮糖的转化率最低仅为2%。pH在5.5~7.5时,异麦芽酮糖的转化率均高于75%,pH为8.0时,转化率又下降到54.2%,说明了pH中性条件适合酶的转化,偏酸偏碱都不利于异麦芽酮糖的生成。从酶反应动力学的角度分析,pH的影响可能是因为它改变了酶活性部位有关基因的解离状态。在最适pH值时,酶活性部位基团解离状态最适合于酶分子对底物的催化,酶活力高,因此蔗糖转化率最高;而高于或低于最适pH值时,酶分子上活性基团的解离状态不利于酶对底物分子的催化,酶活力下降。因此反应最适pH选为6.5。

图4 初始pH蔗糖异构酶转化的影响Fig.4 Effect of initial pH on the enzymatic conversion
2.2.2 反应温度的影响
如图5所示,30℃下,异麦芽酮糖转化率达到最大值82.5%。同时,随着温度的升高或者下降,异麦芽酮糖含量下降,但是单糖含量(葡萄糖和果糖)由6.2%升高至16.5%(数据未展示)。ZHANG等[10]研究来源于Klebsiella sp.LX3蔗糖异构酶发现,温度可以影响酶转化生产产物的比例,较高的温度有利于生成单糖;WU等[9]年报道称来源于Klebsiella planticola蔗糖异构酶在转化蔗糖生产异麦芽酮糖时,当温度低于30℃,温度的降低有利于海藻酮糖的生成。蔗糖异构酶催化蔗糖生成异麦芽酮糖的过程,同时包含两个过程,水解反应和异构反应。水解反应主要是水解蔗糖生成葡萄糖和果糖;异构反应主要是蔗糖中两种单糖连接的糖苷键发生转换,异构生成异麦芽酮糖和海藻酮糖两种同分异构体。当温度升高时,反应有利于水解过程,故单糖量释放增加。而当温度较低时,反应虽然有利于异构过程,但此时酶的构象更有利于生成海藻酮糖。故本实验选用30℃作为最适反应温度。

图5 反应温度对蔗糖异构酶转化的影响Fig.5 Effect of temperature on the enzymatic conversion
2.2.3 加酶量的影响
如图6所示,随着加酶量的增多,异麦芽酮糖的转化率也在不断地增加,当加酶量为20 U/g时,转化达到最大86.9%。之后,随着加酶量的增加,异麦芽酮糖转化率稍微降低,而单糖含量有所增加。如2.2.2所述,蔗糖异构酶催化过程包括两个反应:水解反应和异构反应。当反应体系中加酶量超过20 U/g时,可能会稍微增强水解反应的进行,从而有利于释放单糖。所以,20 U/g的加酶量是蔗糖异构酶转化蔗糖过程中最优加酶量。
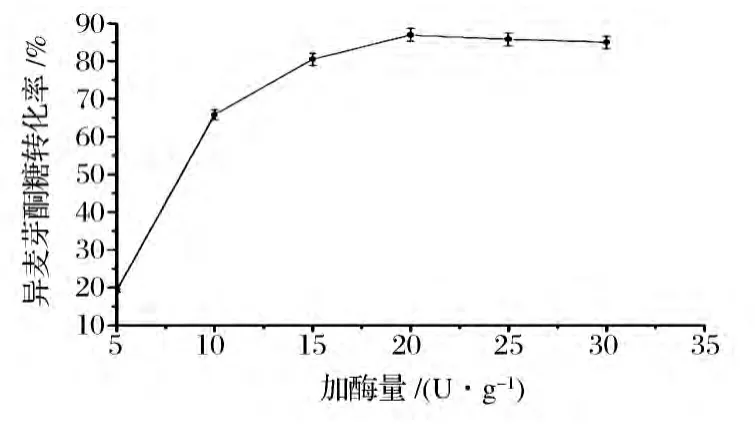
图6 加酶量对蔗糖异构酶转化的影响Fig.6 Effect of enzyme dosage on the enzymatic conversion
2.2.4 反应时间的影响
如图7所示,随着转化时间的延长,异麦芽酮糖转化率也随之提高,转化8 h时,转化率达到最大值86.9%,之后,随着时间的延长,转化率基本不变。蔗糖异构酶在转化蔗糖生成异麦芽酮糖的过程中,在起始的3 h内酶催化反应速率是整个反应过程中的最大值。3 h时转化率即可达到66.9%。在3~8 h内,催化反应速率逐渐减小,异麦芽酮糖的产生量在8 h达到最大值。因此,最佳转化时间可以选择为8 h。
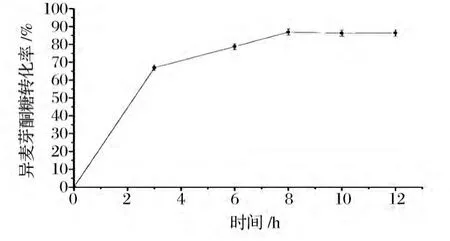
图7 反应时间对蔗糖异构酶转化的影响Fig.7 Effect of transform time on the enzymatic conversion
2.2.5 底物浓度的影响
如图8所示,当蔗糖底物浓度为400 g/L时,转化率可以达到87.9%。蔗糖浓度低于400 g/L时,异麦芽酮糖的生产量随着底物浓度的增加小幅度增加。而500 g/L蔗糖为底物时,不仅转化率下降到83.2%,同时转化过程中发现,在此浓度下,体系在反应后期出现了少数悬浮的球状小体,推测可能是在高浓度的蔗糖浓度下,体系水活力较低,加之蔗糖异构酶本身不稳定,所以出现了少数的蛋白质聚集。因此,400 g/L浓度的蔗糖是最合适的。

图8 底物浓度对蔗糖异构酶转化的影响Fig.8 Effect of substrates concentration on the enzymatic conversion
3 讨论
早在 1983 年,Fujii等[23]从 Serratia plymuthica NCIB 8285中分离得到蔗糖异构酶,之后通过固定化细胞转化蔗糖,生成的产物包括异麦芽酮糖、海藻酮糖、葡萄糖和果糖,此外还有极少量的异松三糖生成。1999 年,Veronese 等[13]从 Serratia plymuthica ATCC 15928得到蔗糖异构酶,并对该酶进行纯化,对得到的纯酶进行相关酶学性质的研究。进一步通过实验证明了在蔗糖转化异麦芽酮糖过程中葡萄糖是蔗糖的竞争性底物,同时提出温度可能是影响酶催化反应的关键因素。南京工业大学任贲等人[24]在E.coli克隆表达来源于Erwinia rhapontici NX-5的蔗糖异构酶,对重组菌产酶的培养条件及诱导剂进行了优化,在最优条件下,蔗糖异构酶的最大酶活为14.72 U/mL。在上述研究的基础上,本研究在E.coli BL21(DE3)中成功表达了来源于Serratia plymuthica AS9的蔗糖异构酶基因(palI),重组菌摇瓶发酵胞外酶活为253.1 U/mL。3 L发酵罐高密度发酵初步研究得到胞外最大酶活654 U/mL,也是目前文献报道的最高酶活。下一步研究重点是将该重组菌在3 L发酵罐中进行优化,获得更高表达量的蔗糖异构酶酶液。
国内南京工业大学李莎等[11]在大肠杆菌中克隆表达来源于Erwinia rhapontici NX-5的蔗糖异构酶,任贲等[25]利用该重组酶转化浓度为55%的蔗糖,可以得到异麦芽酮糖的转化率为83%。李莎等[11]之后利用重组菌游离细胞转化55%的蔗糖,最终异麦芽酮糖的转化率达到87%。本研究在考察了pH对酶转化的影响的基础上,对其他的影响条件,如温度、加酶量、转化时间以及底物浓度等进一步研究,最终把异麦芽酮糖的转化率提高到87.9%,同时底物浓度达到40%,是目前文献报道在400 g/L底物浓度下,单酶转化蔗糖生成异麦芽酮糖的最大转化率。
此外,大部分微生物来源的蔗糖异构酶热稳定性较差[8-10,12],最适温度为30~40 ℃。本研究中的重组蔗糖异构酶在50℃下半衰期仅为8 min左右,热稳定性较差。同时蔗糖作为微生物丰富的碳源,低温下转化过程容易引起其他微生物的生长和消耗蔗糖,不利于酶转化反应的连续进行。因此,在后续的工作中考虑到利用定点突变来提高蔗糖异构酶的热稳定性,进一步满足工业上酶转化反应在较高温度下的连续进行。
4 结论
本研究中重组E.coli BL(DE23)/pET-24a-palI菌株能够高效分泌表达蔗糖异构酶,摇瓶发酵初步研究得到胞外上清酶活253.1 U/mL,3L发酵罐中在0.4 g/(L·h)乳糖诱导浓度下高密度发酵得到发酵上清的最大酶活可达到654 U/mL。对该重组蔗糖异构酶转化蔗糖生成异麦芽酮糖酶法转化条件进行了优化。结果表明,最优条件为底物浓度为400 g/L,反应初始pH 6.5,温度30℃,加酶量20 U/g,转化时间8 h,异麦芽酮糖可以达到最大转化率87.9%。
[1] Takazoe I.Palatinose:an isomeric alternative to sucrose[P].United States.US9046960.1989.
[2] Low N,Sporns P.Analysis and quantitation of minor di-and trisaccharides in honey,using capillary gas chrom-atography[J].Journal of Food Science,1988,53(2):558-561.
[3] Hamada S.Role of sweeteners in the etiology and prevention of dental caries[J].Pure and Applied Chemistry,2002,74(7):1 293-1 300.
[4] Minami T,Fujiwara T,Ooshima T,et al.Interaction of structural isomers of sucrose in the reaction between sucrose and glucosyltransferases from mutansstreptococci[J].Oral Microbiology and Immunology,1990,5(4):189-194.
[5] Lina B A,Jonker D,Kozianowski G.Isomaltulose(Palatinose):a review of biological and toxicological studies[J].Food and Chemical Toxicology,2002,40(10):1 375-1 381.
[6] Lichtenthaler F W.Unsaturated O-and N-heterocycles from carbohydrate feedstocks[J].Accounts ofChemical Research,2002,35(9):728-737.
[7] Schiweck H,Munir M,Rapp K,et al.New developments in the use of sucrose as an industrial bulk chemical[J].Zuckerindustrie,1990,115(7):555-565.
[8] Ravaud S,Watzlawick H,Haser R,et al.Overexpression,purification,crystallization and preliminary diffractio-n studies of the Protaminobacter rubrumsucrose isomerase SmuA[J].Acta Crystallographica Section F:Structural Biology and Crystallization Communications,2005,62(1):74-76.
[9] Wu L,Birch R G.Characterization of the highly efficient sucrose isomerase from Pantoea dispersa UQ68J and cloning of the sucrose isomerase gene[J].Applied and Environmental Microbiology,2005,71(3):1 581-1 590.
[10] ZHANG D,LI X,ZHANG L-H.Isomaltulose synthase from Klebsiella sp.strain LX3:gene cloning and characterization and engineering of thermostability[J].Applied and Environmental Microbiology,2002,68(6):2 676-2 682.
[11] LI S,CAI H,QING Y,et al.Cloning and characterization of a sucrose isomerase from Erwinia rhapontici NX-5 for isomaltulose hyperproduction[J].Applied Biochemistry and Biotechnology,2011,163(1):52-63.
[12] Aroonnual A,Nihira T,Seki T,et al.Role of several key residues in the catalytic activity of sucrose isomerase from Klebsiella pneumoniae NK33-98-8[J].Enzyme and Microbial Technology,2007,40(5):1 221-1 227.
[13] Véronèse T,Perlot P.Mechanism of sucrose conversion by the sucrose isomerase of Serratia plymuthica ATC C 15928[J].Enzyme and Microbial Technology,1999,24(5):263-269.
[14] Cha J,Jung J,Park S,et al.Molecular cloning and functional characterization of a sucrose isomerase(isomalt-ulose synthase)gene from Enterobacter sp.FMB-1[J].Journal of Applied Microbiology,2009,107(4):1 119-1 130.
[15] Klein K,Kunz M,Mattes R,et al.DNA's encoding sucrose isomerase and palatinase[P].United States.US57861 40.1998-07-28.
[16] Park J Y,Jung J H,Seo D H,et al.Microbial production of palatinose through extracellular expression of a sucr-ose isomerase from Enterobacter sp.FMB-1 in Lactococcus lactis MG1363[J].Bioresource Technology,2010,101(22):8 828-8 833.
[17] Lee G Y,Jung J H,Seo D H,et al.Isomaltulose production via yeast surface display of sucrose isomerase fromEnterobacter sp.FMB-1 on Saccharomyces cerevisiae[J].Bioresource Technology,2011,102(19):9 179-9 184.
[18] Ahn S J,Yoo J H,Lee H C,et al.Enhanced conversion of sucrose to isomaltulose by a mutant of Erwinia rhapo ntici[J].Biotechnology Letters,2003,25(14):1 179-1 183.
[19] Kawaguti H Y,Sato H H.Isomaltulose production by free cells of Serratia plymuthica in a batch process[J].Food Chemistry,2010,120(3):789-793.
[20] Kawaguti H Y,Sato H H.Production of isomaltulose obtained by Erwinia sp.cells submitted to different treatments and immobilized in calcium alginate[J].Ciencia E Tecnologia De Alimentos,2011,31(1):257-263.
[21] Lee H C,Kim J H,Kim S Y,et al.Isomaltose production by modification of the fructose-binding site on the bas is of the predicted structure of sucrose isomerase from"Protaminobacter rubrum"[J].Applied and Environmental Microbiology,2008,74(16):5 183-5 194.
[22] 吴敬,程胜,段绪果.一种热稳定性和分泌效率提高的蔗糖异构酶突变体及其制备方法[P].中国.CN104059901A.2014.
[23] Fujii S,Kishihara S,Komoto M,et al.Isolation and characterization of oligosaccharides produced from sucro-se by transglucosylation action of Serratia plymuthica[J].Journal of Japanese Society of Food Science and Techn-ology(Japan),1983,30(6):339-344.
[24] 任贲,李莎,徐虹,等.蔗糖异构酶基因在 Escherichia coli BL21(DE3)中的表达及重组菌的细胞固定化[J].食品与发酵工业,2010,36(6):1-6.
[25] REN B,LI S,XÜ H,et al.Purification and characterization of a highly selective sucrose isomerase from Erwini-a rhapontici NX-5[J].Bioprocess and Biosystems Engineering,2011,34(5):629-637.

