外周血清趋化因子IP-10和Fractalkine及其受体在早期诊断移植肾急性排斥反应的应用
刘一帆,苏泽轩,张 清,石利平,程云华(广州医科大学附属第五医院泌尿外科,广州 50700;暨南大学附属第一医院泌尿外科;通讯作者,E-mail:suz008@6.com)
终末期肾病的调查数据显示全球肾替代治疗已超140万人次,且每年以7%的比例增长[1],我国慢性肾脏病的总患病率高达10.8%[2],虽然目前国内大中心1年移植肾存活率已普遍超过95%,但10年生存率只为50%[3]。肾移植的预后主要取决于是否发生急性或慢性排斥反应,如何提高肾移植术后排斥反应的诊断水平,成为当前研究热点。KDIGO指南指出发生急性排斥反应时,在不延误治疗的前提下,应在治疗前先行移植肾活检,肾活检仍是目前急性排斥反应诊断的主要方法[4],但作为有创检查,存在术后移植肾血肿、破裂及感染等各种潜在并发症,且不宜短期内重复检查,加上检查费用及患者的接受程度等因素制约了肾活检的常规开展。近年研究显示,在外周血、尿中新型标记物及基因检测在无创诊断肾移植急性排斥反应的应用中有着广阔的前景。有研究显示,部分趋化因子及其受体在肾移植过程中起到关键作用。早期研究表明,趋化因子家族中的 CXCL10/IP-10及受体 CXCR3和Fractalkine及受体CX3CR1,参与调节机体的免疫应答,并作用于 T、B、NK 细胞[5-7],这些细胞的活化是移植免疫进入特异性反应阶段的前提,故两者与移植肾的急性排斥有着密切联系。
本试验通过监测同种异体肾移植患者外周血中Fractalkine,IP-10及其受体表达在术后的动态变化,研究它们与急性排斥(AR)的相关性,探讨其在肾移植AR早期诊断中的应用价值。
1 资料与方法
1.1 临床资料
前瞻性地收集2009-10~2012~03在暨南大学附属第一医院因终末期肾病需行同种异体肾移植术的住院患者52例,男女比例为1.3∶1(男性30名,女性22名),平均年龄(49.6 ±9.9)岁(28-66岁)。平均冷缺血时间(3.6±1.5)h。原发病均为慢性肾小球肾炎、糖尿病肾病、慢性肾功能不全(尿毒症期)。供、受者血型相同40例,血型不同但符合输血原则12例。
1.2 纳入标准
①因终末期肾病在本中心行同种异体肾移植的患者。②术后免疫抑制剂使用方案符合KDIGO(Kidney Disease Improving Global Outcomes,改善全球肾脏病组织)指南。③向患者及家属解释并接受签署知情同意书。
1.3 排除标准
①伴随有其他感染性疾病或者恶性肿瘤病史。②术后出现明显的外科并发症。
1.4 分组
根据术后临床表现、辅助检查及移植肾穿刺病理学检查结果,在排除感染及其他干扰因素后(2例男性患者因术后感染排除在外)分为2组:AR组(n=15)均发生在移植后住院期间,AR组确诊是急性排斥的时间为平均术后4.8 d(4-7 d);非AR组(n=35)。健康志愿者12例,作为正常对照组。
1.5 术后免疫抑制方案
肾移植术后,采用标准的三联维持免疫抑制:钙调神经磷酸酶抑制剂(他克莫司:低谷浓度5-10 ng/ml,或环孢素:低谷浓度200-300 ng/ml)、霉酚酸酯或硫唑嘌呤、强的松(移植后一个月内剂量从80 mg/d逐渐减少到10 mg/d),7 d后根据血药浓度调整他克莫司或者环孢素A剂量。一旦诊断急性排斥后,采用3 d甲基强的松龙冲击治疗[6-10 mg/(kg·d)]。
1.6 样本收集
所有肾移植患者均常规于术前1 d以及术后1,3,5,9 d采集外周血2-3 ml,12 例健康对照组血清来自我院体检中心,所有血标本都在10 min,3 000 r/min设置下离心,取血清保存在-80℃液氮灌中,以便后续统一检测。
1.7 急性排斥诊断标准
以移植肾穿刺活检病理诊断为依据。
1.8 外周血CXCL10/IP-10及受体CXCR3和Fractalkine及受体CX3CR1的检测
采用双抗体夹心ELISA方法,试剂盒购自广州威佳科技有限公司,华美试剂盒(产品编号:CSBE09942h/Lot:J21012596;CSB-E08850h/Lot:J19012597;CSB-E04558h/Lot:J06012595; CSB-E08181h/Lot:J19012594),酶标仪(南京华东电子集团医疗装备有限责任公司,DG5033A型);严格按说明书操作。
1.9 统计方法
2 结果
2.1 一般特征资料
50例入选患者的年龄、体重、性别、冷缺血时间、并发症、HLA错配、免疫抑制药物使用等情况见表1,两组间的基线资料均无统计学差异(P>0.05)。
2.2 移植前后两组患者外周血血清IP-10以及CXCR3表达的比较
正常人血中IP-10和CXCR3的浓度分别为(66.74 ±11.77)pg/ml和(583.99 ±157.21)pg/ml。肾移植术后,AR组(n=15)中有13例患者可观察到IP-10以及CXCR3的表达较术前上升,并明显高于正常对照组(P<0.05),AR组的IP-10在术后5 d内显著高于 NAR组,CXCR3在术后各个检测点均显著高于非急性排斥组(non-acuterejection,NAR)。而术后NAR组Fractalkine和CX3CR1移植前后的变化不大,且无统计学意义(P>0.05,见表2)。另外,AR组的标记物的表达与时间呈正相关,具有统计学意义,其中以CXCR3的相关系数(r)较大,达 0.70。
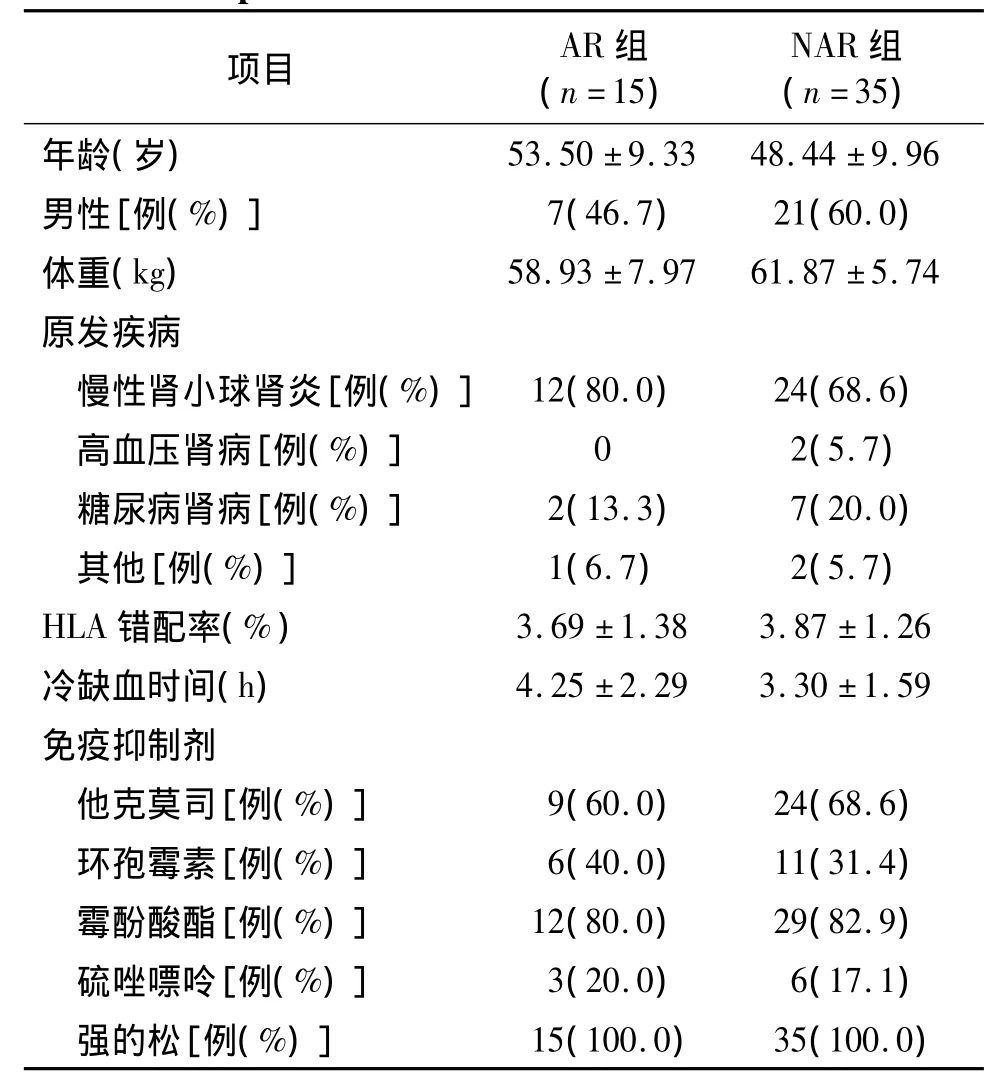
表1 入选的AR组与NAR组患者基线特征比较Table 1 Demographic characteristics of AR and NAR patients
2.3 移植前后两组患者的外周血清的Fractalkine以及CX3CR1表达的比较
正常人外周血中Fractalkine及其受体CX3CR1的浓度分别为(1 250.96 ±230.68)pg/ml、(241.85±53.39)pg/ml。术前两组的Fractalkine及其受体并无显著性差异,但两者与正常对照组相比有统计学差异(P <0.05)。
肾移植术后,AR组(n=15)中有14例患者可观察到Fractalkine及其受体CX3CR1的表达均有不同程度的上升,术后AR组的CX3CR1在术后1,3,5,9 d均比 NAR 组高(P <0.05),而 Fractalkine在术后第5天显著高于NAR组,另外,我们观察到其中有3例AR患者在术后血肌酐与术前对比升高不明显,但Fractalkine以及CX3CR1的表达已经明显较前升高。同样,NAR组Fractalkine和CX3CR1表达在移植前后无明显变化,见表2。AR组的Fractalkine及CX3CR1的高表达与时间均呈正相关(P<0.05),两者相关系数分别为 0.45 和 0.56。
表2 肾移植AR组和NAR组患者血清趋化因子及受体的表达(±s,pg/ml)Table 2 Serum levels of chemokines and their receptors in AR and NAR groups(±s,pg/ml)

表2 肾移植AR组和NAR组患者血清趋化因子及受体的表达(±s,pg/ml)Table 2 Serum levels of chemokines and their receptors in AR and NAR groups(±s,pg/ml)
与 NAR 组比较,*P<0.05
指标 组别 术前1 d 术后1 d 术后3 d 术后5 d 术后9 d Fractalkine AR 组 1 629.29 ±201.05 1 801.98 ±262.99*1 865.46 ±237.51*2 046.43 ±234.46* 1 643.65 ±310.54*NAR 组 1 493.69 ±209.98 1 465.97 ±264.90 1 487.15 ±263.57 1 544.72 ±264.24 1 588.53 ±240.47 CX3CR1 AR 组 356.24 ±77.77 379.48 ±70.47* 398.34 ±80.49* 402.04 ±47.09* 473.54 ±86.49*NAR 组 325.61 ±55.43 309.86 ±63.78 310.24 ±63.12 365.51 ±74.26 290.42 ±65.42 IP-10 AR 组 94.72 ±34.98 107.49 ±34.99* 114.24 ±26.95* 175.84 ±64.25* 113.13 ±19.04*NAR 组 83.31 ±14.93 80.17 ±16.S63 99.75 ±20.94 103.43 ±20.66 102.08 ±20.70 CXCR3 AR 组 755.68 ±154.22 821.69 ±134.73*1 174.47 ±173.21*2 122.99 ±216.10*1 489.70 ±518.03*NAR 组 661.68 ±120.95 674.73 ±135.29 691.12 ±143.69 718.26 ±164.13 449.38 ±145.47 Scr AR 组 599.3 ±18.00* 635.14 ±19.73* 679.43 ±23.41* 573.6 ±21.30* 599.98 ±33.54 NAR 组 507.11 ±55.29 426.73 ±73.66 345.54 ±104.05 218.3 ±135.30 586.88 ±48.43
2.4 激素冲击治疗对外周血中IP-10及Fractalkine及其受体的表达的影响
患者确诊为急性排斥均在术后4-7 d,在激素冲击治疗2-3 d后,AR组8例患者血肌酐、IP-10及Fractalkine及其受体的表达与确诊当天相比均有不同程度的下降,其中以CXCR3、IP-10为著,以在术后9 d最明显,表明这些患者为激素治疗敏感,但与非AR组比较,差异仍有显著性。此外,2例患者治疗后所有指标无下降,表明为激素耐药,改用OKT3(抗CD3 细胞单克隆抗体)治疗[0.1 mg/(kg·d)]。
2.5 趋化因子及其受体在预测肾移植术后急性排斥反应准确度的ROC分析
由于AR组的四个指标在术后1 d的数值均显著高于NAR组,故本文分别采用四个指标在术后1 d的数据与是否发生急性排斥反应做ROC曲线分析,结果见表3、图1-2。IP-10在预测急性排斥反应的 AUC 值为0.74(95%CI 0.57-0.91),而 Fractakine则为0.75(95%CI 0.61-0.89),两者比较并无显著性差异。分别联合IP-10与Fractakine、CX CR3与CX3CR1再次行ROC曲线分析,结果显示:两者联合后预测急性排斥反应的AUC值分别提高至0.86(95%CI 0.77-0.96)和 0.83(95%CI 0.70-0.96)。
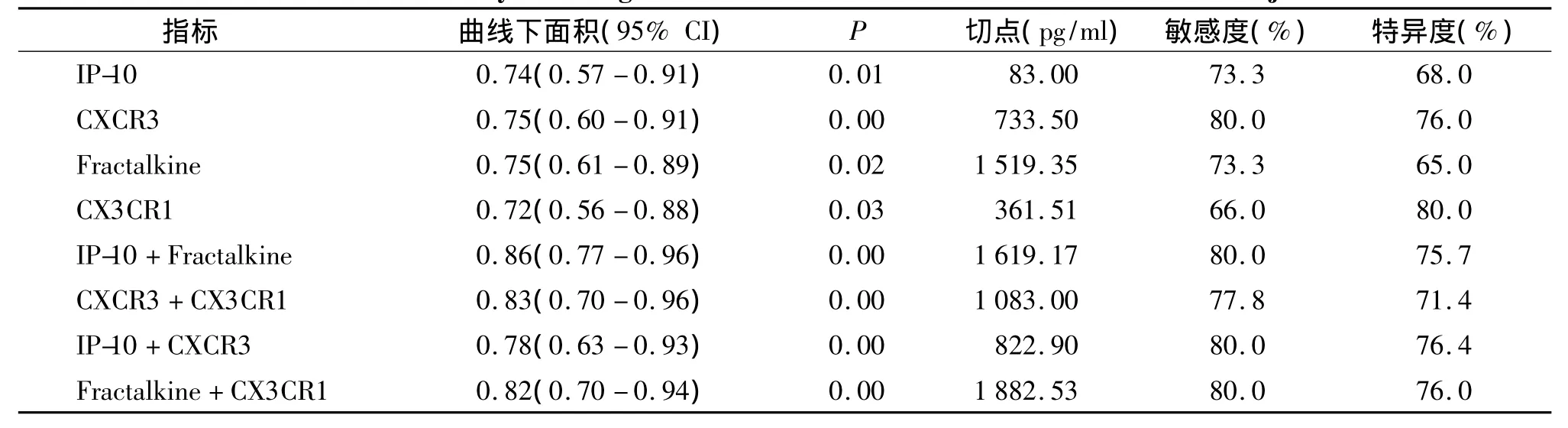
表3 标记物单独及联合在预测肾移植急性排斥反应的ROC分析结果汇总Table 3 Results of ROC curve analysis of single or combined detection of chemokines for acute rejection
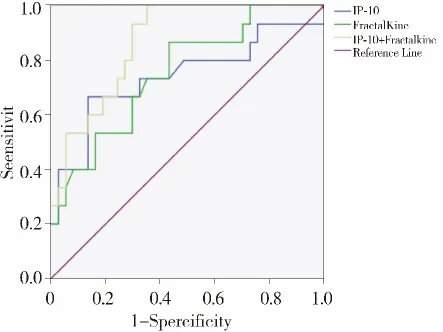
图1 IP-10、Fractalkine单独及联合检测预测肾移植急性排斥反应的ROC曲线Figure 1 ROC curve analysis of IP-10 and Fractalkine alone or in combination for predicting acute rejection
3 讨论
生物标记物的重要性在临床实践中不言而喻。在器官移植领域中,生物学标记物的应用尚处在摸索初始阶段。在同种异体肾移植术后,移植物的功能多通过血肌酐、尿量、临床表现或者一些免疫性指标监测,由于缺乏特异性,这些指标都不能成为反映移植肾免疫状态的标记物。近年来一些关于新型生物标记物在移植领域的研究结果提示,在早期预测急性排斥中有较高的特异性和敏感性,它将指导我们临床更合理、准确地使用免疫抑制剂。

图2 CXCR3、CX3CR1单独及联合检测在预测肾移植急性排斥反应的ROC曲线Figure 2 ROC curve analysis of CXCR3,CX3CR1 alone or in combination for predicting acute rejection
急性移植肾排斥是肾移植术后最常见的并发症,急性排斥的严重程度和治疗效果对移植物的长期存活有直接的影响。急、慢性移植物损伤常伴有白细胞的浸润,炎性细胞的刺激,最终发生纤维化。目前研究显示,趋化因子作为非选择性或特定角色在动物移植实验,甚至在人体试验都显示出巨大的潜力,其在肾移植过程中起到关键作用。趋化因子作为白细胞因子超家族,具有内源性白细胞趋化性,是一类具有活性化作用的碱基—肝素结合性蛋白质的总称,其功能主要是作为各种粒细胞的化学诱导剂,使之从血浆聚集于感染或损伤的部位,并发挥抗炎功能,同时趋化因子也具有调节细胞生物学活性的功能,如淋巴细胞的活化、黏附和脱颗粒等,参与调节机体的免疫应答[8,9]。早期研究表明,CC类的趋化因子 (包括 CCL2/MCP-1,CCL5/RANTES,CCL3/MIP-1a,CCL4/MIP-1B)以及其相应受体(CCR1,CCR2,CCR5)在急性人体移植物排斥反应上调[10,11]。而本文通过检测同种异体肾移植患者外周血中IP-10、Fractalkine及其受体表达,探讨其在预测肾移植术后急性排斥反应的应用价值。
早前研究指出IP-10的mRNA以及其表达的蛋白质可以预测移植物功能[12]。而Hoffmann等指出CXCR3阳性染色比例在急性肾间质及血管排斥中明显升高,而无排斥的移植物活检则无明显变化[13]。Tatapudi等研究结果显示,IP-10以及其受体CXCR3在肾移植排斥反应中的mRNA的表达升高,其敏感度以及特异度分别为 100%、78%,以及63%、83%[14]。而本研究结果显示,肾移植术后,AR组的外周血IP-10以及CXCR3的表达均有逐渐上升趋势,与时间呈正相关(P<0.05),两者在术后第5天达到高峰。另外,我们观察到一些最终确诊为AR患者在早期排斥临床表现不典型,肌酐与基线对比升高不明显或者蛋白尿阴性的情况下,仍可观察到IP-10及其受体的升高。ROC分析结果表明,IP-10、CXCR3对预测肾移植急性排斥反应的准确度分别达到0.74和0.75,两者联合预测AR的准确度可提升至0.86,当以1 619.17 pg/ml为阈值,敏感度、特异度分别为 80.0%,76.4%,综合诊断价值较高。
Fractalkine存在于肾小血管内皮、近端肾小管上皮[15],Fractalkine分为膜结合以及游离两种形式,前者作为黏附分子促发后续白细胞面受体CX3CR1的表达,使NK细胞或者单核细胞结合血管内皮细胞,促进移植物排斥反应的发生[16]。而游离的Fractalkine同样在排斥过程中起到类似作用。受体CX3CR1的缺乏可致NK细胞的减少从而起到保护移植物的作用[17],Fractalkine及其受体在排斥反应中角色不容忽视。目前Fractalkine在心脏移植领域的应用已得到一定认识[16,17],而本研究发现Fractalkine及其受体CX3CR1数值显著高于正常对照组,而术后AR组两者表达显著高于NAR组,AR组标记物的表达随着时间推移而递增,在术后第5天达到高峰。ROC曲线结果显示:当Fractalkine及CX3CR1分别以 1 519.35 pg/ml,361.51 pg/ml为临界点时,敏感度/特异度分别为 73.3%/65.0%,66.7%/80.0%。Wang等约300例样本量的研究结果显示,Fractalkine在判断肾移植术后出现急性排斥反应的AUC达到0.83(95%CI 0.770-0.899),而且其很好地鉴别急性排斥反应患者是否耐受激素[18]。而本研究结果显示:Fractakine的 AUC则为 0.75(95%CI(0.61-0.89),而CX3CR1 则为0.72(95%CI 0.56-0.88),比Wang等的研究结果稍低,且可信区间较大,可能与本研究纳入例数较少有关。
由于 IP-10、Fractakine与相应的受体 CXCR3、CX3CR1存在较强的相关性,故我们采用分别联合IP-10与Fractakine、CXCR3与CX3CR1再次行ROC曲线分析,结果显示:两者预测急性排斥反应的AUC 值分别提高至 0.86(95%CI 0.77-0.96)、0.83(95%CI 0.70-0.96),大于它们各自预测的AUC,这提示我们联合这些指标评价肾移植术后急性排斥反应发生价值更好。
大部分AR患者经激素冲击治疗2-3 d后,在患者临床症状好转以及血肌酐出现下降的同时,IP-10、Fractakine及其受体水平均出现不同程度的下降,提示这些生物标记物可能用来判断免疫抑制治疗的疗效,同时也表明后续的激素冲击治疗对免疫排斥反应可能具有逆转作用。
本研究局限性在于由于观察时间较短,一些AR患者在第9天的生物标记物仍未有显著性下降,而且大部分AR组的数值仍显著高于NAR组,这些因子是否持续维持高位水平,以及这些因子长期如何变化仍有待进一步的研究跟踪。
目前,虽然各种新型免疫抑制剂的使用已经大大改变了肾移植的预后,但是在移植肾功能在未严重受损的情况下,及时、准确地诊断出急性排斥反应并治疗,延长移植肾的存活时间仍为移植科的重要研究方向。在本研究中我们发现肾移植术后出现急性排斥反应的患者在早期临床表现不典型,血清肌酐不升高的情况下,仍可观察到血清中IP-10及受体CXCR3、Fractalkine及受体CX3CR1显著地增高,且与时间呈正相关,IP-10联合Fractalkine在预测AR的总准确度达到0.86,这对于指导临床及时采取进一步检查如移植肾穿刺活检,避免延误治疗时机有着重要意义,而且检测样本收集简单、快捷,故上述趋化因子及其受体有望成为肾移植急性排斥反应的新型无创检测方法。
[1]Schieppati A,Remuzzi G.Chronic renal diseases as a public health problem:epidemiology,social,and economic implications[J].Kid-ney Int Suppl,2005:S7- S10.
[2]Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].Lancet,2012,379(9818):815-822.
[3]中国医院协会血液净化中心管理分会血液透析登记组.我国面临快速增长的终末期肾病治疗负担[J].中国血液净化,2010,9(1):47-49.
[4]Kidney Disease Improving Global Outcomes.Chronic kidney disease:New KDIGO CKD Clinical Practice Guideline published[J].Nat Rev Nephrol,2013,9(3):126-135.
[5]Hancock WW,Wang L,Ye Q,et al.Chemokines and their receptors as markers of allograft rejection and targets for immunosuppression[J].Curr Opin Immunol,2003,15(5):479-486.
[6]Steinmetz OM,Stahl RA,Panzer U,et al.Chemokines and B cells in renal inflammation and allograft rejection[J].Front Biosci(Schol Ed),2009,1:13-22.
[7]Chen YM,Hu-Tsai MI,Lin SL,et al.Expression of CX3CL1/fractalkine bymesangial cells in vitro and in acute anti-Thy1 glomerulonephritis in rats[J].Nephrol Dial Transplant,2003,12(18):2505-2514.
[8]Inston NG,Cockwell P.The evolving role of chemokines and their receptors in acute allograft rejection[J].Nephrol Dial Transplant,2002,17(8):1374-1379.
[9]Segerer S,Cui F,Eitner T,et al.Expression of chemokines and chemokine receptors during human renal transplant rejection[J].Am J Kidney Dis,2001,37(3):518-531.
[10]Panzer U,Reinking RR,Steinmetz OM,et al.CXCR3 and CCR5 positive T-cell recruitment in acute human renal allograft rejection[J].Transplantation,2004,78(9):1341-1350.
[11]Mayer V,Hudkins KL,Heller F,et al.Expression of the chemokine receptor CCR1 in human renal allografts[J].Nephrol Dial Transplant,2007,22(6):1720-1729.
[12]Matz M,Beyer J,Wunsch D,et al.Early post-transplant urinary IP-10 expression after kidney transplantation is predictive of short-and long-term graft function[J].Kidney Int,2006,69(9):1683-1690.
[13]Hoffmann U,Segerer S,Rümmele P,et al.Expression of the chemokine receptor CXCR3 in human renal allografts-a prospective study[J].Nephrol Dial Transplant,2006,21(5):1373-1381.
[14]Tatapudi RR,Muthukumar T,Dadhania D,et al.Noninvasive detection of renal allograft inflammation by measurements of mRNA for IP-10 and CXCR3 in urine[J].Kidney Int,2004,65(6):2390-2397.
[15]Cockwell P,Chakravorty SJ,Girdlestone J,et al.Fractalkine expression in human renal inflammation[J].J Pathol,2002,196(1):85-90.
[16]Robinson LA,Nataraj C,Thomas DW,et al.A role for fractalkine and its receptor(CX3CR1)in cardiac allograft rejection[J].J Immunol,2000,165(11):6067-6072.
[17]Haskell CA,Hancock WW,Salant DJ,et al.Targeted deletion of CX3CR1 reveals a role for fractalkine in cardiac allograft rejection[J].J Clin Invest,2001,108(5):679- 688.
[18]Peng W,Chen J,Jiang Y,et al.Urinary fractalkine is a marker of acute rejection[J].Kidney Int,2008,74(11):1454- 1460.

