导向激光捕获显微切割纯化的贲门腺癌细胞蛋白质表达图谱的建立
程 妍,张 军,刘 冬,伍 洁,宋亚华,龚 均(西安交通大学第二附属医院消化内科,西安70004;西安交通大学第二附属医院病理科;通讯作者,E-mail:jun3z@63.com)
近年来食管下段腺癌及贲门腺癌的发病率逐年增加[1],但贲门腺癌的癌变机制不清。贲门腺癌既是一种多基因疾病,也是一种蛋白质组疾病。基因编码的产物—蛋白质才是生命活动的真正执行者。对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制。
蛋白质组学(proteomics)是指应用各种手段来研究整个基因组编码的全部蛋白质的组成和活动规律的一门学科[2,3]。采用蛋白质组学技术分析肿瘤蛋白质种类、表达水平与修饰的改变,对揭示肿瘤发病机制以及发现肿瘤标志物具有十分重要的作用[3,4]。建立贲门腺癌蛋白质表达谱是开展贲门腺癌蛋白质组学研究的基础工作之一。
已知贲门腺癌组织是由肿瘤实质细胞和各种间质细胞所构成的混合群体,若直接以组织块来研究肿瘤的发病机制,实验结果难免会随所研究细胞在整个组织中的含量不同而差异很大,使得研究结果的客观性和检测重复性受到了很大限制。激光捕获显微切割技术(laser capture microdissection,LCM)是一项在显微镜直视下从组织切片中分离、纯化单一类型细胞群或单个细胞的技术,成功解决了细胞异质性问题,是肿瘤研究领域的一项革命性技术[5]。本研究前期已成功构建了导向激光捕获显微技术(navigated laser capture microdissection,NLCM)用于贲门腺癌蛋白质组学研究的技术平台[6]。
为了建立高分辨率的贲门腺癌细胞的双向凝胶电泳表达图谱,本研究以导向LCM(NLCM)分离纯化贲门腺癌细胞,采用2-DE凝胶电泳和MALDITOF MS的方法,分离、鉴定贲门腺癌表达的蛋白质,构建贲门腺癌的2-DE表达图谱及蛋白质数据库,并为研究贲门腺癌的发生机制和寻找贲门腺癌特异性的蛋白质提供了有价值的基础性资料。
1 材料与方法
1.1 材料
9例高、中、低分化的贲门腺癌患者手术组织标本均来自西安交通大学第二附属医院、唐都医院和陕西省人民医院胸外科,并经病理医师确诊。所有患者在术前均未接受放疗或化疗,患者为50-80岁男性,平均年龄64岁。组织标本于-80℃保存。
1.2 冰冻切片制备
用恒冷切片机将冷冻的贲门腺癌组织制备成厚度为8 μm的切片。
1.3 冰冻切片处理
LCM导向组快速苏木素染色:700 ml/L乙醇固定30 s;超纯水(含蛋白酶抑制剂)浸泡1 min;苏木素染色10-15 s,自来水冲洗5-10 s,然后乙醇15 s,950 ml/L乙醇15 s,无水乙醇15 s×2梯度脱水,二甲苯1 min×2透明,室温完全干燥。NLCM组无染色:除去染色步骤,其余同快速苏木素染色。
1.4 导向激光捕获显微切割
处理后的冰冻切片进行NLCM。采用PixCellⅡLCM系统,通过图像监视器或显微镜观察染色切片(LCM导向组),用LCM图像分析软件(Arcturus Engineering公司)对切片上感兴趣的部位进行取图(导向图),然后换上与染色切片相邻的无染色组织切片(NLCM组),在导向图的指引下准确找到捕获区域,按下按钮发射低能量红外激光,细胞即黏附在转运膜上。将NLCM切割后的组织切片再进行苏木素染色,观察捕获结果,保证细胞捕获效率在90%以上。每个塑料帽发射激光约10 000-12 000次,捕获细胞约25 000-30 000个。每次捕获时间不超过1 h。捕获结束后,将塑料帽盖到0.5 ml离心管上,-80℃冻存备用。
1.5 LCM细胞蛋白提取
将捕获细胞的塑料帽扣在0.5 ml的装有裂解液(7 mol/L尿素,2 mol/L硫脲,40 g/L CHAPS,40 mmol/L Tris-HCl/pH 8.8,65 mmol/L DTT,5 g/L TX-100,蛋白酶抑制剂鸡尾酒)的离心管上,在室温下倒置约5 min,经反复振荡后,于 6 000 r/min离心2 min,按同样的方法处理下一个塑料帽,直到收集到足够的细胞数,于4℃,20 000 r/min离心1 h,提取上清液,Bradford法蛋白定量。
1.6 双向凝胶电泳
提取的总蛋白进行双向电泳,选择13 cm、pH3-10非线性IPG胶条,在蛋白质样品中加入水化液(8 mol/L尿素,20 g/L CHAPS,50 mmol/L DTT,5 g/L TX-100,50 ml/L IPG 缓冲液,痕量溴酚蓝);第一向等电聚焦电泳:20℃,60 μA/IPG strip,30 V 6 h、60 V 6 h、200 V 2 h、500 V 2 h、1 000 V 1 h、稳定在8 000 V,总共30 000 Vh;分别在平衡液Ⅰ(50 mmol/L Tris-HCl/pH 8.8,6 mol/L 尿素,300 ml/L甘油,40 g/L SDS,0.02 g/L 溴酚蓝,10 g/L DTT)和平衡液Ⅱ(50 mmol/L Tris-HCl/pH 8.8,6 mol/L 尿素,300 ml/L 甘油,40 g/L SDS,0.02 g/L溴酚蓝,25 g/L碘乙酰胺)中平衡15 min;第二向SDS 垂直电泳:110 g/L 分离胶,10 mA/gel,20 min,然后20 mA/gel至电泳结束。银染:固定(400 ml/L乙醇,100 ml/L冰醋酸)2 h、敏化(300 ml/L乙醇,2 g/L Na2S2O3,68 g/L 无水乙酸钠)30 min、Milli-Q 水洗涤3次、1 g/L硝酸银染色20 min、Milli-Q水洗涤2 次、显色(2.5 g/L 碳酸钠/0.4 ml/L 甲醛)、10 ml/L冰醋酸终止反应并保存。在相同条件下,实验重复3次。
1.7 凝胶图像分析
用光密度扫描仪采集2-DE图像,用Image Master 2D Platinum Version 5.0凝胶分析软件对图像进行分析,得到的数据列表包括蛋白质点的编号(spot)、量(volume)和面积(area);用体积百分比表示每个蛋白质点的表达强度。用方差分析进行统计学检验。
1.8 胶内酶解
将选取的2-DE凝胶上蛋白质点切成1 mm3大小放入1.5 ml离心管中;用超纯水冲洗两次后,加入脱色工作液200 μl,室温震荡5 min,待凝胶颜色消失后,用超纯水冲洗直到脱色液洗净为止。用乙腈脱水至胶块变为白色后,置于真空干燥泵中抽干;加入200 μl 的 20 mmol/L DTT/25 mmol/L NH4HCO3,56℃还原1 h,室温冷却;加入等体积的55 mmol/L碘乙酰胺/25 mmol/L NH4HCO3,室温避光震荡45 min;用25 mmol/L NH4HCO3冲洗4次,再用乙腈脱水至胶块变为白色,真空干燥泵中抽干;在冰上加入7-10 μl的12.5 ng/μl胰酶溶液,静置 20 min,加入适量25 mmol/L NH4HCO3,冰上静置20 min,37℃过夜;加入50 μl萃取液,超声波处理15 min,吸取上清(酶解后的肽)至另一离心管中,在余下的胶块中再加入50 μl萃取液,超声波处理15 min,合并萃取液,真空干燥抽干。
1.9 质谱分析
抽干的样品用0.2%TFA溶液溶解,然后与10 mg/ml的CHCA基质液按1∶2体积混合,充分混匀,吸取1 μl,点于点样板上,空气中自然干燥;将样品置于Voyager-DETM MALDI-TOF质谱仪上进行分析,采用线性模式、正离子谱测定,设定离子源加速电压为20 kV,质谱信号单次扫描累加80次,用angiotensinⅡ(912.08 D)和 insulin B chain(3 495.95 D)作为内标。
1.10 数据库搜索
用Data Explorer软件对肽质量指纹图谱进行分析,将结果输入到http://www.expasy.org/tools/aldente/,用Aldente软件在SWISS-PROT和TrEMBL数据库中鉴定蛋白质。
2 结果
2.1 NLCM分离的贲门腺癌细胞的2-DE表达图谱的建立
获得了背景清晰、分辨率高、重复性好的贲门腺癌细胞的双向凝胶电泳图谱(见图1)。从图中可以看出,蛋白质点多集中分布于等电点4-8和分子量28-85 kD之间。用ImageMaster软件对图像进行分析,三块凝胶平均蛋白质点数为905±74,匹配点数为799±29,匹配率达88.2%,三块凝胶蛋白质点在位置上有较好的重复性,不同凝胶之间的蛋白质点在等电点(IEF)方向偏差为(1.031±0.205)mm,在 SDS-PAGE 方向偏差为(1.44±0.11)mm。
2.2 蛋白质点的质谱鉴定
从2-DE凝胶中随机切取分辨较清楚的150个匹配的蛋白质点,经胶内原位酶解后进行MALDITOF MS分析,获得了90个肽质量指纹图。贲门腺癌细胞1号蛋白质点的肽质量指纹图(见图2)。将90个肽质量指纹图的质量数据输入到Aldente软件中,查询SWISS-PROT和TrEMBL数据库,结合双向电泳蛋白质点的表观分子量及等电点数值,共鉴定出了72个蛋白质(见表1)。表1中列出了所有已鉴定蛋白质的一些相关信息,包括蛋白质名称、SWISS-PROT中的AC号、蛋白质的分子量和等电点数值、序列覆盖率,匹配肽片段数以及蛋白质的定位和功能分类信息。

图1 NLCM的贲门腺癌细胞的2-DE图谱Figure 1 The 2-DE pattern of GCA cells by NLEM
2.3 已鉴定蛋白质的亚细胞定位与功能分类
依据ExPASy数据库中蛋白质的相关定位和功能信息,对贲门腺癌2-DE表达图谱中鉴定得到的72个蛋白质进行了初步的亚细胞定位(见图3)和功能分类(见图4)。
已鉴定的蛋白质亚细胞定位:细胞质蛋白23个(31.9%),线粒体蛋白 9 个(12.5%),细胞膜蛋白 6个(8.3%),分泌性蛋白5个(6.9%),细胞核蛋白6个(8.3%),骨架蛋白3 个(4.2%),内质网蛋白 3 个(4.2%),高尔基体蛋白2个(2.8%),溶酶体蛋白1个(1.4%),核糖体蛋白 1 个(1.4%),蛋白酶体蛋白1个(1.4%),细胞外基质蛋白 1 个(1.4%),定位未知的蛋白11个(15.3%)。

图2 贲门腺癌细胞1号蛋白质点指纹图Figure 2 Peptide mass fingerprinting of No.1 protein spot of GCA
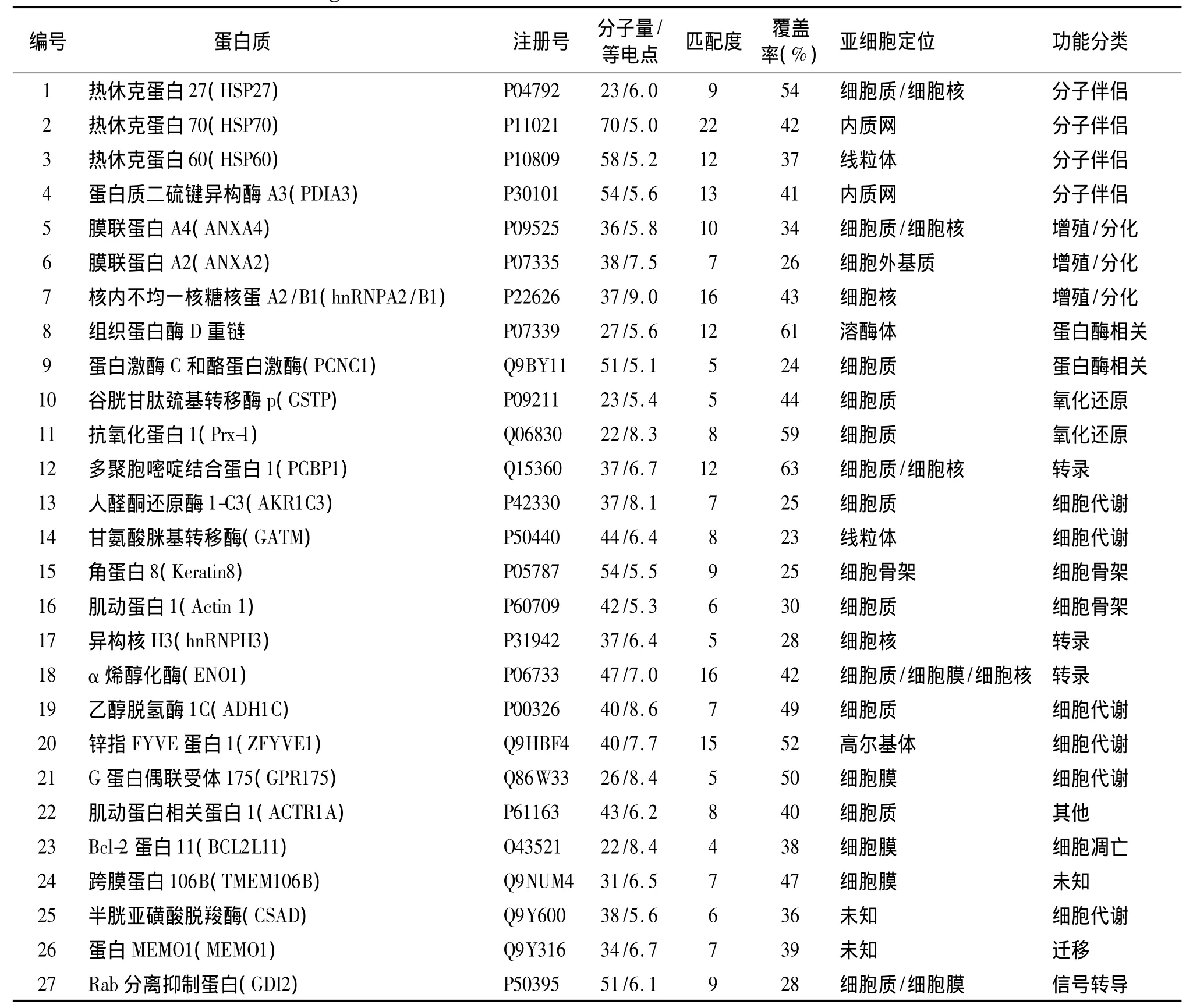
表1 贲门腺癌细胞部分蛋白质鉴定结果Table 1 Proteins related with gastric cardiac adenocarcinoma

表1 贲门腺癌细胞部分蛋白质鉴定结果 (续表)Table 1 Proteins related with gastric cardiac adenocarcinoma (continued)
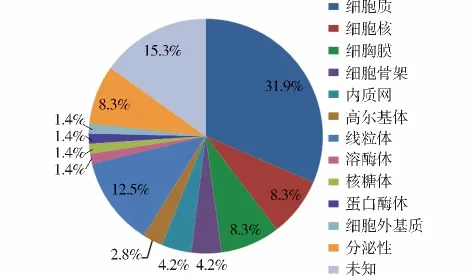
图3 已鉴定贲门腺癌蛋白质亚细胞定位Figure 3 Cellular localization of identified proteins of GCA
已鉴定的蛋白质功能分类:参与细胞代谢占25.0%,参与RNA转录和翻译占6.9%,参与细胞增殖和分化占 6.9%,如膜联蛋白(annexin A4、A2);参与信号转导通路占11.1%,如鸟嘌呤核苷酸结合蛋白(guanine nucleotide-binding protein subunit beta 2-like 1)、视黄醛脱氢酶(retinal dehydrogenase1)等;蛋白质分子伴侣占6.9%,如热休克蛋白(HSP27、60、70);细胞骨架蛋白占4.2%,比如肌动蛋白(actin 1)、角蛋白(CK8、CK13)等;参与细胞氧化还原占4.2%,如过氧化物酶(peroxiredoxin 1、2、3),谷胱甘肽S-转移酶(glutathione S-transferase P)等;参与细胞凋亡占4.2%,如caspase-5 subunit p20等;参与细胞免疫占2.8%,如补体因子B(complement factor B)等;更详细的蛋白质功能分类见图4。
3 讨论
贲门腺癌是我国常见的恶性肿瘤,其发病率逐年升高[1]。目前国内外有关贲门腺癌蛋白质组的研究较少,对贲门腺癌发生的分子机制尚不清楚。
蛋白质组学研究直接定位于蛋白质水平,从整体、动态、定量的角度研究基因的功能。肿瘤蛋白质组学研究为揭示肿瘤发生的分子机制[7]以及肿瘤的诊断、防治和新药开发提供科学依据和靶标[8-10]。
蛋白质表达谱的建立是蛋白质组学研究的一项重要内容。目前,国内外已对鼻咽癌、膀胱癌、乳腺癌、肾癌、肺癌、胃癌[11,12]等多种肿瘤的蛋白质组均进行了一定的研究,己建立众多的基于2-DE的蛋白质表达谱及其数据库,如最著名的 SWISS-2DPAGE就收录了约60种生物体或组织的蛋白质的2-DE参考图谱,其中包括人的心、肝、肾、脑脊液、血小板、巨噬细胞和淋巴细胞等(http://ca.expasy.org/ch2d/)。其中部分肿瘤蛋白质组数据库己建立,并发现了一些肿瘤相关的蛋白质,为发现新的药物靶蛋白提供了有意义的资料。此外,最近有研究指出,过去曾被人们广泛应用蛋白质定量的内标如 GAPDH,β-actin和 β-tubulin等管家蛋白(housekeeping protein)在不同生理或病理状态下表达不相同[13]。因此,为了可靠鉴定贲门腺癌中的差异蛋白质,首先进行表达谱构建是十分必要的。
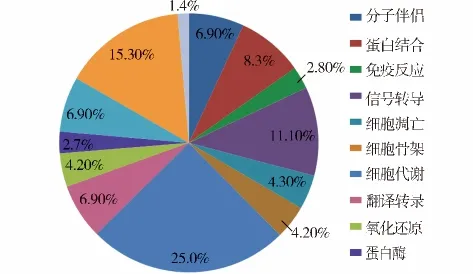
图4 已鉴定贲门腺癌蛋白质功能分类Figure 4 Physiological function of identified proteins of GCA
本研究建立了NLCM分离的贲门腺癌细胞的蛋白质表达谱,实验中采用NLCM技术对贲门腺癌细胞进行分离,提高了贲门腺癌蛋白质表达谱的特异性,并以高、中、低分化的贲门腺癌细胞为研究对象,使得蛋白表达谱涵盖的信息更为全面,更具有代表性。实验中共鉴定出了72个蛋白质,为研究贲门腺癌的发病机制提供了重要的参考信息,也为贲门腺癌的基因组、转录组和蛋白质组的数据对接奠定了基础。
根据ExPASy数据库中蛋白质的相关定位信息,本研究已鉴定的72个贲门腺癌蛋白质绝大部分为胞质蛋白(31.9%)和线粒体蛋白(12.5%),而亚细胞器蛋白如细胞核蛋白(8.3%)、内质网蛋白(4.2%)、核 糖 体 蛋 白 (1.4%)、高 尔 基 体 蛋 白(2.8%)和溶酶体蛋白(1.4%)的比例相对较低,这可能与本实验采用的是一步法抽提细胞总蛋白质有关,因此,若要进一步研究亚细胞器中的蛋白质可采用亚细胞抽提的方法,首先进行细胞器的纯化。膜蛋白质也只占整个鉴定蛋白质的8.3%,这可能是由于膜蛋白疏水性强、难溶于裂解液,因此,要提高膜蛋白质在2-DE凝胶上的丰度,必须提高蛋白质裂解液的溶解能力。此外,在本实验已鉴定的蛋白质中存在个别分泌性蛋白现象,这对于显微切割而言是难以完全避免的。但本实验中并没有发现来源于血浆中的蛋白质,这进一步说明NLCM可有效解决组织中血液的异质性问题。
根据ExPASy数据库中蛋白质的相关功能信息,本研究鉴定到的蛋白质功能多样,表明参与贲门腺癌发生的分子机制的复杂性。其中最大一部分为参与细胞内基本物质代谢和能量产生的蛋白质(占25.0%),这些蛋白质参与三羧酸循环、糖酵解、ATP合成和电子传递等生物学过程。RNA转录和翻译蛋白质丰度也较高(约占6.9%)。细胞增殖、分化和凋亡蛋白质占11.1%,如膜联蛋白A4、A2等;信号转导通路蛋白占11.1%,如鸟嘌呤核苷酸结合蛋白、视黄醛脱氢酶等。还有一类重要的蛋白质分子是分子伴侣(约占6.9%),包括参与应激反应的热休克蛋白家族(HSPs)成员,如 HSP27、60、70,以及蛋白质二硫键异构酶A3(PDIA3)等蛋白质。此外,细胞骨架蛋白约占4.2%,它们参与细胞的形态维持和细胞的运动,包括肌动蛋白1,角蛋白8、角蛋白13等蛋白质。其他蛋白质的功能涉及细胞抗氧化、免疫应答以及蛋白结合等。
综上所述,本实验建立了NLCM分离的贲门腺癌细胞蛋白质的双向电泳参考图谱,并应用质谱技术鉴定了部分蛋白质点,获得了贲门腺癌部分相关蛋白质的表达特征,为进一步构建其蛋白质表达数据库提供了基础,并为开展贲门腺癌差异蛋白质组的研究提供了重要依据。
[1]Walther C,Zilling T,Perfekt R,et al.Strongly increasing incidence of adenocarcinoma of the esophagus and gastric cardia[J].Lakartidningen,2004,101(3):180-183.
[2]Wasinger VC,Cordwell SJ,Cerpa-pojak A,et al.Progress with gene product mapping of the mollicutes:mycoplasma genitalium[J].E-lectrophoresis,1995,16(3):1090-1094.
[3]陈主初,梁宋平.肿瘤蛋白质组学[M].长沙:湖南科技出版社,2002:1-7.
[4]Liu Y,Li Y,Tan BB,et al.Technique appraisement of comparative proteomics and screening of differentiation-related protein in gastric carcinoma[J].Hepatogastroenterology,2013,60(123):633-637.
[5]Decarlo K,Emley A,Dadzie OE,et al.Laser capture microdissection:methods and applications[J].Methods Mol Biol,2011,755:1-15.
[6]程妍,张军,张蓉,等.导向激光捕获显微切割技术在贲门腺癌差异蛋白质组学的应用研究[J].西安交通大学学报,2014,35(4):557-561.
[7]Yasuhiro K,Kazuyuki N.Proteomic analysis of cancer tissues:Shedding light on carcinogenesis and possible biomarkers[J].Proteomics,2006,6(2):5650-5661.
[8]Posadas EM,Simpkins F,Liotta LA,et al.Proteomic analysis for the early detection and rational treatment of cancer-realistic hope[J].Ann Oncol,2005,16(1):16-22.
[9]Wulfkuhle JD,Paweletz CP,Steeg PS,et al.Proteomic approaches to the diagnosis,treatment and monitoring of cancer[J].Adv Exp Med Biol,2003,32(3):59-68.
[10]Blackstock WP,Weir MP.Proteomics:quantitative and physical mapping of cellular proteins[J].Trends Biotechnol,1999,17(3):121-127.
[11]Zhang ZQ,Li XJ,Liu GT,et al.Identification of annexin a1 protein expression in human gastric adenocarcinoma using proteomics and tissue microarray[J].World J Gastroenterol,2013,19(43):7795-7803.
[12]Geun HH,Seung UL,Deok GK,et al.Proteome analysis of human stomach tissue:Separation of soluble proteins by two-dimensional polyacrylamide gel electrophoresis and identification by mass spectrometry[J].Electrophresis,2002,23(15):2513- 2524.
[13]Ferguson RE,Carroll HP,Harris A,et al.Housekeeping proteins:a preliminary study illustrating some limitations as useful references in protein expression studies[J].Proteomics,2005,5(2):566-571.

