大承气汤通过抑制炎症反应来改善大鼠炎症相关性胃肠动力障碍
刘艳红,张明鑫,关 波,张 超,马宏炜,秦 明,王景杰(第四军医大学唐都医院消化内科,西安 710038;通讯作者,E-mail:jingjie@fmmu.edu.cn)
大承气汤是张仲景《伤寒论》中的经典方剂,其主证可归纳为“痞、满、燥、实”,组成包含大黄、枳实、厚朴、芒硝四味中药,其中大黄在该方剂中发挥主要作用;大承气汤具有“通便泻热”的作用,其中“通便”与现代医学的促胃肠动力为异曲同工,而“泄热”则暗示其具有明显的抗炎作用[1]。然而,大承气汤能否成为治疗炎症相关性胃肠动力障碍的理想药物尚有待深入研究。本研究在成功建立腹腔炎症大鼠模型的基础上,通过应用前期研究所得到最佳给药量的大承气汤[2],观察不同的时间段大承气汤的促胃肠动力作用效果及其抗炎作用,为临床应用提供可靠的理论依据。应用统计方法,探讨了大承气汤干预下胃肠动力与炎症因素的相关性,进一步探讨大承气汤促进胃肠动力及其抗炎作用的机制。
1 材料及方法
1.1 大承气汤的制备与给药
按照大黄12 g、厚朴15 g、枳实12 g、芒硝9 g组方进行药物煎制。煎制好的药物装瓶冷藏备用。
称取大黄36 g、厚朴 27 g、枳实 27 g、芒硝 13.5 g,加入8倍量水(即836 ml),浸泡30 min,加热煮沸1 h后,同样方法提取3次合并水煎液,纱布滤过,减压浓缩,最后制成含生药0.5 g/ml溶液,即得大承气汤。
给药量:最佳给药剂量(1 ml/kg)×体质量×5.7(g)。通过灌胃给药的方式,在不同天数的相同时间点给予大鼠进行灌胃[2]。
1.2 模型大鼠制备及分组
1 mg/kg LPS腹腔注射后4 h,大鼠出现稳定的腹直肌电频率及波幅增加,同时期胃电活动明显降低,验证胃肠道组织学变化,表明急性腹腔炎症模型制备成功,注射6 h后胃肠道出现明显动力低下。成功获得急性腹腔炎症模型。实验分组:正常对照组、模型组和干预组。其中模型组分为造模1 d组、造模3 d组、造模5 d组和造模7 d组。干预组又分为四个亚组,即干预1 d组、干预3 d组、干预5 d组和干预7 d组。每组大鼠均为5只。
1.3 主要实验仪器及试剂
3%戊巴比妥钠溶液(第四军医大学药理教研室);4%多聚甲醛磷酸盐缓冲液(武汉博士德公司);抗兔 Texasred(Sigma公司)、Triton X-100(Sigma公司)、PBS液、30%蔗糖溶液、0.9%氯化钠溶液;大鼠TGF-β/IL-10/TNF-α/IL-6酶联免疫分析试剂盒(R&D公司)。
1.4 胃电和小肠移行运动复合波(migrating motor complex,MMC)的测定方法
采用多道生理信号采集仪(RM6240,成都仪器厂)记录胃电和MMC,胃电活动参数:生物电,25 mV,直流,30 Hz,统计学分析胃电生理图频率和波幅进行;空肠 MMC 参数:频率100 Hz,时间常数0.01 s,高频滤波1 kHz,对所记录的MMC的周期、活动期/周期(%)和每分钟快波数进行统计学分析。
1.5 炎症因子表达变化的检测
为了检查大承气汤对炎症因子的变化,选取促炎症因子(TNF-α、IL-6)及抗炎症因子(TGF-β、IL-10)为研究对象,应用相关ELISA试剂盒检测上述因子的表达。各组在干预时间到达后,常规脱颈处死动物后,颈动脉采集血液。
将血液放置于室温10-20 min,然后放入离心机中,2 000-3 000 r/min,离心 20 min,收集的上清即为血清,可于-20℃保存。将收集的血清置于37℃温箱,温育30 min。洗涤、加酶、温育、洗涤、显色15 min后终止。以空白孔作为基准进行调零,采用450 nm波长测量样品的吸光度(OD值)。实验测定尽量在加终止液后15 min以内完成。
1.6 统计学分析
2 结果
2.1 大承气汤对胃动力的影响
在造模第1天,大鼠胃电的波幅和频率呈现一定程度的降低,但与正常组相比未见统计学差异(P>0.05);在造模的第3天胃电呈现显著降低,与造模的第1天相比存在统计学差异(P<0.05);造模的第5天,胃电的波幅和频率降到最低,与造模第3天相比差异显著(P<0.05);造模第7天,大鼠胃电的波幅与频率与第5天相比未见明显改善,二者相比无统计学差异(P>0.05)。干预组在实验的第1天,大鼠胃电与模型组相比未见有明显差异(P>0.05);干预组在实验的第3天,胃电的波幅和频率产生变化,与第1天及正常组第3天差异显著(P<0.05),但与模型组第3天相比,二者无显著性差异(P>0.05)。干预组在实验第5天,大鼠的胃电波幅和频率产生显著变化,与第3天相比差异显著(P<0.05),与正常组和模型组第5天相比,二者均有统计学差异(P<0.05);干预组第7天大鼠胃电的波幅和频率继续呈现逐渐上升,与正常组及模型组相比,未见统计学差异(P>0.05,见表1)。
表1 大承气汤对腹腔炎症大鼠胃电活动的影响(n=5,±s)Table 1 Effect of Dachengqi decoction on gastric electrical activity in rats(n=5,±s)

表1 大承气汤对腹腔炎症大鼠胃电活动的影响(n=5,±s)Table 1 Effect of Dachengqi decoction on gastric electrical activity in rats(n=5,±s)
与正常组比较,aP<0.05;与模型组比较,bP<0.05;与同组前一数据比较,cP<0.05
指标 组别0 d 1 d 3 d 5 d 7 d频率(次/min) 正常组 3.18 ±0.12 3.18 ±0.12 3.16 ±0.11 3.18 ±0.13 3.15 ±0.09模型组 3.17 ±0.12 3.04 ±0.11 2.20 ±0.10ac 1.51 ±0.08ac 1.47 ±0.07a干预组 3.18 ±0.11 3.02 ±0.11 2.31 ±0.12ac 2.91 ±0.10abc 3.15 ±0.11波幅(μV) 正常组 2 306±326 2 296±341 2 351±324 2 179±289 2 306±301模型组 2 104±253 1 983±278 1 357±262ac 969±249ac 937±251a干预组 3 011±312 2 296±303 1 479±297ac 1 879±310abc 2 246±289
2.2 大承气汤对小肠MMC的影响
正常大鼠小肠MMC呈现规律性的变化;在造模第1天,大鼠小肠MMC中周期、活动期/周期(%)及每分钟快波数有所改变,但与正常组相比,未见显著性差异(P>0.05)。造模第3天,大鼠MMC中的周期、活动期/周期(%)及每分钟快波数发生显著变化,与造模第1天 相比,存在显著性差异(P<0.05)。造模第5天,大鼠MMC中的周期、活动期/周期(%)及每分钟快波数较第3天依然有显著变化(P<0.05)。造模第7天与造模第5天相比无明显差异,但与正常组相比,存在显著性差异(P<0.05)。干预组第1天,大鼠MMC中的周期、活动期/周期(%)及每分钟快波数与模型组1 d相比,未见显著性差异(P>0.05)。干预组第3天,其相关指标与正常组存在显著性差异(P<0.05),但与干预组第5、7天的大鼠 MMC 中的周期、活动期/周期(%)及每分钟快波数未见显著性差异(P>0.05)。并且,在实验中我们观察到,造模组大鼠的小肠MMC呈现紊乱状态,在给予大承气汤干预后,在干预的第5天,模型大鼠小肠小肠MMC检测指标才处于逐渐恢复状态(见表2)。
表2 正常大鼠、腹膜炎症大鼠、大承气汤对炎症大鼠干预后小肠MMC的运动规律(n=5,±s)Table 2 Effect of Dachengqi decoction on MMC in rats(n=5,±s)
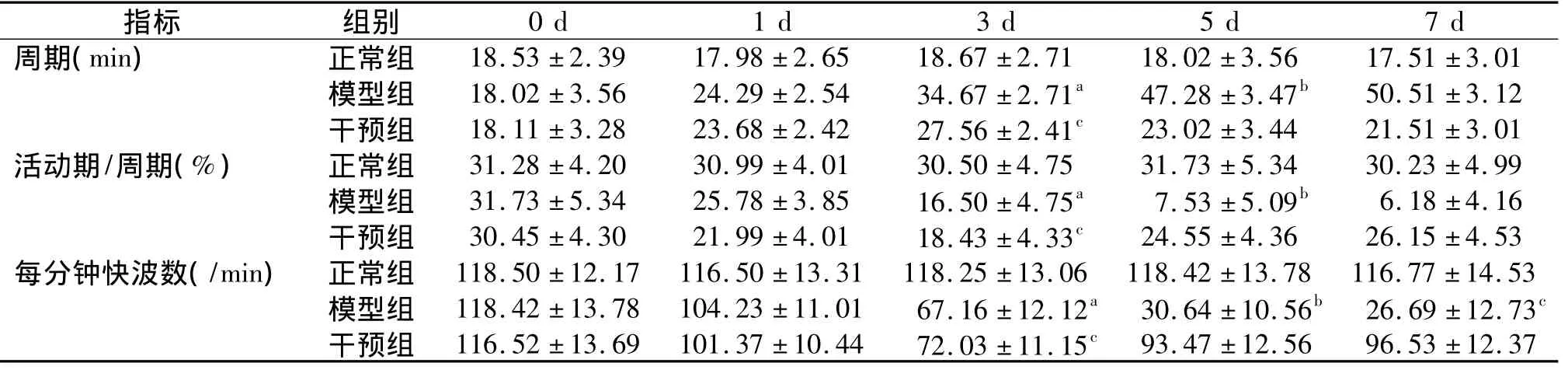
表2 正常大鼠、腹膜炎症大鼠、大承气汤对炎症大鼠干预后小肠MMC的运动规律(n=5,±s)Table 2 Effect of Dachengqi decoction on MMC in rats(n=5,±s)
与同组1 d比较,aP <0.05;与同组3 d比较,bP<0.05;与正常组比较,cP <0.05
指标 组别0 d 1 d 3 d 5 d 7 d周期(min) 正常组 18.53 ±2.39 17.98 ±2.65 18.67 ±2.71 18.02 ±3.56 17.51 ±3.01模型组 18.02 ±3.56 24.29 ±2.54 34.67 ±2.71a 47.28 ±3.47b 50.51 ±3.12干预组 18.11 ±3.28 23.68 ±2.42 27.56 ±2.41c 23.02 ±3.44 21.51 ±3.01活动期/周期(%) 正常组 31.28 ±4.20 30.99 ±4.01 30.50 ±4.75 31.73 ±5.34 30.23 ±4.99模型组 31.73 ±5.34 25.78 ±3.85 16.50 ±4.75a 7.53 ±5.09b 6.18 ±4.16干预组 30.45 ±4.30 21.99 ±4.01 18.43 ±4.33c 24.55 ±4.36 26.15 ±4.53每分钟快波数(/min) 正常组 118.50 ±12.17 116.50 ±13.31 118.25 ±13.06 118.42 ±13.78 116.77 ±14.53模型组 118.42 ±13.78 104.23 ±11.01 67.16 ±12.12a 30.64 ±10.56b 26.69 ±12.73c干预组 116.52 ±13.69 101.37 ±10.44 72.03 ±11.15c 93.47 ±12.56 96.53 ±12.37
2.3 大承气汤对炎症因子的影响
在造模第1天,大鼠促炎性因子(TNF-α、IL-6)呈现一定程度的升高,抗趋势炎症因子(TGF-β、IL-10)呈现一定程度的降低趋势,但与正常组相比未见显著性差异(P>0.05);在造模的第3天促炎性因子呈现显著升高,抗炎症因子呈现显著降低,与造模的第1天相比存在显著性差异(P<0.05);造模的第5天,促炎性因子持续升高,抗炎症因子持续降低,与造模第3天相比差异显著(P<0.01);造模第7天,促炎性因子持续升高,抗炎症因子持续降低,但与第5天相比无统计学差异(P>0.05)。干预组大鼠在实验的第1天,炎症因子与模型组相比未见有明显差异(P>0.05);干预组在实验的第3天,促炎性因子呈现一定程度的升高,抗炎症因子呈现一定程度的降低,但与第1天差异显著(P<0.05),与模型组第3天相比,二者呈显著性差异(P<0.05)。干预组在实验第5天,促炎性因子持续升高,抗炎症因子持续降低,与第3天相比差异显著(P<0.05);干预组第7天,炎症因子与模型组对比有显著差异(P<0.05),但与正常对照组相比,未见显著差异(P >0.05,见表3-6)。
表3 大承气汤对腹腔炎症大鼠TNF-α的影响 (n=5,±s)Table 3 Effect of Dachengqi decoction on TNF-α level in peritonitis rats(n=5,±s)

表3 大承气汤对腹腔炎症大鼠TNF-α的影响 (n=5,±s)Table 3 Effect of Dachengqi decoction on TNF-α level in peritonitis rats(n=5,±s)
与正常组比较,aP<0.05;与模型组比较,bP<0.05;与同组前一天数据比较,cP<0.05
组别0 d 1 d 3 d 5 d 7 d正常组 10.21 ±0.51 10.31 ±0.49 10.27 ±0.41 10.48 ±0.50 10.24 ±0.42模型组 10.21 ±0.51 11.08 ±0.45 60.48 ±3.24ac 75.38 ±4.23ac 76.48 ±5.11a干预组 10.18 ±0.48 12.45 ±0.55 24.22 ±0.79abc 18.37 ±1.28abc 13.48 ±1.39
表4 大承气汤对腹腔炎症大鼠IL-6的影响(n=5,±s)Table 4 Effect of Dachengqi decoction on IL-6 level in peritonitis rats(n=5,±s)

表4 大承气汤对腹腔炎症大鼠IL-6的影响(n=5,±s)Table 4 Effect of Dachengqi decoction on IL-6 level in peritonitis rats(n=5,±s)
与正常组比较,aP<0.05;与模型组比较,bP<0.05;与同组前一天数据比较,cP<0.05
组别0 d 1 d 3 d 5 d 7 d正常组 5.10 ±0.26 5.21 ±0.31 5.32 ±0.41 5.12 ±0.21 5.14 ±0.21模型组 5.12 ±0.25 5.54 ±0.27 30.75 ±1.53ac 38.08 ±2.01ac 41.02 ±2.22a干预组 5.11 ±0.24 6.05 ±0.35 13.41 ±0.69abc 9.19 ±0.51abc 5.94 ±0.22
表5 大承气汤对腹腔炎症大鼠TGF-β的影响(n=5,±s)Table 5 Effect of Dachengqi decoction on TGF-β level in peritonitis rats(n=5,±s)

表5 大承气汤对腹腔炎症大鼠TGF-β的影响(n=5,±s)Table 5 Effect of Dachengqi decoction on TGF-β level in peritonitis rats(n=5,±s)
与正常组比较,aP<0.05;与模型组比较,bP<0.05;与同组前一天数据比较,cP<0.05
组别0 d 1 d 3 d 5 d 7 d正常组 1.02 ±0.04 0.99 ±0.04 1.01 ±0.03 1.00 ±0.04 0.9 1.02 ±0.06 8 ±0.03模型组 1.01 ±0.03 0.93 ±0.03 0.31 ±0.01ac 0.20 ±0.01ac 0.15 ±0.01a干预组 1.03 ±0.05 0.90 ±0.04 0.44 ±0.02abc 0.61 ±0.04abc
表6 大承气汤对腹腔炎症大鼠IL-10的影响(n=5,±s)Table 6 Effect of Dachengqi decoction on IL-10 level in peritonitis rats(n=5,±s)

表6 大承气汤对腹腔炎症大鼠IL-10的影响(n=5,±s)Table 6 Effect of Dachengqi decoction on IL-10 level in peritonitis rats(n=5,±s)
与正常组比较,aP<0.05;与模型组比较,bP<0.05;与同组前一天数据比较,cP<0.05
组别0 d 1 d 3 d 5 d 7 d正常组 15.38 ±0.77 15.30 ±0.76 15.41 ±0.70 15.52 ±0.67 15.42 ±0.71模型组 15.37 ±0.54 14.04 ±0.65 5.15 ±0.26ac 3.25 ±0.16ac 2.05 ±0.11a干预组 15.39 ±0.67 14.17 ±0.74 8.58 ±0.51abc 11.48 ±0.64abc 15.04 ±0.77
2.4 炎症因子与胃电活动的相关性分析
无论是模型组还是干预组,胃电频率均与促炎症因子(TNF-α、IL-6)呈负相关,与抗炎症因子(TGF-β、IL-10)呈正相关(P <0.05,见图1-4)。

图1 模型组胃电频率与促炎症因子的相关性分析Figure 1 Correlation between gastric electrical frequency and pro-inflammation factors in model rats
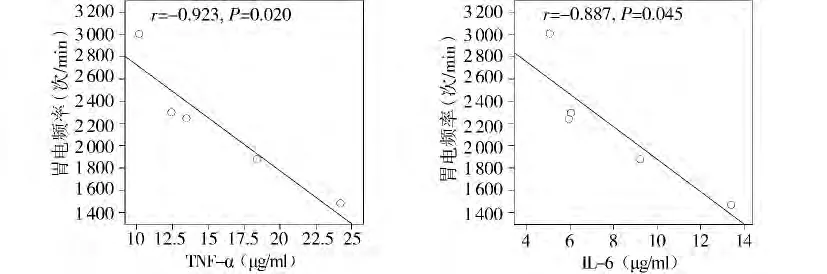
图2 干预组胃电频率与促炎症因子的相关性分析Figure 2 Correlation between gastric electrical frequency and pro-inflammation factors in rats treated with Dachengqi decoction
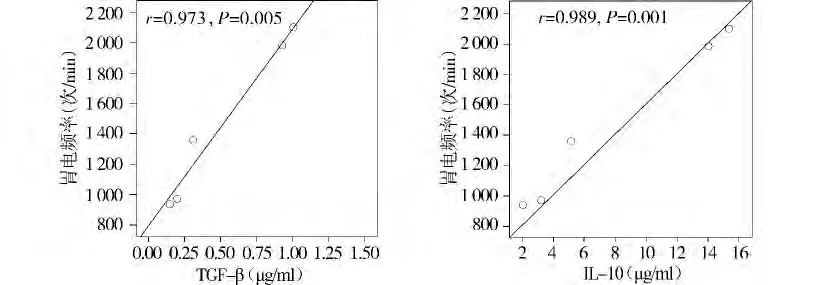
图3 模型组胃电频率与抗炎症因子的相关性分析Figure 3 Correlation between gastric electrical frequency and anti-inflammation factors in model rats

图4 干预组胃电频率与抗炎症因子的相关性分析Figure 4 Correlation between gastric electrical frequency and anti-inflammation factors in rats treated with Dachengqi decoction
3 讨论
大量证据表明,腹腔脏器感染常伴发明显的胃肠动力障碍。其不但影响患者的饮食状况,严重的可导致胃肠道组织的坏死性改变,极大地限制了患者病情的好转和康复[3]。因此,临床亟需开发一种既可以改善胃肠动力又可以消退炎症的药物。目前临床上主要是采用抗生素进行抗炎、采用吗丁啉或者西沙比利等促进胃肠动力,但是抗生素的应用主要针对有细菌性感染问题,然而抗生素在杀伤病原菌的同时导致大量菌体裂解,释放出的毒素会引起更为明显的胃肠动力障碍。
大承气汤方剂中君药为大黄,峻下热结,行气导发现大承气汤可以降低IL-6、TNF-α在外周血中的含量,从而抑制炎症反应。据此我们推断大承气汤可排空胃肠,促进胃肠功能恢复,并可抑制炎性因子释放,保护胃肠黏膜,减少脏器功能损害;其既具有促胃肠动力作用,又有抗炎作用,正是我们需要的具有双重作用的药物。
本研究显示,给予模型组大鼠一定剂量的药物进行干预,在不同的时段,模型大鼠的胃肠动力运动情况均明显改善,尤其是胃电活动的变化较为明显:随着干预时间的延长,模型大鼠的胃电活动不断增强。与此同时我们还观察到干预的模型大鼠血清中致炎因子的表达受到明显抑制,而抗炎因子的表达水平有所提升,二者存在明显的相关性,与以往研究结果相符[9]。但是,从小肠MMC的变化情况来看,上述炎症性指标的变化与干预组大鼠的MMC中的周期、活动期/周期(%)及每分钟快波数也存在明显的相关性,但是未呈现明显的线性关系,主要由于在大承气汤干预的情况下,到干预的第5天,小肠滞,可抑制胰酶活性、恢复胃肠功能、松弛胆道口括约肌;臣药为厚朴、枳实、芒硝,软坚泻下、消痞满、散腹胀、宽中理气等。根据上述中医理论,结合现代医学的方法,我们进一步借用大承气汤具有使“寒邪传阳明之腑,入里化热”而引起的症结进行“荡涤肠胃邪热积滞”,即大承气汤具有“通便邪热”的双重作用[4]。张栋梁等[5]研究发现承气汤通过增加大鼠小肠Cajal间质细胞(ICC)三磷酸肌醇受体表达增强细胞内钙库的动员,促进胃肠蠕动。另有研究表明,大承气汤可以修复大鼠小肠深部肌间ICC的形态学损伤[6],促进肠神经-ICC网络结构的恢复,进而改善大鼠胃肠动力障碍[7]。吴嘉骏等[8]研究MMC呈现稳定的状态,从小肠动力调节的角度来看,新近研究提示,小肠的动力起搏与胃的动力起搏可能是不同的起搏区域,另外,小肠的动力起搏虽然也源于ICC,但是胃的ICC生理状况和小肠的ICC的生理状况是存在差异的,故此,我们研究观察的指标的变化及胃肠动力改善的情况与此相吻合。再者我们所使用的动物数量和观察时间的不足,也可能是这一结果产生的原因。
综上所述,大承气汤促进胃肠动力的机制,在于其显著降低致炎因子的表达水平,提高抗炎因子的表达,促进胃电活动增强,综合改善胃肠运动功能障碍。
[1]任鸿义,任鹏,吴迪.浅析《伤寒论》大承气汤的证治[J].光明中医,2013,28(4):654-655.
[2]关波,秦明,张明鑫,等.大承气汤促胃肠动力的研究[J].山西医科大学学报,2014,45(6):453-455.
[3]Guo ZZ,Wang P,Yi ZH,et al.The crosstalk between gut inflammation and gastrointestinal disorders during acute pancreatitis[J].Curr Pharm Des,2014,20(7):1051-62.
[4]Wang J,Chen G,Gong H,et al.Amelioration of experimental acute pancreatitis with Dachengqi Decoction via regulation of necrosisapoptosis switch in the pancreatic acinar cell[J].PLoS One,2012,7(7):e40160.
[5]张栋梁,齐清会,李毅,等.大承气汤动物含药血清对Cajal间质细胞三磷酸肌醇受体表达的影响[J].世界华人消化杂志,2009,17(27);2825-2829.
[6]李毅,齐清会.大承气汤对MODS大鼠小肠深部肌间Cajal间质细胞损伤的作用[J].中国中西医结合外科杂志,2008,14(3):230-234.
[7]梁国刚,谢明征,曹万龙,等.阳明腑实证大鼠小肠神经-ICC网络形态学损伤和下法施治研究[J].大连医科大学学报,2013,35(6):520-525.
[8]吴嘉骏,赵冰,苏文利,等.大承气汤对脓毒症大鼠肝脏Toll样受体4表达的影响[J].中国中西医结合急救杂志,2010,17(5):285-287.
[9]Akiho H,Ihara E,Motomura Y,et al.Cytokine-induced alterations of gastrointestinal motility in gastrointestinal disorders[J].World J Gastrointest Pathophysiol,2011,2(5):72-81.

