乙肝肝硬化患者血小板活化、聚集与血浆色素上皮衍生因子关系
武 康,张卓伟,朱丽静,梁佳佳,武希润(山西医科大学影像系,太原 03000;山西医科大学第二临床医学院消化内科;通讯作者,E-mail:xirunwu66@6.com)
肝硬化病人大多存在出血倾向,以往研究认为,其主要与肝脏合成凝血因子减少、脾功能亢进、免疫异常导致血小板减少有关。色素上皮衍生因子(pigment pithelium-derived factor,PEDF)是 1989 年Tombran-Tink等从胎儿视网膜色素上皮细胞的体外培养液中分离纯化的一种可溶性糖蛋白,属于丝氨酸蛋白酶抑制剂超家族,是一种内生性多功能因子,有研究表明,PEDF通过氧化应激可抑制血小板P选择素的表达和血小板的聚集,但PEDF在乙肝肝硬化患者血液中变化及其与肝硬化血小板活化、聚集是否存在相关关系,目前国内外尚未见相关文献报道。本实验检测乙肝肝硬化患者血中PEDF变化,分析其与肝硬化血小板活化、聚集相关关系。
1 材料与方法
1.1 研究对象
收集2012-11~2013-01乙肝肝硬化患者37例,所有入选病例均根据病史、临床表现、实验室检查、胃镜和腹部彩超或CT检查确诊,其中山西医科大学第一临床医学院6例,山西医科大学第二临床医学院18例,山西省人民医院13例。其中男28例,女9例,年龄34-81岁,平均(54±10)岁,按照肝硬化Child-Pugh分级标准,将37例患者分为3组,Child-Pugh A级15例,B级12例,C级10例。正常健康体检10例作为对照组,男7例,女3例,年龄28-57岁,平均(47±9)岁。
1.2 主要试剂仪器
ADP诱导剂、CD61-FITC、CD62P-PE、CD63-PE、IgG-PE购自法国Immunotech公司;链霉亲和素-HRP、生物素标记的抗PEDF抗体购自生工生物工程(上海)股份有限公司。Allegra X-12离心机、FACSC流式细胞仪、LH750型血小板聚集仪购自美国贝克曼库尔特有限公司;多功能酶标仪购自郑州安图生物科技有限公司。
1.3 检测指标及方法
CD62P、CD63的测定:晨起空腹肘中静脉采血2.7 ml,加入含3.2%枸橼酸钠抗凝剂的真空采血管中,轻轻混匀,2 000 r/min离心5 min制备富血小板血浆(PRP)。取3支离心管,分别加入CD61-FITC IgG1-PE(同型对照)、CD61-FITC CD62P-PE、CD61-FITC CD63-PE 各 5 μl,各加入 PRP 10 μl,室温避光孵育20 min;加入适量PBS缓冲液,轻轻摇匀,2 000 r/min离心5 min,弃上清,加入1%多聚甲醛200 μl,轻轻摇匀,24 h内流式细胞仪检测。将前向散射(FSC)和侧向散射(SSC)的检测信号均设置为对数放大,并初步圈出血小板群;利用流式细胞术设逻辑门,以CD61-FITC和SSC双参数散点图设门,再圈出CD61阳性表达的血小板群,门内采集>10 000个血小板,分析CD62P、CD63阳性的百分率。
血小板聚集率(platelet aggregation rate,PAgT)测定:晨起空腹肘中静脉采血2.7 ml,加入含3.2%的枸橼酸钠抗凝剂的真空采血管中,800 r/min离心5 min,取上清 200 μl,加入 ADP 诱导剂(5 μmol/L)10 μl,2 h 内血小板聚集仪测 PAgT。
PEDF测定:晨起抽取空腹肘中静脉血5 ml,加入含抗凝剂的真空采血管中,3 000 r/min离心10 min,取上清置于Eppendorf管中,多功能酶标仪检测PEDF浓度。
1.4 统计学方法
2 结果
2.1 乙肝肝硬化患者CD62P、CD63的变化
乙肝肝硬化患者血小板CD62P阳性表达较正常对照组明显增加,差异有统计学意义(P<0.05);乙肝肝硬化B级、C级患者血小板CD63的表达较正常对照组有所增加,差异无统计学意义(P<0.05,见表1)。
表1 乙肝肝硬化患者CD62P、CD63的变化(±s)Table 1 Plasma levels of CD62P,CD63 in patients with hepatitis B cirrhosis(±s)
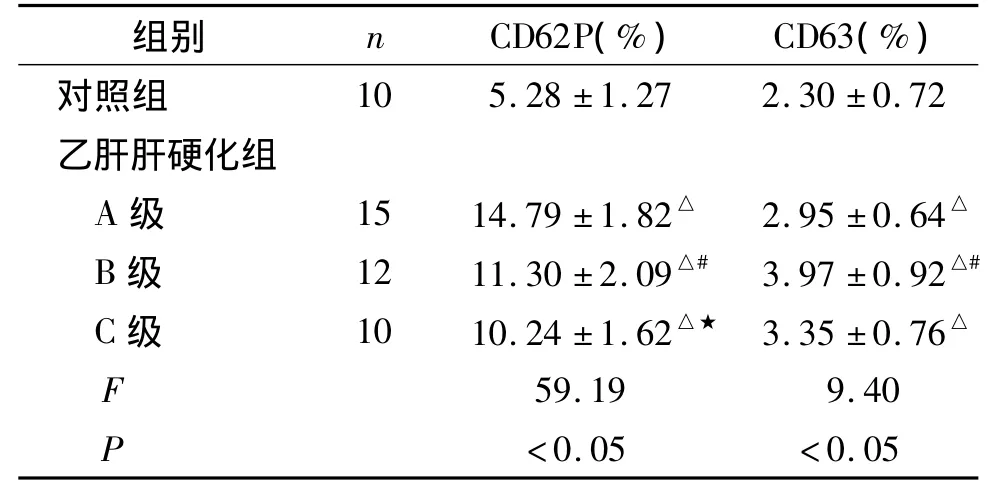
表1 乙肝肝硬化患者CD62P、CD63的变化(±s)Table 1 Plasma levels of CD62P,CD63 in patients with hepatitis B cirrhosis(±s)
与对照组比较,△P<0.05;与A级比较,#P<0.05;与B级比较,★P <0.05
组别 n CD62P(%) CD63(%)对照组10 5.28 ±1.27 2.30 ±0.72乙肝肝硬化组A 级 15 14.79 ±1.82△ 2.95 ±0.64△B 级 12 11.30 ±2.09△# 3.97 ±0.92△#C 级 10 10.24 ±1.62△★ 3.35 ±0.76△F 59.19 9.40 P <0.05 <0.05
2.2 乙肝肝硬化患者PAgT、PEDF的变化
乙肝肝硬化患者PAgT、PEDF明显低于对照组,差异有统计学意义(见表2)。
表2 乙肝肝硬化患者PAgT、PEDF的变化(±s)Table 2 Plasma levels of PAgT and PEDF in patients with hepatitis B cirrhosis(±s)
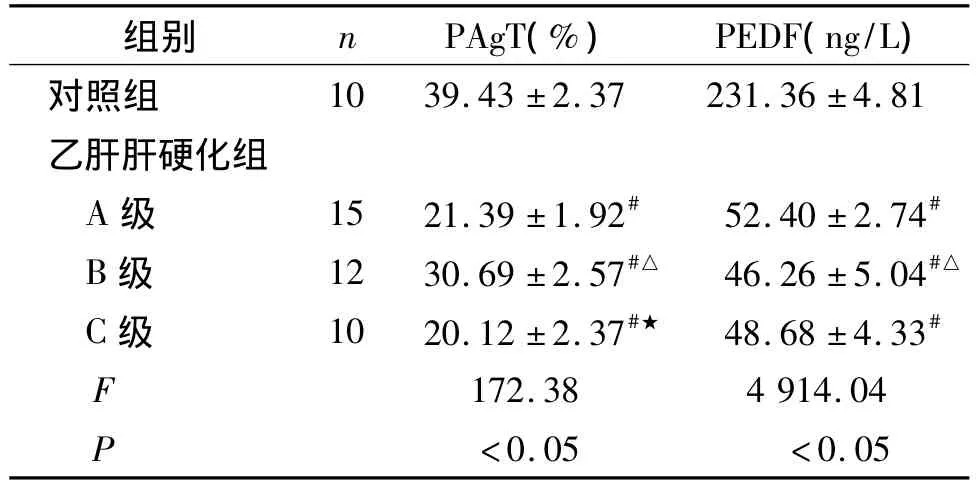
表2 乙肝肝硬化患者PAgT、PEDF的变化(±s)Table 2 Plasma levels of PAgT and PEDF in patients with hepatitis B cirrhosis(±s)
与对照组比较,#P<0.001;与 A 级比较,△P <0.05;与B 级比较,★P <0.05
组别 n PAgT(%) PEDF(ng/L)对照组10 39.43 ±2.37 231.36 ±4.81乙肝肝硬化组A 级 15 21.39 ±1.92# 52.40 ±2.74#B 级 12 30.69 ±2.57#△ 46.26 ±5.04#△C 级 10 20.12 ±2.37#★ 48.68 ±4.33#F 172.38 4 914.04 P <0.05 <0.05
2.3 相关性分析
乙肝肝硬化患者血液中PEDF的表达与CD62P呈负相关(r=-0.755,P <0.05),与 PAgT 呈正相关(r=0.791,P <0.05)。
3 讨论
肝硬化患者大多存在出血倾向,以往研究多集中在肝硬化脾大、脾功能亢进导致血小板数量改变,也有研究表明乙肝病毒复制影响骨髓巨核细胞增殖、活化[1],而对乙肝肝硬化血小板聚集与活化功能变化的研究较少。
血小板膜上含有a-颗粒、致密颗粒及溶酶体,这些颗粒膜蛋白在静止期不表达或少量表达。当血小板活化时,a颗粒立即与血小板质膜发生融合释放CD62P,且CD62P只在活化的血小板表面表达,不被血浆蛋白所掩盖,不随时间的推移而在活化血小板表面消失。因此,CD62P在血小板质膜上的表达或其阳性血小板的百分率的增加被认为是活化血小板的特异性标志。CD63又称溶酶体颗粒膜糖蛋白,血小板溶酶体在较强刺激剂诱导下缓慢与血小板质膜融合,释放内容物,在血小板表面表达溶酶体颗粒膜糖蛋白,因此,CD63也是血小板活化的特异性指标,血小板质膜上检测到CD63被认为是血小板已被较高程度活化。
童照威等[2]对32例乙型肝炎后硬化患者研究发现,肝硬化患者血小板表面CD62P、CD63增高不仅与血小板过度破坏有关,还与体内血小板活化程度有关。我们的实验结果表明,乙肝肝硬化患者血中CD62P、CD63阳性百分率与对照组比较均明显增加,差异有统计学意义,提示乙肝肝硬化患者存在血小板活化异常。
血小板聚集是血小板膜糖蛋白(GPⅡb/Ⅲa)通过纤维蛋白原(Fg)与另一血小板膜GPⅡb/Ⅲa结合的聚合能力,显示活化的血小板相互作用聚集成团的特征,是血小板的一种重要止血功能。龚文胜等[3]对121例门脉性肝硬化患者及52例对照组进行PAgT检测,结果发现肝硬化组血小板功能明显下降,表明乙肝肝硬化除存在血小板数量的减少外,常有血小板功能的减退。本实验检测乙肝肝硬化患者血小板聚集率明显降低,与对照组相比,差异具有统计学意义,表明乙肝肝硬化患者存在血小板聚集功能降低。
PEDF是一种具有多种生理作用的保护因子,广泛分布在人体的脑、眼、胎盘、睾丸、卵巢、前列腺等组织中,抗氧化应激是PEDF众多生理作用的枢纽[4,5],PEDF 可通过其抗氧化应激性抑制 NADPH活化,减少ROS生成,抑制血小板P选择素的表达和血小板的聚集,起到抗血小板聚集及血栓形成[6-8]。肝硬化患者存在血小板数量及功能的异常,但是否存在肝硬化患者血中PEDF变化与血小板活化、聚集相关关系目前尚无相关文献报道。我们采用酶联免疫吸附法检测37例乙肝肝硬化患者血清中PEDF变化,结果血中PEDF浓度较正常对照组明显减少,提示乙肝肝硬化中存在保护性因子PEDF减少。分析乙肝肝硬化患者血液中PEDF表达与CD62P、PAgT相关关系,结果表明,PEDF的表达与CD62P呈负相关,与PAgT呈正相关,表明乙肝肝硬化患者血清PEDF变化影响其血小板活化和聚集,推测乙肝肝硬化患者血清PEDF降低,血小板活化和聚集功能异常可能也是肝硬化出血风险增大的原因之一。
[1]王慧纬,武希润,梁佳佳,等.乙肝肝硬化患者血清对体外培养巨核细胞增殖分化的影响[J].中华肝脏病杂志,2013,21(2):143-145.
[2]童照威,周建方.肝硬化患者血小板膜蛋白CD62P,CD63表达变化及意义[J].肝脏,2001,6(4):251-252.
[3]龚文胜,叶素丹,陈宁.121例肝硬化患者血小板聚集功能观察[J].现代医院,2005,5(3):21-22.
[4]Bolukbas C,Bolukbas FF,Horoz M,et al.Increased oxidative stress associated with the severity of the liver disease in various forms of hepatitis B virus infection[J].BMC Infect Dis,2005,5(1):95.
[5]Cederbaum AI,Lu Y,Wu D.Role of oxidative stress in alcohol-induced liver injury[J].Archiv Toxicol,2009,83(6):519-548.
[6]Zheng Z,Chen H,Zhao H,et al.Inhibition of JAK2/STAT3-mediated VEGF upregulation under high glucose conditions by PEDF through a mitochondrial ROS pathway in vitro[J].Invest Ophthalmol Vis Sci,2010,51(1):64-71.
[7]Sanchez A,Tripathy D,Yin X,et al.Pigment epithelium-derived factor(PEDF)protects cortical neurons in vitro from oxidant injury by activation of extracellular signal-regulated kinase(ERK)1/2 and induction of Bcl-2[J].Neurosci Res,2012,72(1):1-8.
[8]Takenaka K,Yamagishi S,Matsui T,et al.Pigment epithelium-derived factor(PEDF)administration inhibits occlusive thrombus formation in rats:a possible participation of reduced intraplatelet PEDF in thrombosis of acute coronary syndromes[J].Atherosclerosis,2008,197(1):25-33.

