Bmi-1、NANOG、EZH2在结直肠癌中的表达及临床意义
通信作者:张国庆,男,主任医师,学士,教授,研究方向: 肿瘤外科的基础与临床研究, E-mail:zgqprofessor@sina.com 。
Bmi-1、NANOG、EZH2在结直肠癌中的表达及临床意义
邵国安1, 张国庆2, 蒲红伟3, 徐永耀+ 1, 王海超+ 1, 李仕亮1
(新疆医科大学1第五附属医院肿瘤治疗中心, 乌鲁木齐830011,2附属肿瘤医院, 乌鲁木齐830011,
3第一附属医院研究生科, 乌鲁木齐830054)
摘要:目的探讨Bmi-1、NANOG和EZH2蛋白在结直肠癌病人癌组织、癌旁正常组织和淋巴结中的表达及其与肿瘤患者临床病理的关系。方法应用免疫组化法检测70例结直肠癌病人癌组织、癌旁正常组织和淋巴结中Bmi-1、NANOG和EZH2的表达情况,并分析其与临床病理的关系。结果Bmi-1、NANOG、EZH2蛋白均在肿瘤组织中高表达,70例结直癌患者中,Bmi-1在癌组织及癌旁组织中阳性表达率分别为81.4%(57/70)、10.0%(7/70),差异有统计学意义(χ2=71.957,P<0.05);NANOG在癌组织及癌旁组织中阳性表达率分别为68.6%(48/70)、 15.7%(11/70),差异有统计学意义(χ2=40.105,P<0.05);EZH2在癌组织及癌旁组织中阳性表达率分别为85.7%(60/70)、22.9%(16/70),差异有统计学意义(χ2=55.724,P<0.05);3种蛋白的表达均与结直肠癌的临床病理分期、淋巴结转移及术后生存期有关(P<0.05),而与患者性别、年龄及肿瘤大小无关(P>0.05);3种蛋白的表达两两之间无相关性。结论Bmi-1、NANOG与EZH2蛋白对于结直肠癌的诊断及鉴别诊断有一定的意义;3种蛋白的表达对结直肠癌的术后复发、转移及其预后有指导意义。
关键词:结直肠癌; Bmi-1; NANOG; EZH2; 免疫组化
基金项目:新疆医科大学科研创新基金(XJC201199)
作者简介:邵国安(1968-),男,主任医师,硕士,副教授,研究方向: 肿瘤外科的基础与临床研究。
中图分类号:R735.3+4
doi:10.3969/j.issn.1009-5551.2015.03.026
[收稿日期:2014-03-12]
Experimental study on expression of Bmi-1, NANOG and EZH2
in colorectal cancer and its clinical significance
SHAO Guoan1, ZHANG Guoqing2, PU Hongwei3, XU Yongyao1, WANG Haichao1, LI Shiliang1
(1DepartmentofTumorTreatmentCenter,TheFifthAffiliatedHospital,Urumqi830011,China;
2TheAffiliatedTumorHospitalUrumqi830011;3DepartmentofPostgraduate,TheFirstAffiliated
Hospital,XinjiangMedicaluniversity,Urumqi830054,China)
Abstract:ObjectiveTo evaluate expression of Bmi-1, NANOG and EZH2 in tumor tissue in colorectal cancer patients and its relationship with tumor metastasis and lymph gland. MethodsBy using immunohistochemical method, the expression of Bmi-1, NANOG and EZH2 in tumor tissue, the tissue adjacent to tumor and lymph gland was detected in 70 cases of colon and rectal cancer patients. ResultsBmi-1, NANOG and EZH2 protein were of high expression in the tumor tissue. The positive expression rate of Bmi-1 was 81.4% (57/70) in the tumor tissue and 10.0% (7/70) in the tissue adjacent to tumor in the 70 cases of patients with colorectal cancer. The difference was statistically significant (χ2=71.957, P<0.05). The positive expression rate of NANOG was 68.6% (48/70) in the tumor tissue and 15.7% (11/70) in the tissue adjacent to carcinoma tissues. The difference was statistically significant (χ2=40.105, P<0.05); The positive expression rate of EZH2 was 85.7% (60/70) in tumor tissue and 22.9% (16/70) in the tissue adjacent to carcinoma tissues. The difference was statistically significant (χ2=55.724, P<0.05). The expressions of Bmi-1, NANOG and EZH2 were closely related to the clinical stage colorectal metastasis and postoperative survival (P<0.05), but have nothing to do with the patients gender, age and tumor size (P>0.05). There is no correlation between three proteins. ConclusionThree protein of Bmi-1, NANOG EZH2 may be valuable for the diagnosis of carcinoma. The expression of the three proteins is of guiding significance to colorectal cancer recurrence, metastasis and prognosis.
Key words: colorectal cancer; Bmi-1; NANOG; EZH2; immunohistochemical
结直肠癌(colorectal cancer,CRC)是常见的严重危害人类健康的恶性肿瘤之一,在西方发达国家其发病率在所有恶性肿瘤中居第3位,但死亡率高居第2位[1],每年约有50万人因结直肠癌死亡[2]。在全球每年新发的恶性肿瘤中结直肠癌占9.7%[3],我国20世纪70年代结直肠癌的发病率为12/10万,最新的统计显示已经升到56/10万,升速约为4.2%,与2%的国际水平相比变化明显[4]。CRC是我国发病率升速较快的恶性肿瘤之一,目前结直肠癌在我国的恶性肿瘤中发病率已位于第5位。肿瘤干细胞是最近肿瘤研究领域的热点,大量研究发现肿瘤干细胞及其信号传导通路异常是肿瘤发病的重要原因[5]。目前有研究发现结直肠癌很可能是一种与干细胞相关的疾病[6],并且已经有研究在人类结直肠肿瘤组织中找到了肿瘤干细胞[7]。用单个指标筛选肿瘤干细胞可靠性较差,而使用多个指标联合检查的方法则可明显提高肿瘤干细胞的检出率,联合检测对分离鉴定结直肠癌肿瘤干细胞有重要指导意义,可能会成为结直肠癌肿瘤干细胞分离鉴定的方法,还有可能为结直肠癌的治疗及预后判断提供理论依据。本研究采用免疫组化方法检测对结直肠癌可能有重要影响的肿瘤干细胞标志物,以探讨Bmi-1、NANOG、EZH2蛋白在结直肠癌病人癌组织、癌旁正常组织和淋巴结中的表达及其与肿瘤患者临床病理的关系。
1材料与方法
1.1一般资料选择新疆医科大学第五附属医院肿瘤外科2003-2009年收治的结直肠肠癌患者70例,男、女性各35例。年龄31~85岁,平均62.3岁。所有病例均手术治疗并在我院病理科首次诊断为结直肠癌。癌旁组织病理检查均未见癌细胞。取上述病例的标本存档石蜡块,做3 μm厚的连续病理切片,室温保存待检测。
1.2试剂及方法
1.2.1试剂Bmi-1、NANOG与EZH2鼠抗人单克隆抗体、免疫组化染色试剂盒、PBS、DAB、显色剂等均购于中杉金桥生物技术公司。95%酒精Ⅰ、95%酒精Ⅱ、梯度酒精80%、无水乙醇、盐酸乙醇、苏木素、二甲苯Ⅰ、二甲苯Ⅱ、中性树胶、蒸馏水等试剂均由新疆医科大学第一附属医院临床医学研究中心提供。
1.2.2方法采用免疫组化技术检测Bmi-1、NANOG、EZH2蛋白的表达情况,参照免疫组化试剂盒说明书的步骤逐步进行,实验步骤:取石腊标本做3 μm厚连续切片。使用纯二甲苯中脱蜡10 min共2次,然后依次在浓度100%、95%、80%、70%的乙醇中各浸泡5 min,浸泡于蒸馏水中。按照一抗使用说明,用微波抗原修复,切片修复,将切片置于柠檬酸缓冲液的烧杯中,置于700 W微波炉中15 min,之后常温下冷却,用PBS漂洗5 min共3次。在室温下用3%H-2O-2滴于切片上孵育5~10 min消除内源性过氧化酶活性。背景非特异性的减少:滴加试剂A(使用血清工作液),10 min室温孵育。倒掉液体,冲洗。将3种标志物的一抗以1∶50倍稀释,工作液浓度4 μg/mL,滴于切片上,放于湿盒内调整温度为4℃,过夜。次日,用PBS液洗3次,共3 min。滴加二抗,常温下等待10~15 min。使用PBS液洗3 min共3次。常温孵育10~15 min。PBS液冲洗3 min共3次。用DAB显色剂显色(显微镜下控制显色时间3~10 min),自来水终止显色。复染使用苏木素约2 min之后蒸馏水冲洗5 min。使用梯度酒精脱水(浓度依次为50%、70%、80%、90%、100%,时间为:5 s每个梯度),置于60℃烤箱中干燥5 min。透明使用二甲苯,分2次共10 min。自然干燥后用中性树胶封片。电子显微镜下观察,电子计算机采集照片。阴性对照:用PBS代替一抗,实验步骤同上。
1.3结果判定由2名经验丰富的病理学专家独立作出判定并记录免疫组化结果。蛋白阳性反应为胞浆内染色,染色结果采用Thomas综合计分法计算,即随机选取5个视野计数阳性细胞占肿瘤细胞的平均数,阳性细胞<10%计0分,11%~25%计1分,26%~50%计2分,51%~75%计3分,76%~100%计4分。染色强度以多数阳性细胞呈现的染色特性计分,淡黄色计1分,棕黄色计2分,棕褐色计3分。将着色强度和阳性细胞数两者的计分相乘,取低表达和高表达的截断值:0分为阴性(-),1~4分为弱阳性 (+),5~8分为阳性(++),9~12分为强阳性(+++)。
1.4统计学分析应用SPSS 20.0统计学软件包对收集的数据进行数据分析,根据所整理的数据情况对计数资料进行χ2检验及相关性分析。P<0.05表示差异有统计学意义。
2结果
2.1Bmi-1、NANOG、EZH2在结直肠癌组织和癌旁正常组织中的表达70例结直癌患者中,Bmi-1在癌组织及癌旁组织中阳性表达率分别为81.4%(57/70)、10.0%(7/70),差异有统计学意义(χ2=71.957,P<0.05)(表1)。Bmi-1的阳性表达定位于细胞质胞浆中,呈现棕黄色颗粒(图1、2)。NANOG在癌组织及癌旁组织中阳性表达率分别为68.6%(48/70)、 15.7%(11/70),差异有统计学意义(χ2=40.105,P<0.05)(表1)。NANOG的阳性表达定位于细胞质胞浆中,呈现棕黄色颗粒(图3、4)。EZH2在癌组织及癌旁组织中阳性表达率分别为85.7%(60/70)、22.9%(16/70),差异有统计学意义(χ2=55.724,P<0.05)(表1)。EZH2的阳性表达定位于细胞质胞浆中,呈现棕黄色颗粒(图5、6)。
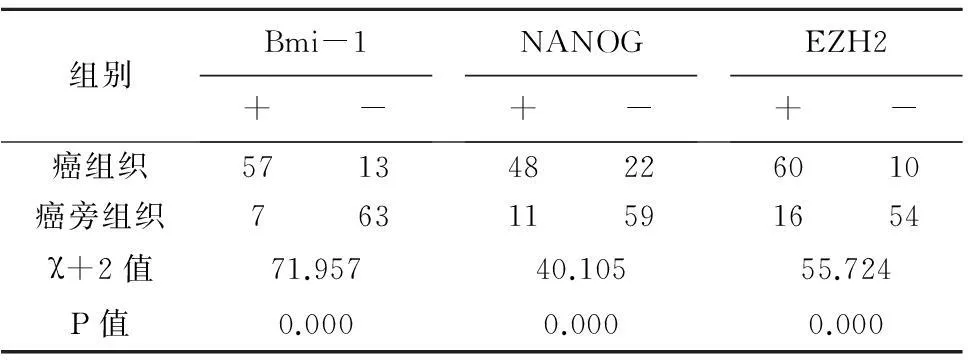
表1 Bmi-1、NANOG、EZH2在结直肠癌癌组织和

图1Bmi-1蛋白在结直肠癌癌组织的阳性表达(×200)

图2Bmi-1蛋白在结直肠癌癌组织的阳性表达(×400)
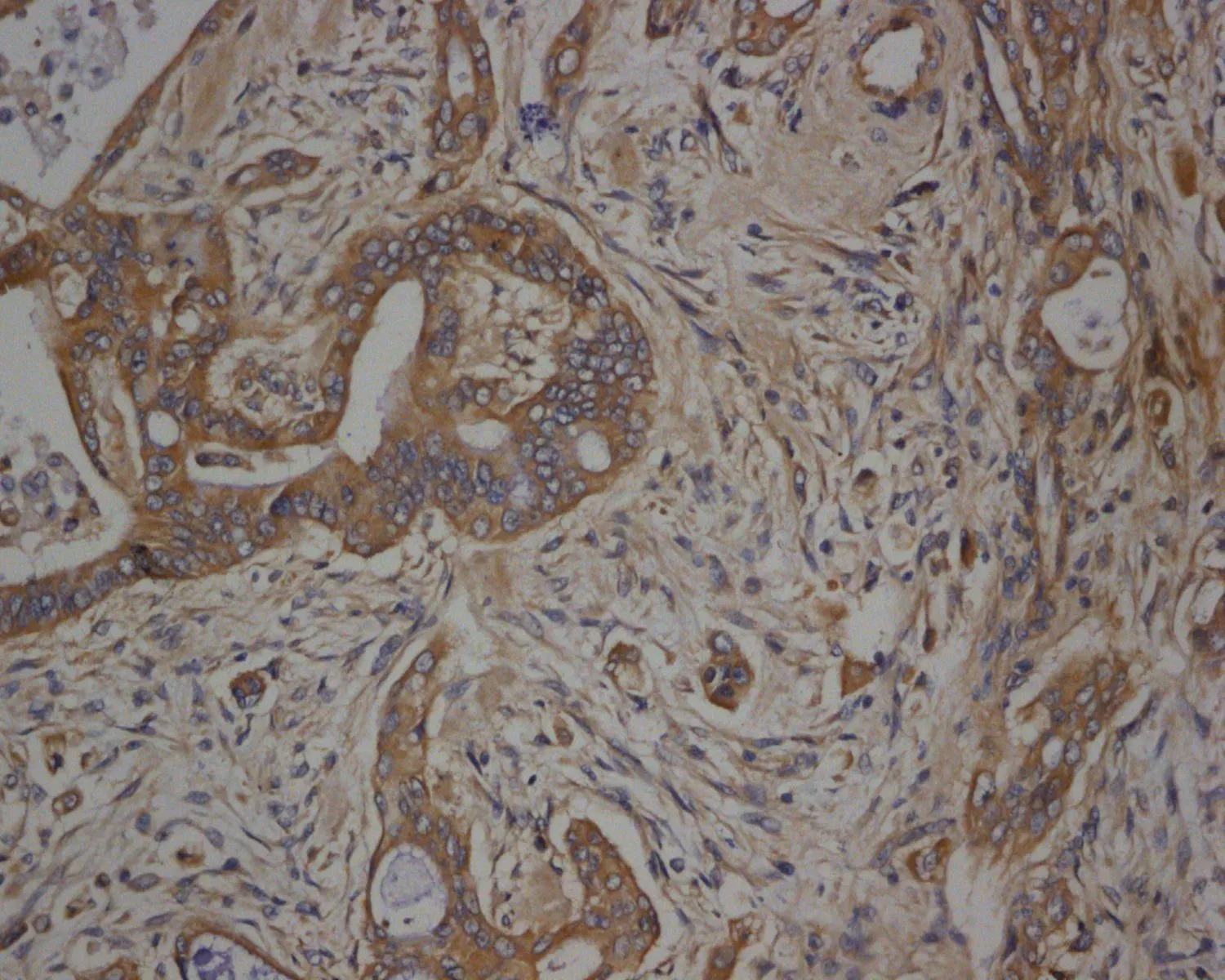
图3NANOG蛋白在结直肠癌癌组织的阳性表达(×200)
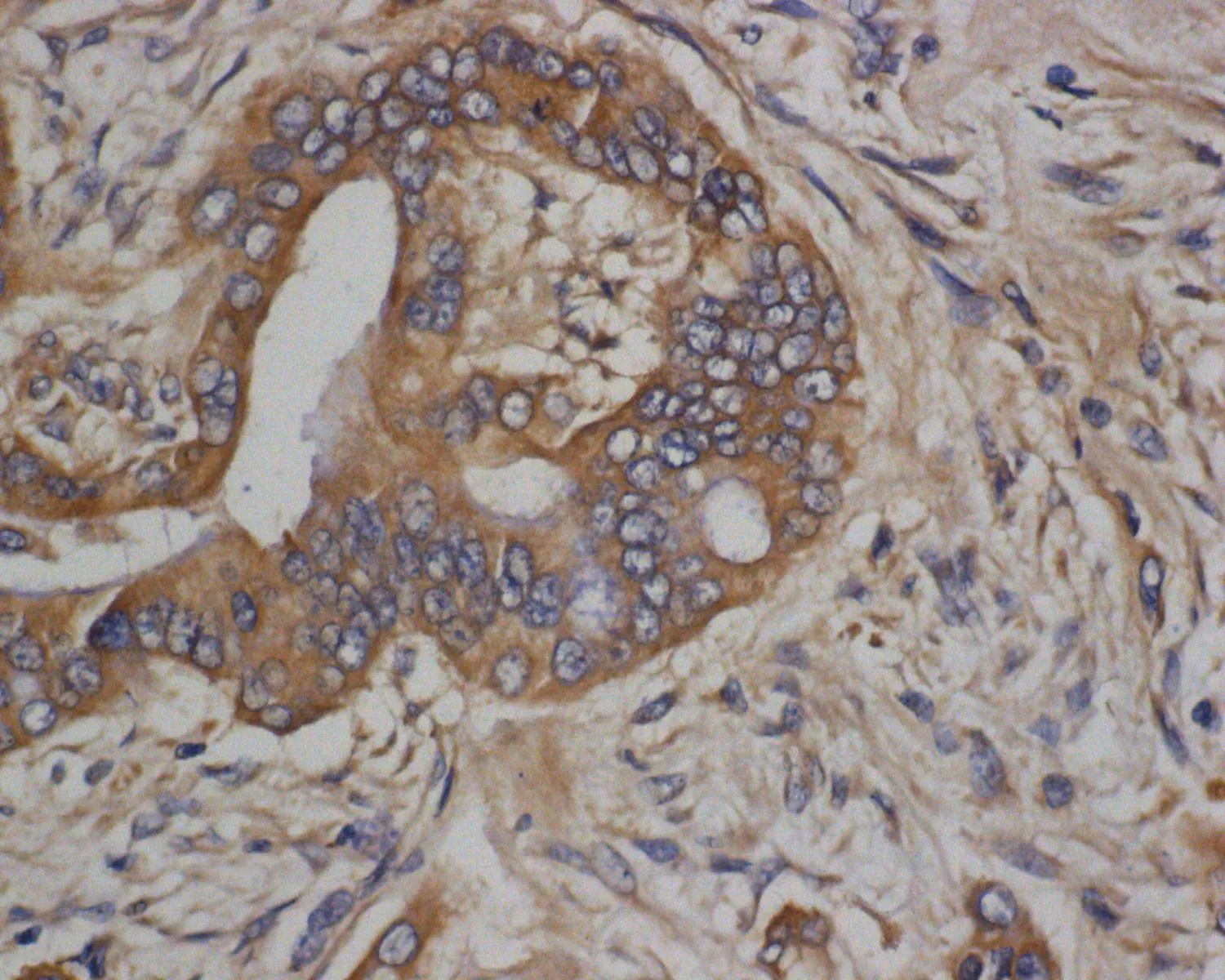
图4NANOG蛋白在结直肠癌癌组织的阳性表达(×400)

图5EZH2蛋白在结直肠癌癌组织的阳性表达(×200)

图6EZH2蛋白在结直肠癌癌组织的阳性表达(×400)
2.2Bmi-1、NANOG、EZH2与结直肠癌患者临床病理的关系Bmi-1在结直肠癌组织中的表达在性别分组、年龄分组、肿瘤直径分组中差异均无统计学意义(P>0.05);Bmi-1在结直癌组织中的表达在A-B期患者中阳性率为65.6% (21/32),在C-D期患者中阳性率为94.7% (36/38),差异有统计学意义(χ2=9.735,P<0.05);Bmi-1在转移的淋巴结中阳性率为94.3%(33/35),在无转移的淋巴结中阳性率为68.6%(24/35),差异有统计学意义(χ2=7.652,P<0.05);Bmi-1在结直肠癌组织中的阳性表达组3年生存率为31.6%(18/57),阴性组为69.2%(9/13),差异有统计学意义(χ2=6.334,P<0.05)(表2)。
NANOG在结直肠癌组织中的表达在性别分组、年龄分组、肿瘤直径分组中差异均无统计学意义(P>0.05);NANOG在结直肠癌组织中的表达在A-B期患者中阳性率为53.1%(17/32),在C-D期患者中阳性率为81.6%(31/38),差异有统计学意义(χ2=6.526,P<0.05);NANOG在转移的淋巴结中阳性率为85.7%(30/35),在无转移的淋巴结中阳性率为51.4%(18/35),差异有统计学意义(χ2=9.545,P<0.05);NANOG在结直肠癌组织中的阳性表达组3年生存率为25.0%(12/48),阴性组为68.2%(15/22),差异有统计学意义(χ2=11.872,P<0.05)(表2)。
EZH2在结直肠癌组织中的表达在性别分组、年龄分组、肿瘤直径分组中差异均无统计学意义(P>0.05);EZH2在结直肠癌组织中的表达在A-B期患者中阳性率为71.9%(23/32),在C-D期患者中阳性率为94.7%(36/38), 差异有统计学意义(χ2=6.855,P<0.05);EZH2在转移的淋巴结中阳性率为94.3%(33/35),在无转移的淋巴结中阳性率为74.3%(26/35),差异有统计学意义(χ2=5.285,P<0.05);EZH2在结直肠癌组织中的阳性表达组3年生存率为33.3%(20/60),阴性组为70.0%(7/10),差异有统计学意义(χ2=4.864,P<0.05)(表2)。
2.3Bmi-1、NANOG、EZH2蛋白在结直肠癌中表达的相关性用Spearman等级相关检验,对结直肠癌癌组织中Bmi-1、NANOG、EZH2蛋白的表达情况进行进行相关性分析,发现3种标志物两两之间无明显相关性(P>0.05)(表3)。

表2 Bmi-1、NANOG、EZH2在结直癌组织的表达与临床病理特征关系/例

表3 Bmi-1、NANOG、EZH2在结直肠癌中表达的相关性分析
3讨论
肿瘤干细胞是肿瘤细胞中具有与干细胞类似的有自我更新、增殖、分化等能力的细胞。近年来提出的肿瘤干细胞理论认为肿瘤组织中具有致瘤性的细胞只占一小部分,但正是这一小部分细胞导致并维持了肿瘤的生长和存在。从理论上讲只有将肿瘤干细胞完全杀死才有可能说在完全意义上治疗恶性肿瘤。因此学者们普遍认为肿瘤干细胞可能会在肿瘤的诊断和治疗中发挥积极的作用。研究有关筛选肿瘤干细胞可能的标志物及对这些标记物功能的研究,有十分重要的现实意义[8]。
荷兰癌症中心在研究鼠淋巴瘤时发现了Bmi-1基因(B-cell-specific moloney murine leukemia virus insertion site 1),其是转录抑制因子中的一个类型,为多梳基因家族中重要成员之一。Liu等[9]发现Bmi-l基因并不是由经典的hTERT(端粒酶逆转录酶)、INK4a-ARF基因和hox基因家族起作用,而是通过AKT基因在部分肿瘤中起作用。Bmi-1基因在胚胎发育、维持干细胞的功能中有着重要的作用,还与干细胞的增殖、分化及衰老关系密切,并在机体多种肿瘤形成过程中起重要作用。Wang等[10]研究了137例肝细胞癌肿瘤组织中Bmi-1的表达情况,结果表明Bmi-1的表达明显升高,同时还发现Bmi-1过表达的病例普遍预后较差。Tong等[11]在检测对宫颈癌病例血液中Bmi-1自身抗体时发现Bmi-1水平较正常对照组增高明显,认为血清中Bmi-1自身抗体水平有望成为一种筛选宫颈癌的理想标志物。陈玉辉等[12]发现Bmi-1蛋白对食管癌的浸润和淋巴转移显著相关,推测其可能对食管癌恶性转化有增进作用,并且使肿瘤的恶性程度增强。廖雯婷等[13]研究发现结肠癌的发生也与Bmi-1有密切相关,同时结肠癌组织Bmi-1 mRNA的表达明显高于癌旁组织,认为Bmi-1可以用作结直肠癌发生及转移预测指标。国内在结直肠癌方面的研究已经发现大肠癌组织Bmi-l蛋白的阳性表达率显著高于瘤旁及正常组织;在大肠癌中有淋巴结转移者Bmi-l mRNA及Bmi-l蛋白表达水平显著高于无转移者并且与癌组织浸润深度也与明显正相关。He等[14]认为Bmi-1基因有可能成为一种敏感的标志物来判断大肠癌的预后,其研究表明Bmi-1在结直肠癌组织中呈高表达而在结直肠癌的癌旁正常组织中为低表达或不表达,并且Bmi-1在结直肠癌组织中的表达在转移淋巴结、病理分期及术后生存期方面差异有统计学意义,而在性别、年龄分组、肿块直径大小方面差异无统计学意义。因此,推断Bmi-1与结直肠癌关系密切,可能与结直肠癌的发生发展及预后相关。建议在诊断结直肠癌使用标记物时要将Bmi-1包含在其内,如果Bmi-1和其他的2个或多个标记均强烈地表达,对于判定结直肠癌转移及预后有较大帮助。
同源盒蛋白NANOG是一种在胚胎干细胞系、囊胚内细胞群、原始生殖细胞表达较稳定的转录因子,在早期发育的胚胎中可以发现,例如人类胎儿卵巢、睾丸中的原始干细胞、胚胎生殖细胞、胚胎瘤细胞,对维持胚胎干细胞多向分化功能非常重要作用。Du等[15]发现NANOG基因存在于肿瘤细胞中,说明可能存在类似于干细胞的肿瘤细胞,所以推测NANOG基因与肿瘤的发生发展有很大关系。Li等[16]研究表明,NANOG在生殖细胞系来源的肿瘤及非小细胞肺癌的细胞中发现高表达。You等[17]对人成纤维细胞用反转录病毒将NANOG基因转染,发现虽然已经高度分化的细胞,但是经过NANOG的阳性表达的促进作用,这些细胞能够再一次进入S期。目前NANOG在结直肠癌中的研究较少。王海玲等[18]研究发现,NANOG的表达与结直肠癌组织分化、Duke分期和淋巴结转移方面差异有统计学意义,随着结肠癌恶性程度的提高、临床分期的进展及淋巴结转移,NANOG的阳性表达相应呈现递增趋势。总之,目前大量研究发现NANOG不仅可作为恶性肿瘤治疗的新靶点,而且有望成为临床用于预测恶性肿瘤患者预后的有效指标[19]。本研究结果显示NANOG在结直肠癌癌组织中高表达,并且NANOG的高表达与患者淋巴结转移存在相关性,影响患者的术后生存期,考虑NANOG的表达与结直肠癌关系密切,并与患者的预后有关联。
EZH2(enhancer of zeste homolog 2)是果蝇基因增强子的人类同源物,EZH2基因的作用:(1)对于同源基因的表达可以做到选择性限制;(2)通过特定基因和转录因子相互影响从而增强抑制靶基因,即EZH2参与转录抑制同时还具有调控作用。EZH2所在的PeG蛋白家族能够使许多分化相关因子发生沉默,并且调节干细胞衰老和干细胞的维持,而且在干细胞发育和更新方面也有重要作用,其会导致正常细胞生长发生失控,引起肿瘤和促进肿瘤血管的发生[20]。肿瘤转移基因分为肿瘤转移促进相关基因和肿瘤转移抑制相关基因,这2种基因相互平衡,但由于可以抑制肿瘤的演进、转变、发展的多数被抑制的基因打破了其平衡,使其偏向肿瘤转移促进相关基因。而EZH2蛋白的特性是具有促进肿瘤细胞侵袭转移能力,其是一种转录抑制因子,亦是一种转录阻遏蛋白,许多基因的活性都受到其抑制,尤其在肿瘤转移抑制基因上起的抑制作用最明显。自从发现具有染色质修饰作用蛋白EZH2以来,目前已有很多学者报道关于EZH2表达水平和多种类型肿瘤相关性,在宫颈癌、乳腺癌、肝癌、食管癌、胃癌、前列腺癌等恶性肿瘤均发现与EZH2表达水平有关,在这些肿瘤中,EZH2蛋白表达水平明显升高[21]。但对于EZH2基因在结直肠肿瘤的相关报道和研究相对较少。总之,目前众多研究都证实EZH2与实体肿瘤关系密切,EZH2有可能成为一种新的重要肿瘤标志物[22]。国外有研究指出研发EZH2的抑制剂可以通过抑制血管形成及肿瘤转移来实现抗肿瘤的效果,可能会为肿瘤治疗提供一种新的方法[23]。本研究发现EZH2在结直肠癌组织中的表达显著高于肿瘤旁正常组织,有淋巴结转移的患者EZH2的表达更高,而且高表达患者相对于低表达或不表达患者术后生存期明显缩短。EZH2在结直肠癌的表达与肿瘤的侵袭、转移和预后有重要关联,通过对EZH2的深入研究有可能为结直肠癌的诊断和治疗提供一个新的方法。
总之,Bmi-1、NANOG、EZH2与结直肠癌的发生、发展及预后关系密切,并且有可能参与肿瘤的转移的发生。3种蛋白有可能可作为结直肠癌诊断、监测治疗效果、指导临床用药及结直肠癌患者再发风险、转移、生存期等预后判断的检测指标,也可能成为结直肠癌治疗的靶目标。因而,结直肠癌相关的肿瘤标志物在结直肠癌诊治等方面具有较大的应用前景,有待于不断地进行深入研究。
参考文献:
[1]Jemal A,Siegel R,Xu J,et al.Cancer statistics 2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2]Jemal A,Siegel R,Ward E,et al.Cancer statistics 2009[J].CA Cancer,2009,59(4):225-249.
[3]Ferlay J,Shin HR,B ray F,et al.Estimates of worldwide burden of Caner in 2008[J].Int J Caneer,2010,127(12):2893-2917.
[4]卫文.不良生活习惯导致大肠癌高发[J].家庭医学,2012,2(8):32-33.
[5]Ramdass B, Duggal R, Minev B, et al. Functional role of solid tumor stem cells in disease etiology and susceptibility to therapeutic interventions[J]. J Stem Cells,2013,8(3-4):189-231.
[6]胡祥,程勇,王吉明,等.结肠癌细胞系SW480肿瘤干细胞相关亚群初步分离、鉴定[J].中国癌症杂志,2008,18(7):496-500.
[7]张秋菊,刘斌,邢传平.结直肠癌干细胞的研究与进展[J].中国组织工程研究与临床康复,2008,12(8):1529-1532.
[8]Wilson BJ, Schatton T, Frank MH, et al. Colorectal cancer stem cells:biology and therapeutic implications.[J] Curr Colorectal Cancer Rep,2011,7(2):128-135.
[9]Liu YL, Jiang SX, Yang YM, et al. usP22 acts as an oncogene by the activation of BMI-l-mediated INK4a/ARF pathway and Akt pathwAy[J].Cell Biochem Biophys, 2012,62(1):229-235.
[10]Wang H,Pan K,Zhang HK,et al.In creased polycomb-group oncogene Bmi-1 expression correlates with poor prognosis in hepatocellular carcinoma[J].Cancer Res Clin Oncol, 2008,134(5):535-541.
[11]Toog YQ,Liu B,Zheng HY,et al.Bmi-1 autoantibody as a new poten tial biomarker for cervical carcinoma[J].PloS One,201l,6(11):27804.
[12]陈玉辉,蒲红伟, 陈晓,等.RhoC、Bmi-1在食管鳞癌中浸润转移及其与预后的关系[J].新疆医科大学学报,2013,36(5):588-591.
[13]廖雯婷,崔艳梅,丁彦青.Bmi-1、PTEN及E-Cadherin在结直肠癌中的表达和意义[J].中国肿瘤临床,2013,39(3):559-561.
[14]He X,Dong Y,Wu CW,et al.MicroRNA-218 inhibits celI cycle proession and promotes apoptosis in colon cancer by downregulaling BMI-l polycomb ring finger oncogene[J]. Mol Med,2013,18(1):1491-1498.
[15]Du Y, Ma C, Wang Z, et al. Nanog, a novel prognostic marker for lung cancer[J]. Surg Oncol,2013,22(4):224-229.
[16]Li XQ,Yang XL,Zhang G,et al.Nuclear β-catenin accumulation is associated with increased expression of Nanog protein and predicts poor progonosis of non-small cell lung cancer[J].J Transl Med,2013,11(1):111-114.
[17]You JS,Kang JK,Soe DE,et al.Deletion of embryonic stem cell signature by histone deacety lase inhibitor in NCCIT cells:involvement of Nanog suppression[J].Cancer Res, 2009,6(9):5716- 5725.
[18]王海玲,杨丽敏,王进.Piwil2、Nanog在结肠癌中异常表达的临床意义[J].中华消化杂志,2011,39(3):627-629.
[19]韩敬华,张飞,武冰,等.Nanog+在多种癌组织中的表达及临床意义[J] .中国肿瘤临床,2012,39(1):10-13.
[20]Crea F,Fornaro L,Bocci G,et al.EZH2 inhibition:targeting the crossroad of tumor invasion and angiogenesis[J].Cancer Metastasis Rev,2012,31(3-4):753-761.
[21]白洁,帅晓明,陶凯雄.EZH2与肿瘤的关系[J].国际肿瘤学杂志,2012,39(3):182-186.
[22]王晓雪,王光明,丁跃明,等.EZH2与神经胶质瘤的现况研究[J].中华临床医师杂志,2013,7(24):11685-11687.
[23]Smits M,Nilsson J,Mir SE,et al.miR101 is down-regnlated in glioblastomaresulting in EZH2 induced proliferation migration,andangiogenesis[J].Oncotarget,2010,1(8):710-720.
(本文编辑杨晨晨)

