姐妹胚胎体外形成囊胚的时间、数量与D3胚胎移植结局关系的研究
尹太郎,丁锦丽,张怡,徐望明,龙文,杨菁
(武汉大学人民医院生殖医学中心,武汉 430060)
影响IVF-ET 临床结局的因素较多,胚胎质量是一个重要因素[1]。有研究表明,将鲜胚移植后剩余的所有胚胎行囊胚培养,IVF-ET 后妊娠患者的剩余胚胎更容易形成囊胚,同周期中姐妹胚胎体外形成囊胚的潜能可以预测D3 移植胚胎的临床结局[2-3]。但关于姐妹胚胎继续培养形成囊胚的速度与胚胎移植结局的关系鲜有报道。本研究回顾性分析本中心2013年1月至2014年5月卵裂期胚胎移植后剩余的姐妹胚胎继续囊胚培养的患者数据,研究姐妹胚胎体外形成囊胚的速度与D3胚胎移植后临床结局的相关性,探索其对移植胚胎的临床结局的预测作用。
资料与方法
一、研究对象
收集2013年1月至2014年5月在我院生殖医学中心于D3行优质新鲜胚胎移植、剩余姐妹胚胎继续培养并形成囊胚的363 例患者的资料,纳入134例鲜胚移植后剩余姐妹胚胎继续培养无囊胚形成的患者作为对照。女方年龄20~42岁,不孕年限1~15年。不孕原因包括:子宫内膜异位症、盆腔输卵管因素、排卵障碍;男方少、弱、畸精子症及不明原因不孕。
二、治疗方法回顾
1.促排卵及受精:采用我中心常规使用的方案促排卵,包括短方案、长方案及超长方案[4]。阴道B超发现3个以上直径≥18mm 的卵泡时,肌注5 000~10 000U HCG(雪兰诺,瑞士),36h后在阴道B 超下采卵。根据男方精子质量决定自然受精或卵胞浆内单精子注射授精。
2.胚胎移植:所有患者均根据其年龄、内膜准备情况等决定移植卵裂期胚胎数,移植2~3枚优质胚胎。在移植后肌注黄体酮行黄体支持,具体参考本中心用药方案[5]。
3.囊胚培养及冻存:将第3天移植后剩余的非优质胚胎置入Quinn’s囊胚培养液(SAGE,美国)继续囊胚培养。D5/D6评估形成囊胚的情况,将形成的囊胚冷冻。
4.胚胎质量评估:根胚胎形态学对D3胚胎进行评估,即评估时包含6个以上均匀一致的卵裂球且细胞碎片小于20%的胚胎定义为优质胚胎,其余为非优质胚胎[5]。按Gardner囊胚分级法[6]对D5/D6胚胎进行评分。
三、分析指标
本项研究收集了纳入研究的女性的年龄、不孕年限、体重指数(BMI)、移植优胚数、胚胎种植数、临床妊娠例数以及剩余胚胎囊胚培养情况等资料。
胚胎移植后14d检测血β-HCG>10U/L,2周后B 超下见孕囊确定为临床妊娠,孕28 周前妊娠丢失为早期流产。胚胎种植率定义为超声扫描可见孕囊数/移植胚胎数;临床妊娠率定义为临床妊娠例数/总周期数;流产率为流产例数/临床妊娠例数;多胎率为多胎例数/临床妊娠例数(本研究中均为双胎);囊胚形成率为D5或/和D6形成的囊胚数/行囊胚培养的姐妹胚胎数。
四、统计学分析
应用SPSS 19.0统计学软件进行分析。计量资料结果以均数±标准差表示,计数资料以率表示。定量资料比较采用t检验,定性资料的比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一、基本资料
共纳入497个周期的患者资料,按姐妹胚胎培养后是否有囊胚形成分组,再根据观察囊胚形成的时间分为D5组和D6组。若D5和/或D6有囊胚形成,则为囊胚形成组,反之为对照组;仅D5有囊胚形成为D5组,仅D6有囊胚形成为D6组,D5、D6均有囊胚形成为D5+D6组。本研究中囊胚形成组363例,其中D5组107例,D6组144例,D5+D6组112例。
囊胚形成组与对照组及D5、D6、D5+D6 三个亚组与对照组组间女方年龄、不孕年限、不孕类型均无统计学差异(P>0.05);囊胚形成组的优质胚胎数(5.00±2.78)显著高于对照组(4.25±2.67)(P<0.01),D5、D5+D6 两个亚组的优质胚胎数(分别为5.08±2.92,5.40±2.83)也显著高于对照组(4.25±2.67)(P<0.05),D5+D6组的优质胚胎数还显著高于D6组(P<0.05),而D5组的优质胚胎数(5.08±2.92)虽高于D6组(4.64±2.59),但差异无统计学意义(P>0.05)(表1)。
二、姐妹胚胎形成囊胚的情况与D3 胚胎移植结局的关系
囊胚形成组与对照组及D5、D6、D5+D6 三个亚组与对照组组间移植的胚胎数无统计学差异(P>0.05)。囊胚形成组与对照组的种植率(31.34% vs.19.41%)及 临 床 妊 娠 率(50.14%vs.32.84%)均有统计学差异(P<0.01);D5、D6及D5+D6 三 个 亚 组 种 植 率(分 别 为34.42%、29.01%、31.42%)及临床妊娠率(分别为53.27%、47.92%、50.00%)均 显 著 高 于 对 照 组(分 别 为19.41%、32.84%)(P<0.01和P<0.05);囊胚形成组与对照组及D5、D6、D5+D6三个亚组与对照组的组间流产率均无统计学差异(P>0.05)(表2)。
三、姐妹胚胎囊胚形成个数与D3 胚胎移植结局的相关性
在363个有囊胚形成的周期中,形成囊胚的个数为1~10个。
线性回归分析结果显示,在形成0~7个囊胚的周期患者中,形成囊胚的个数与鲜胚种植率及临床妊娠率呈显著正相关(r=0.749,P <0.05;r=0.752,P<0.05)(表3)。
形成8个囊胚者有2例,9个囊胚者1例,10个囊胚者1 例。该4 个周期共植入胚胎8 枚,着床3枚(种植率37.50%),临床妊娠3例(临床妊娠率75.00%)。由于例数较少,故未列入相关性分析。
四、非优质胚胎数≥5的周期姐妹胚胎形成囊胚的情况与移植结局的关系
由于患者继续囊胚培养的非优质胚胎数量存在差别,少者仅有1个,多者有20个,为了避免继续囊胚培养的非优质胚胎基数不同为研究结果带来的干扰,我们进一步选择至少有5个非优质胚胎行继续培养的共382例患者作为研究对象,按照囊胚形成率进行分组:囊胚形成率≥40%为A 组,囊胚形成率20%~40%为B组,囊胚形成率<20%为C组。
表1 患者基本资料[(±s),n(%)]
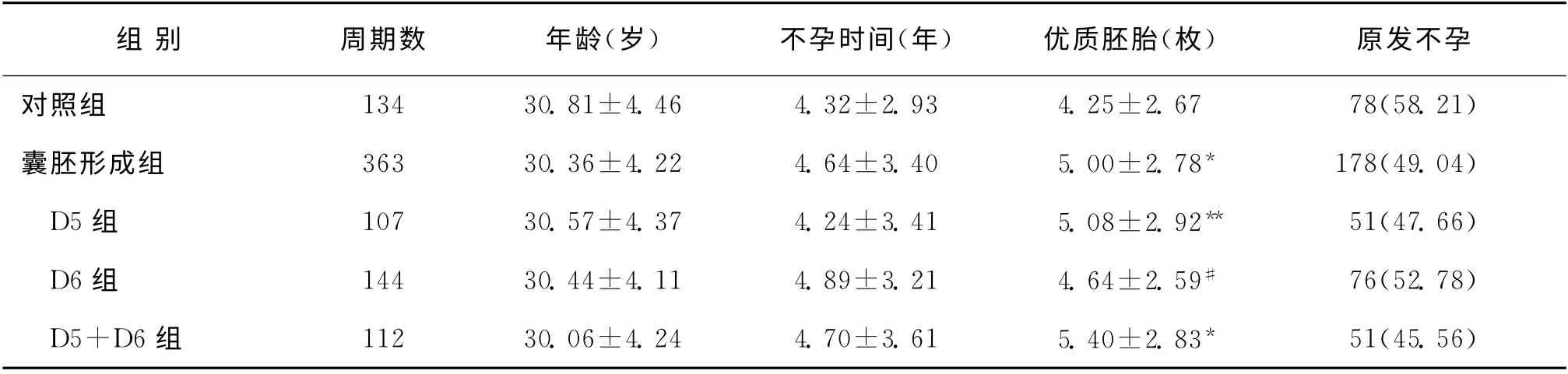
表1 患者基本资料[(±s),n(%)]
注:与对照组比较,*P<0.01,**P<0.05;与D5+D6组比较,#P<0.05
组 别 周期数 年龄(岁) 不孕时间(年) 优质胚胎(枚)原发不孕对照组 134 30.81±4.46 4.32±2.93 4.25±2.67 78(58.21)囊胚形成组 363 30.36±4.22 4.64±3.40 5.00±2.78* 178(49.04) D5组 107 30.57±4.37 4.24±3.41 5.08±2.92** 51(47.66) D6组 144 30.44±4.11 4.89±3.21 4.64±2.59# 76(52.78) D5+D6组 112 30.06±4.24 4.70±3.61 5.40±2.83* 51(45.56)
A、B及C 组组间女方年龄及移植胚胎数均无统计学差异(P>0.05)。A 组的种植率及临床妊娠率均显著高于B 组和C 组(P<0.05);B 组的种植率及临床妊娠率较C 组有增高趋势,但无统计学差异(P>0.05);A、B 及C 组组间的流产率及多胎率均无统计学差异(P>0.05)(表4)。
表2 姐妹胚胎形成囊胚情况与D3移植结局(±s)

表2 姐妹胚胎形成囊胚情况与D3移植结局(±s)
注:与对照组比较,*P<0.01,**P<0.05
组 别 周期数 移植胚胎数 种植率(%) 临床妊娠率(%) 流产率(%)对照组 134 2.02±0.19 19.41(53/273) 32.84(44/134) 13.63(6/44)囊胚形成组 363 2.02±0.15 31.34(230/734)* 50.14(182/363)* 15.38(28/182) D5组 107 2.00±0.10 34.42(74/215)* 53.27(57/107)* 10.52(6/57) D6组 144 2.04±0.18 29.01(85/293)* 47.92(69/144)** 14.49(10/69) D5+D6组 112 2.02±0.13 31.42(71/226)* 50.00(56/112)* 10.71(6/56)
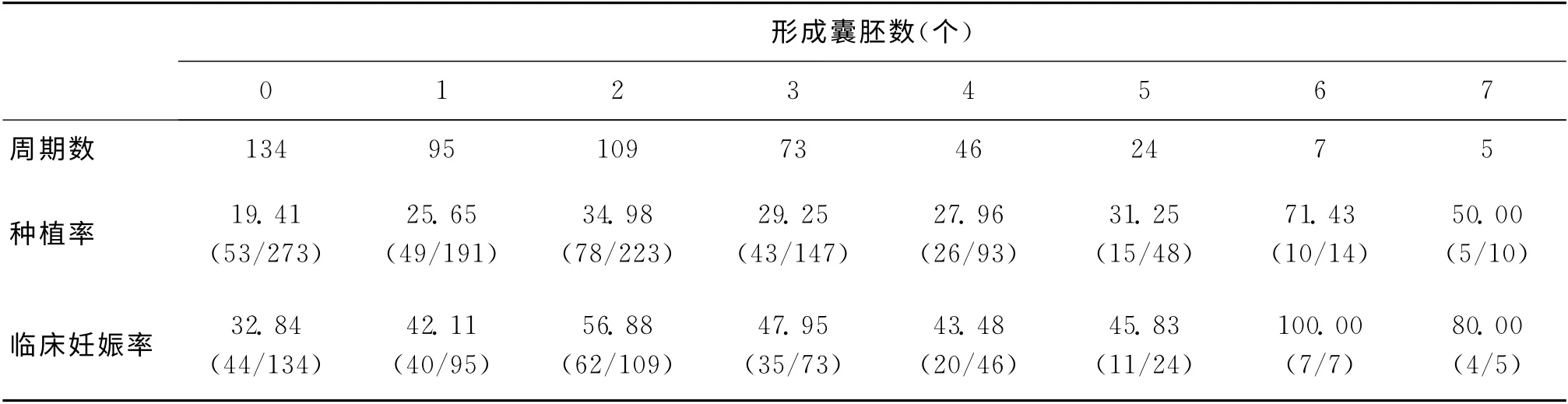
表3 D3胚胎移植结局与姐妹胚胎囊胚形成个数的关系(%)
表4 非优质胚胎数≥5的周期姐妹胚胎形成囊胚情况与D3移植结局(±s,%)

表4 非优质胚胎数≥5的周期姐妹胚胎形成囊胚情况与D3移植结局(±s,%)
注:与A 组比较,*P<0.05,#P<0.01
组 别 周期数 年龄(岁) 移植数(枚)种植率 临床妊娠率 流产率 多胎率A 组 46 29.35±4.19 2.02±0.15 43.01(40/93) 67.39(31/46) 22.58(7/31) 29.03(9/31)B组 139 30.35±3.75 2.03±0.17 29.43(83/282)* 47.48(66/139)* 16.67(11/66) 24.76(17/66)C组 197 30.69±4.49 2.02±0.14 23.12(92/398)# 38.58(76/197)# 10.53(8/76) 21.05(16/76)
讨 论
随着不孕夫妇对人类辅助生育技术需求的增加,如何在提高临床妊娠率的同时也减低多胎妊娠的风险是生殖医学普遍关注的问题。囊胚移植较D3胚胎移植有更好的临床结局,但周期取消的风险较大,所以部分中心选择在D3 移植优质胚胎后将剩余的胚胎继续培养成囊胚后冻存,等待冻胚移植。对于姐妹胚胎体外培养的囊胚形成率及囊胚形成个数是否可以预测移植胚胎的发育、种植潜能尚无统一结论。
多项研究表明,姐妹胚胎体外培养的囊胚形成率及囊胚形成个数可以用于预测D3胚胎移植的临床结局[3,7-8]。本研究回顾性分析了2013年1月至2014年5月在本中心行D3优质胚胎移植,且剩余胚胎继续培养的497个周期的数据,在不孕时间、女方年龄、不孕类型、移植胚胎数等基础资料无显著差异的情况下,姐妹胚胎继续培养有囊胚形成组患者的种植率和临床妊娠率均显著高于对照组,其中D5、D6有囊胚形成的患者其D3移植周期的种植率及临床妊娠率也显著高于对照组。从趋势上看,D5组鲜胚移植后的种植率及临床妊娠率均高于D6组和D5+D6组,且D5+D6组的种植率及临床妊娠率较D6组也有增高趋势。D3 移植胚胎的种植率及临床妊娠率均与姐妹胚胎培养形成囊胚的个数呈正相关。我们推测,囊胚形成组及亚组的种植率及妊娠率较无囊胚形成组高,可能的原因之一是有囊胚形成的患者其胚胎质量较好,正如本文表1所示,囊胚形成组及各亚组较无囊胚形成组获得的优质胚胎数更多。为了进一步探索姐妹胚胎的囊胚形成率与D3移植结局的相关性,我们将研究对象(囊胚培养的非优质胚胎数≥5)按囊胚形成率分为3组(≥40%为A 组,介于20%~40%为B 组,<20%为C组),统计结果显示,A 组的D3 胚胎移植周期种植率及临床妊娠率显著高于B组及C 组,B组较C 组也有升高趋势,表明姐妹胚胎囊胚形成率高的患者,D3移植后有较好的临床结局,与早先的报道[9-10]结论一致。
发育速度较快的胚胎其存活能力更高,胚胎的发育速度可能用于预测其种植潜能[11-13],在一定程度上可能是由于发育较慢的胚胎非整倍体的发生率更高[14]。结合本项研究结果,我们推测,姐妹胚胎的发育速度也可能用于预测D3胚胎移植后的临床结局。胚胎在体外培养时间的延长可能选择出更有发育潜能的胚胎。有文献报道,发育潜能较差的胚胎可能停滞在基因组激活的卵裂期阶段,体外继续培养后能够形成囊胚的胚胎,其染色体异常的比例更低[15]。胚胎质量、卵母细胞质量及培养环境等均可影响囊胚形成,其中以卵裂期胚胎的质量尤为重要,它不仅影响形成的囊胚的质量,也影响囊胚的形成率[16]。
卵裂期胚胎内在质量可能直接决定其发育潜能[17],从而影响胚胎移植后的临床结局。一般而言,D3 移植的胚胎都是同期获得的胚胎中质量较好、形态学评分较高的胚胎,因此,剩余姐妹胚胎体外培养成囊胚的能力就可能间接反映D3移植胚胎在体内发育的潜能及其临床结局[9]。在我们的研究中,姐妹胚胎有囊胚形成组较无囊胚形成的对照组D3移植后有较好的胚胎种植率及临床妊娠率,因此,我们认为,姐妹胚胎体外培养形成囊胚的能力也可以间接反应D3移植胚胎在体内发育的潜能及其临床结局,这与国内外多项研究结果一致[3,8-10]。关于剩余胚胎形成囊胚的能力对临床妊娠的预测作用,国外数据研究表明,其阴性预测率为82%,阳性预测率为60%[18-19]。
囊胚的发育速度可以预测胚胎的着床潜能,发育速度越慢,妊娠率则越低[20]。Alfarawati等[14]活检滋养层细胞对囊胚进行染色体分析后发现,发育迟缓的囊胚,其非整倍体的发生率更高。本研究结果提示,囊胚形成各亚组(D5 组、D6 组及D5+D6组)患者的胚胎种植率及临床妊娠率均显著高于对照组,各亚组间的种植率及临床妊娠率虽无统计学差异,但D5 组较D6 组及D5+D6 组均有升高趋势,且D5+D6组较D6组也有增高趋势,我们认为姐妹胚胎培养形成囊胚的速度也能预测D3移植后的临床结局。
姐妹胚胎继续培养形成囊胚的个数也与D3移植胚胎的种植率及临床妊娠率相关。有研究表明,单囊胚移植后剩余胚胎继续培养后冷冻,冷冻的囊胚个数与种植率及活婴出生率显著相关,且种植率及活婴出生率随着冷冻囊胚个数的增加而增加[8,10]。在本研究中,姐妹胚胎继续培养形成囊胚的个数在1~10个之间,由于囊胚数>7个的周期只有4个,故未纳入进行相关性分析。我们的结果显示,姐妹胚胎形成囊胚的个数与D3 移植胚胎的种植率及临床妊娠率显著正相关。这与Hill等[8]提出的“形成囊胚的个数也与胚胎种植率和临床妊娠率呈显著正相关”结论一致。本研究中,囊胚个数为6时,种植率及临床妊娠率均达到了最大值,分别为71.43%和100.00%。囊胚数>7 的4 个周期中,种植率及临床妊娠率有所下降,但本研究纳入的囊胚数>7的周期数较少,可能不能反映姐妹胚胎形成囊胚的个数与D3 移植胚胎的临床结局的相关性。
这项研究还存在一定的局限性。因为用于继续培养的非优质胚胎数量可能存在差异,而这些差异可能影响囊胚形成的比例。因此,我们进一步对非优质胚胎数≥5的患者进行了研究,但是,针对姐妹胚胎体外形成囊胚的数量与D3胚胎移植结局的相关性分析还需要更大样本量的研究。
总之,本研究结果表明,姐妹胚胎继续培养后形成囊胚的能力、个数与速度与D3 移植胚胎的种植潜能和发育潜能有关,同周期姐妹胚胎体外形成囊胚的能力个数与速度成为除卵裂期胚胎形态学评估以外的又一预测D3移植胚胎的临床结局的有效预测因子。对于D3移植失败但姐妹胚胎培养成为囊胚的患者,可能更需要关注体内激素环境、黄体功能支持及子宫内膜容受性等胚胎以外的原因[21],以期获得妊娠。
[1] Racowsky C,Combelles CM,Nureddin A.Day 3and day 5 morphological predictors of embryo viability[J/OL].Reprod Biomed Online,2003,63:23-31.
[2] Sjögren A,Sjöblom P,Hamberger L.Culture of human spare preembryos:association between blastocyst formation and pregnancy[J].J Assist Reprod Genet,1992,9:41-44.
[3] 宋成,万才云,鲍忠剑,等.姐妹胚胎体外囊胚形成能力对体外受精-胚胎移植临床结局的预测作用研究[J].生殖医学杂志,2014,23:367-371.
[4] 余楠,杨菁,赵庆红,等.卵巢低反应患者不同剂量促性腺激素促排卵对体外受精结局的影响[J].中华临床医师杂志(电子版),2012,6:1019-1021.
[5] 尹太郎,夏曦,穆杨,等.体外受精-胚胎移植后生化妊娠的相关危险因素分析[J].医学分子生物学杂志,2014,11:311-317.
[6] Gardner DK,Vella P,Lane M,et al.Culture and transfer of human blastocysts increases implantation rates and reduces the need for multiple embryo transfers[J].Fertil Steril,1998,69:84-88.
[7] Mackenna A,Crosby J,Zegers-Hochschild F.Sibling embryo blastocyst development as a prognostic factor for the outcome of day-3embryo transfer[J].Reprod Biomed Online,2013,26:486-490.
[8] Hill MJ,Richter KS,Heitmann RJ,et al.Number of supernumerary vitrified blastocysts is positively correlated with implantation and live birth in single-blastocyst embryo transfers[J].Fertil Steril,2013,99:1631-1636.
[9] 胡煜,任海琴,宫立国,等.人类姊妹胚胎体外囊胚形成情况与妊娠结局关系的研究[J].中国优生与遗传杂志,2013,21:105-110.
[10] Thomas MR,Sparks AE,Ryan GL,et al.Clinical predictors of human blastocyst formation and pregnancy after extended embryo culture and transfer[J].Fertil Steril,2010,2:543-548.
[11] Behr B,Gebhardt J,Lyon J A,et al.Factors relating cryopreserved blastocyst transfer program[J].Fertil Steril,2002,77:697-699.
[13] 王雪,甄骤然,孙正怡,等.囊胚发育速度对冻融移植结局的影响[J].生殖医学杂志,2014,23:356-360.
[14] Alfarawati S,Fragouli E,Colls P,et al.The relationship between blastocyst morphology,chromosomal abnormality,and embryo gender[J].Fertil Steril,2011,95:520-524.
[15] Gardner DK,Balaban B.Choosing between day 3and day 5 transfers[J].Clin Obstet Gynecol,2006,49:85-92.
[16] Blake D,Proctor CM,Johnson N,et al.Cleavage stage versus blastocyst stage embryo transfer in assisted conception[J].Cochrane Database Syst Rev,2007:CD002118.
[17] Staessen C,Platteau P,Van Assche E,et al.Comparison of blastocysttransfer with or without preimplantation genetic diagnosis for aneuploidy screening in couples with advanced maternal age:aprospective randomized controlled trial[J].Hum Reprod,2004,19,2849-2958.
[18] Balaban B,UrmanB,Sertae A,et al.Progression of excess embryos to the blastoeyst stage prediets pregnaney and implantation rates after intracytoplasmic sperm injection[J].Hum Reprod,1998,13:2564-2567.
[19] Fiseh Milki AA,Behr B.Sibling embryo blastocyst development correlates with the in vitro fertilization day3 embryo transfer pregnancy rate in patients under age 40[J].Fertil Steril,1999,71:750-752.
[20] Barrenetxea G,López de Larruzea A,Ganzabal T,et al.Blastocyst culture after repeated failure of cleavage-stage embryo transfers:a comparison of day 5and day 6transfers[J].Fertil Steril,2005,83:49-53.
[21] 梁菊艳,王芳,孙莹璞,等.废弃胚胎继续囊胚培养研究[J].生殖与避孕,2008,10:598-601.

