系统性红斑狼疮患者外周血T、B细胞自噬水平及其临床意义①
陈燕文 王 超王旭光冯永民 安 宁 吴洪銮 李尚妹 陶静莉 刘伟敬 刘华锋 潘庆军(广东医学院附属医院肾脏疾病研究所,湛江524001)
系统性红斑狼疮患者外周血T、B细胞自噬水平及其临床意义①
陈燕文王超②王旭光③冯永民安宁吴洪銮李尚妹陶静莉刘伟敬刘华锋潘庆军(广东医学院附属医院肾脏疾病研究所,湛江524001)
[摘要]目的:探讨系统性红斑狼疮(Systemic lupus erythematosus,SLE)患者外周血T、B淋巴细胞自噬水平及其临床意义。方法:入组就诊前4周内未用药的SLE患者68例;用流式细胞术检测23例正常人和68例经激素和免疫抑制剂治疗前后的SLE患者外周血T、B淋巴细胞的自噬水平及其变化情况,并分析其与补体C3、SLEDAI评分和血清Anti-dsDNA水平的相关性。结果:治疗前SLE患者T淋巴细胞自噬水平显著高于正常人,活动组(SLEDAI score≥10) SLE患者显著高于稳定组(SLEDAI score<10),且活动组中初发组(即首次确诊)显著高于复发组(P均<0.05)。而SLE患者B淋巴细胞自噬水平显著低于正常人,活动组SLE患者显著低于稳定组,且活动组中初发组显著低于复发组(P均<0.05)。相关性分析发现,SLE患者T淋巴细胞自噬水平与SLEDAI评分呈正相关(rs= 0.289,P<0.05),B淋巴细胞自噬水平与血清补体C3水平呈正相关(rs= 0.371,P<0.01)。经激素和免疫抑制剂治疗5 d后,SLE患者预后良好组(SLEDAI降低≥4分)的T淋巴细胞自噬水平即可显著降低(P<0.05) ;治疗3 d后,SLE患者预后良好组的B淋巴细胞自噬水平即可显著升高(P<0.05) ;预后不良组治疗前后T、B淋巴细胞的自噬水平变化无统计学意义。结论: SLE患者外周血T、B淋巴细胞自噬水平异常,其变化与疾病活动度相关,有望作为疾病活动度指标和潜在的临床治疗靶标。
[关键词]系统性红斑狼疮; T细胞; B细胞;自噬; LC3-Ⅱ
①本文受国家自然科学基金(No.81202346,30971370,81270798)和湛江市科技计划项目(2013B01040)资助。
②共同第一作者,沈阳医学院附属第二医院肾内科,沈阳110000。
③共同第一作者,广东医学院附属医院临床研究中心,湛江524001。
Levels of autophagy in T cells and B cell of patients with systemic lupus erythematosus and its clinical significance
CHEN Yan-Wen,WANG Chao,WANG Xu-Guang,FENG Yong-Min,AN Ning,WU Hong-Luan,LI Shang-Mei,TAO Jing-Li,LIU Wei-Jing,LIU Hua-Feng,PAN Qing-Jun.Institute of Nephrology,Affiliated Hospital of Guangdong Medical College,Zhanjiang 524001,China
[Abstract]Objective: To investigate levels of autophagy in T cells and B cell of patients with systemic lupus erythematosus (SLE) and its clinical significance.Methods: 68 SLE patients without treatment within 4 weeks were enrolled in this study.We accessed the levels of autophagy in T cells and B cells of 23 healthy controls and 68 patients before and after treatment by flow cytometry,and analyzed their correlations with serum levels of C3 and anti-dsDNA antibodies,SLEDAI score,et al.Results: Before treatment,a significantly increased levels of LC3-Ⅱwas observed in SLE patients than healthy controls,the active group(SLEDAI score≥10) was significantly higher than the stable group(SLEDAI score<10),and the newly diagnosed group was significantly higher than the recurrent group (all P<0.05) .While the levels of LC3-Ⅱwas decreased in B lymphocytes in SLE patients,the active group was significantly lower than stable group,and the active group was significantly lower than the newly diagnosed group(all P<0.05).Correlation analysis found that,a positively correlation was observed for the levels of LC3-Ⅱwith SLEDAI score in T lymphocyte(rs= 0.289,P<0.05),and the levels of C3 were positively correlated the levels of LC3-Ⅱin B lymphocyte(rs=0.371,P<0.01) .After treatment for five days,levels of autophagy in T lymphocytes of SLE patients with good prognosis(SLEDAI score decreased≥4) significantly decreased(P<0.05) .Also,three days after treatment,levels of autophagy in B lymphocytes of SLE patients with good prognosis were increased significantly(P<0.05) .However,SLE patients with poor prognosis had no such difference(P>0.05).Conclusion: Levels of autophagy in T and B lymphocytes of SLE patients are abnormal compared to healthy controls,and these changes are associated with disease activity.Also,these changes are expected to be the indicators of disease activity and potential therapeutic targets in SLE.
[Key words]Systemic lupus erythematous; T lymphocytes; B lymphocytes; Autophagy; LC3-Ⅱ
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种免疫调节紊乱的自身免疫性疾病,其发病机制尚未完全解析[1]。但T、B细胞等多种免疫细胞功能失常,导致自身抗体产生,从而形成大量免疫循环复合物,进而沉积于各个脏器的病理过程已获广泛认知[2]。目前认为,自身抗原失耐受的主要机制是T细胞异常活化和CD4+辅助T淋巴细胞异常分泌细胞因子[3],以及B细胞异常活化及分化为效应细胞(浆细胞),通过分泌自身抗体,摄取和提呈自身抗原,释放多种细胞因子等方式参与自身免疫疾病的启动和维持[4,5]。其中,T、B细胞活化和凋亡信号异常是SLE的发病基础[6]。研究证实,辅助性T细胞(Th细胞)分化异常和功能失调在SLE发生发展中也起关键作用[7],如Th细胞分泌大量的炎症因子,同时刺激B细胞分化为浆细胞产生更多自身抗体,进而参与SLE的发病[6,7]。基于T、B细胞可相互影响,共同参与SLE的发病,但其具体作用机制和方式有待进入一步探讨。
自噬是经溶酶体介导的对胞内蛋白、衰老细胞器和胞内病原体等进行降解的过程,广泛存在于真核生物中,对稳定细胞内环境、维持细胞的生长、分化和功能极其重要[8]。在自噬过程中,内源性LC3转化加工成LC3-I,随着LC3-I和其他自噬相关蛋白共轭结合为LC3-Ⅱ,双层分隔膜逐渐延伸形成自噬体,因此LC3-Ⅱ是自噬体形成的标记,检测该形式的LC3-Ⅱ的水平可作为自噬量化的指标[9]。目前,市售anti human LC3抗体可同时识别LC3-I和LC3-Ⅱ,但经以saponin(皂苷)为代表的表面活性剂处理细胞可清除LC3-I,保留LC3-Ⅱ[12-14],因此,用流式细胞术检测经saponin处理的细胞,仅可检测LC3-Ⅱ,是一种方便快捷的检测手段。
对于SLE患者免疫细胞自噬是否异常,Frédéric[10]和赵继军[11]等发现SLE患者外周血单个核细胞(PBMC)有自噬泡堆积的现象。已知,PBMC含多种细胞类型,而T、B细胞在SLE疾病发展中起重要作用,但其自噬水平如何,以及治疗后自噬水平变化如何,有何临床意义?尚有待进一步深入研究。
本研究通过检测SLE患者,及其治疗前后外周血T、B细胞自噬通路关键标记物LC3-Ⅱ的表达情况,探讨SLE患者外周血T、B淋巴细胞的自噬水平及其临床意义。
1 资料与方法
1.1临床资料入组2011年11月~2012年12月在广东医学院附属医院肾病内科门诊和住院的SLE患者68例(男13例,女55例),诊断均符合1997年美国风湿病协会(ACR)修正的SLE分类标准。收集SLE患者的临床资料及实验室检查数据,并计算患者SLE活动指数(SLE disease activity index,SLEDAI),根据SLEDAI评分(SLEDAI score)将SLE患者分为活动组(SLEDAI≥10分) 46例(包括初诊活动期31例和复发活动期15例)和稳定组(SLEDAI<10分) 22例。活动组患者平均年龄为(24.3±7.2)岁,稳定组患者平均年龄为(30.1±9.2)岁,同时选取性别和年龄匹配的健康志愿者23例(男6例,女18例),平均年龄(23.7±5.3)岁为对照组。
1.2试剂和仪器PE anti-human CD19、PE-Cy7 anti human CD3、APC-Cy7 anti human CD4均购自BioLegend公司。anti human LC3抗体(可同时识别LC3-I和LC3-Ⅱ)及其同型对照(mouse IgG1)购自MBL公司。FITC anti mouse IgG购自Santa cruz公司。裂解液、固定液、穿透液(saponin)、染色液购自BioLegend和ebioscience公司。流式细胞仪为BD FACSCantoTMⅡ。
1.3流式细胞检测人外周血T、B细胞自噬标记物
1.3.1荧光抗体标记采集受试者清晨空腹外周静脉血3 ml,EDTA抗凝;取2支试管用于制备样本,先将裂解液分别加入上述试管中,每管6 ml,再将血标本1 ml分别加入上述试管并充分裂解;离心后去上清,加入2 ml PBS(10 mmol/L)洗涤,两试管均加入荧光表面抗体PE-Cy7 CD3(10 μl)、APCCY7 CD4(10 μl)、PE CD19(10 μl),混匀,避光孵育30 min;再加入固定液100 μl,固定15 min;基于参考文献[12-14],继之加入穿透液(含0.1% saponin) 2 ml/管,充分震荡,洗涤穿透2次,1 500 r/min×6 min/次。加入穿透液(100 μl/管)重悬细胞后加含羊血清5%的封闭液进行封闭; PBS洗涤2次后在试管1加入0.5 μl的mouse IgG1作为同型对照,试管2加入anti-LC3抗体0.5 μl,混匀,室温避光孵育30min;加入PBS洗涤2次;加入穿透液(100 μl/管)重悬细胞后,加入FITC anti mouse IgG(2 μl/管),室温避光孵育30 min;再次PBS洗涤2次;加入染色液重悬细胞(200 μl/管),流式检测备用。
1.3.2流式细胞仪检测设置相应各通道电压后,根据前向散射角和侧向散射角,对整个白细胞进行设门,分别以CD3+定义为CD3+T细胞; CD3+CD4+定义为CD4+T细胞; CD3+CD4-定义为CD8+T细胞; CD3+CD4+CD19+定义为B细胞。以平均荧光强度(Mean fluorescence intensity,MFI)表示T、B细胞的LC3-Ⅱ的表达水平。
1.4 SLE的其他指标检测方法补体C3采用免疫速率散射比浊法(广州丹纳医疗科技有限公司),anti-dsDNA采用酶联免疫吸附试验(ELISA)检测(上海科新生物技术股份有限公司)。
1.5统计学方法应用SPSS16.0对数据进行统计分析。根据Kolmogorov-Smimov正态性检验可知该组资料是否为偏态分布,本文采用非参数检测方法对数据进行处理。计数资料差异比较采用χ2检验,计量资料采用中位数(四分位间距)[M(P25-P75)]表示,Mann-Whitney Test分析;非参数数据的相关分析采用Spearman秩相关,比较自噬相关标记物LC3-Ⅱ与SLEDAI评分及其他指标的相关性。
2 结果
2.1 SLE患者外周血T、B细胞LC3-Ⅱ的比较
2.1.1 SLE患者外周血T细胞LC3-Ⅱ的表达CD3+T细胞LC3-Ⅱ的表达水平: SLE活动组LC3-Ⅱ的平均荧光强度为1 000.5(909.5,1 270)显著高于稳定组263.5(219,341)和对照组282(260,317),差异均有统计学意义(均P<0.01) ;而稳定组与对照组相比,差异无统计学意义(P>0.05) ;在活动组中初发组372.5 (221.5,451.5)低于复发组461 (386.5,937),差异有统计学意义(P<0.05)。
CD4+T细胞LC3-Ⅱ的表达水平: SLE活动组LC3-Ⅱ的平均荧光强度为1 021(929,1281)显著高于稳定组260.5 (205.62,310.13)和对照组289 (272,320),差异均有统计学意义(均P<0.01) ;稳定组与对照组相比,差异无统计学意义(P>0.05) ;在活动组中初发组341(128,484)低于复发组396.5 (311,480),差异有统计学意义(P<0.05)。
CD8+T细胞LC3-Ⅱ的表达水平: SLE活动组LC3-Ⅱ的平均荧光强度为997(899,1290)显著高于稳定组297.75(244.25,358.75)和对照组275(257,306),差异均有统计学意义(均P<0.01) ;稳定组与对照组相比,差异无统计学意义(P>0.05) ;在活动组中初发组411(377.5,481)与复发组404(409,1317),差异无统计学意义(P>0.05) (见图1)。
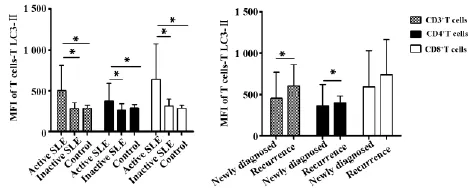
图1 SLE患者和正常人T细胞自噬(LC3-Ⅱ)的表达情况Fig.1 Expression of autophagy(LC3-Ⅱ) in T cells of SLE patients and health controls
Note: Active SLE=46,inactive SLE=23 and healthy controls= 22,* .P<0.05.
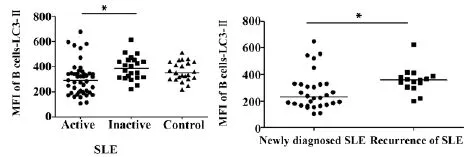
2.1.2 SLE患者外周血B细胞LC3-Ⅱ的表达SLE活动组外周血B细胞LC3-Ⅱ的平均荧光强度为319.5 (206.1,368.8),低于SLE稳定组385 (311.5,451),差异有统计学意义(P<0.05) ;与对照组350 (300.5,511)相比,无统计学意义(P>0.05) ; SLE稳定组与对照组相比,无统计学意义(P>0.05) (图2A)。在活动组中初发SLE外周血B细胞LC3-Ⅱ的平均荧光强度261(188,361)低于复发SLE外周血B细胞LC3-Ⅱ的平均荧光强度357 (305,387),有统计学意义(P<0.05) (图2B)。
2.2 SLE患者T、B细胞LC3-Ⅱ水平与补体C3、SLEDAI评分和Anti-dsDNA的相关性SLE患者组外周血CD3+T细胞LC3-Ⅱ的平均荧光强度与SLEDAI评分呈正相关(rs= 0.289,P<0.05),而CD4+T细胞和CD8+T细胞LC3-Ⅱ的平均荧光强度与血清C3水平、SLEDAI评分、血清anti-dsDNA水平无相关关系。
SLE患者组外周血B细胞LC3-Ⅱ的平均荧光强度与血清C3水平呈正相关(rs=0.371,P<0.01)。而与SLEDAI评分、血清anti-dsDNA抗体滴度均无相关关系(表1)。
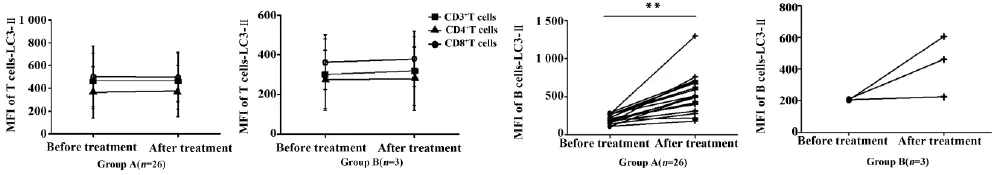
图3 SLE患者治疗前后外周血CD3+T细胞、CD4+T细胞、CD8+T细胞和B细胞LC3-Ⅱ变化情况Fig.3 Changes of levels of LC3-Ⅱexpression in CD3+T cells,CD4+T cells,CD8+T cells and B cells in SLE patients before and after treatment
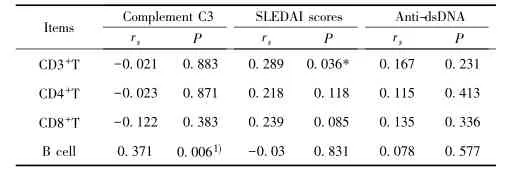
表1 SLE患者T细胞和B细胞LC3-Ⅱ与补体C3、SLEDAI评分和Anti-dsDNA的相关分析Tab.1 Analysis of correlations between expression of LC3-Ⅱin T cells and B cell with serum levels of anti-ds-DNA antibodies and C3 and SLEDAI scores in SLE patients

表2 预后良好的SLE患者T、B细胞LC3-Ⅱ水平显著变化的天数Tab.2 Days of significantly change of LC3-Ⅱlevels expression in T and B cells of SLE patients with good prognosis
2.3治疗后外周血T、B细胞LC3-Ⅱ的变化情况本研究同时随访了29例SLE患者(A组: 26例预后良好,B组: 3例预后较差),检测其在本次入院治疗前和治疗后第7天的外周血T、B细胞自噬相关标记物的变化情况。经统计分折与治疗前对比:治疗后SLE患者外周血CD3+T细胞、CD4+T细胞和CD8+T细胞LC3-Ⅱ的变化情况: AB两组LC3-Ⅱ的表达水平治疗前后差异均无统计学意义(P>0.05)。
治疗后SLE患者外周血B细胞LC3-Ⅱ的变化情况: A组LC3-Ⅱ的表达水平从治疗前399(193.5,363.5)升至510(399,649),差异有统计学意义(P<0.01) ; B组,治疗前后LC3-Ⅱ表达分别为207 (203.5,212)和461(224,606),治疗前后差异无统计学意义(P>0.05) (图3)。
2.4 SLE患者经药物治疗前后补体C3、SLEDAI以及外周血T、B细胞LC3-Ⅱ表达的变化情况随访SLE患者经激素(醋酸泼尼松、甲泼尼龙琥珀酸钠)和免疫抑制剂(环磷酰胺、环孢素A、霉酚酸酯、硫唑嘌呤、雷公藤多甙)治疗前和治疗后1、3、5、7 d外周血T、B细胞LC3-Ⅱ、SLEDAI评分和补体C3结果(表2)。经统计分折与治疗前配对检验,治疗5 d 后A组(预后良好组) T细胞和治疗3 d后B细胞的LC3-Ⅱ的平均荧光强度发生变化,差异有统计学意义(P<0.01),而其他指标相对变化较慢,补体在治疗1个月才有显著变化,anti-dsDNA水平变化时间在6个月。
3 讨论
已知自噬同时参与生理和病理过程[15-17],自噬异常存在于多种自身免疫性疾病中[11,18,19],但SLE相关的自噬研究较少,部分结果尚有争议[9-11,20,23]。明确两大类免疫细胞T、B细胞的自噬活性以及与疾病的转归关系尤为重要[21]。
本研究发现,疾病活动期SLE患者外周血CD3+T细胞、CD4+T细胞和CD8+T细胞LC3-Ⅱ的平均荧光强度显著高于稳定组和对照组,该增多可能由于自噬诱导增加或自噬通路受阻导致[22]。另外,已报道Th细胞因子可以诱导自噬[19],本研究中,与对照组相比,活动组SLE患者外周血T细胞LC3-Ⅱ表达水平均显著增加,并与SLEDAI评分呈正相关关系。提示在SLE发病时T细胞的LC3-Ⅱ增加可能与细胞因子的增多有关,即SLE患者外周血CD3+T细胞、CD4+T细胞和CD8+T细胞存在自噬被过度诱导的现象,从而活化T细胞,释放大量细胞因子,促进炎症和器官损伤,加重疾病,致SLEDAI评分升高[6,7,24]。但是我们对SLE活动组中初发组与复发组的比较发现虽然活动组LC3-Ⅱ显著高于稳定组及对照组,但是LC3-Ⅱ的增加主要以复发SLE组为主,提示SLE治疗药物在治疗疾病的同时也极大地干预了细胞的自噬水平。此外,还发现在活动组中初发SLE外周血CD3+T细胞和CD4+T细胞LC3-Ⅱ的表达低于复发组,但CD8+T细胞则无组间差异,提示CD8+T细胞LC3-Ⅱ的表达对治疗药物的敏感性可能不如CD3+T细胞和CD4+T细胞。
随访研究发现,经过5 d治疗后,病情好转的SLE患者LC3-Ⅱ的表达水平下降,进一步支持自噬参与了SLE的发病,并且现有的激素和免疫抑制剂存在自噬调控的作用[25,26]。
此外,研究结果显示疾病活动期SLE患者外周血B细胞LC3-Ⅱ的表达低于对照组,并与补体C3呈正相关,推测SLE患者外周血B细胞自噬在诱导阶段即受到抑制,已有文献证实自噬基因ATG5是B细胞存活的重要影响因素[27],即敲除Atg5可使B细胞存活率明显下降,即激活自噬是自身免疫性B细胞存活的一种机制[23]。我们的结果显示B细胞的自噬可能受抑制,理论上B细胞的存活和功能亦可能受损,然而SLE发病过程中B细胞和T细胞可相互作用,如疾病活动期T细胞自噬被过度诱导,分泌多种炎症因子促使B细胞分化为浆细胞,并分泌大量自身抗体[6,7,24],进而激活补体途径,导致血清补体C3水平降低。基于SLE发病中T淋巴细胞的主导地位,推测其可调控B细胞因自噬受抑制而引起的功能缺陷。同时通过分析初发组与复发组SLE患者的结果,发现LC3-Ⅱ的表达低于复发组,推测现行治疗药物(激素和免疫抑制剂)对B细胞自噬存在着广泛的影响。但目前关于免疫抑制剂对B细胞自噬情况的影响报道较少。
最后,随访研究还发现,经过治疗7 d后,病情好转的SLE患者LC3-Ⅱ的表达水平增加,推测这种抑制作用,随着疾病的好转逐渐减弱。同时预后良好的患者治疗第三天后LC3-Ⅱ的平均荧光强度表达显著升高,因此该指标有望成为判断药物疗效的早期敏感指标。
综上,SLE患者外周血T、B淋巴细胞自噬水平异常,其变化与疾病活动度相关,可作为预后的标志物,为SLE治疗提供了一个潜在的靶点。
参考文献:
[1]Liu Z,Davidson A.Taming lupus-a new understanding of pathogenesis is leading to clinical advances[J].Nat Med,2012,6(18) : 871-882.
[2]Shlomchik MJ,Craft JE,Mamula MJ.From T to B and back again: positive feedback in systemic autoimmune disease[J].Nat Rev Immunol,2001,1(2) : 147-153.
[3]Uhm WS,Na K,Song GW,et al.Cytokine balance in kidney tissue from lupus nephritis patients[J].Rheumatology,2003,42(8) : 935-938.
[4]Zhou XJ,Lu XL,Lv JC,et alet al.Genetic association of PRDM1-ATG5 intergenic region and autophagy with systemic lupus erythematosus in a Chinese population[J].Ann Rheum Dis,2011,70 (7) : 1330-1337.
[5]Gateva V,Sandling JK,Hom G,et al.A large-scale replication study identifies TNIP1,PRDM1,JAZF1,UHRF1BP1 and IL10 as risk loci for systemic lupus erythematosus[J].Nat Genet,2009,41: 1228-1233.
[6]Mok CC,Lau CS.Pamogenesis of systemic lupus emematosus[J].J Clin Pathol,2003,56(7) : 481-490.
[7]Crispín JC,Kyttaris VC,Terhorts C,et al.T cells as therapeutic targets in SLE[J].Nat Rev Rheumatol.2010,6: 317-325.
[8]Klionsky D J,Abdalla F C,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4) : 445-544.
[9]Alessandri C,Barbati C,Vacirca D,et al.T lymphocytes from patients with systemic lupus erythematosus are resistant to induction of autophagy[J].FASEB J,2012,26(11) : 4722-4732.
[10]Frédéric G,Johan A,Nicolas P,et al.Macroautophagy is deregulated in murine and human lupus T lymphocytes[J].Autophagy,2012,8(7) : 1113-1123.
[11]赵继军,李美荣,陆才生,等.活动性系统性红斑狼疮自噬及相关基因研究[J].中华风湿病学杂志,2009,13 (3) : 148-151.
[12]Eng KE,Panas MD,Karlsson Hedestam GB,et al.A novel quantitative flow cytometry-based assay for autophagy[J].Autophagy,2010,6(5) : 634-641.
[13]Warnes G.Measurement of autophagy by flow cytometry[J].Curr Protoc Cytom,2014,68: 9.45.1-9.45.10.
[14]Ciechomska IA,Tolkovsky AM.Non-autophagic GFP-LC3 puncta induced by saponin and other detergents[J].Autophagy,2007,3 (6) : 586-590.
[15]Chen WT,Hung KC,Wen MS,et al.Impaired leukocytes autophagy in chronic kidney disease patients[J].Cardiorenal Med,2013,3(4) : 254-264.
[16]Paludan C,Schmid D,Landthaler M,et al.Endogenous MHC class Ⅱprocessing of a viral nuclear antigen after autophagy[J].Science,2005,307: 593-596.
[17]Kubaila P,Huatt A,Rioux JD,et al.Impaired autophagy of intracellular pathogen induced by a Crohn's disease associated ATGl6Ll variant[J].PLoS One,2008,3(10) : e3391.
[18]Alirezaei M,Fox HS,Flynn CT,et al.Elevated ATG5 expression in autoimmune demuelination and hauhiple sclerosis[J].Autophagy,2009,5: 152-158.
[19]Harris J,De Haro SA,Master SS,et al.T helper 2 cytokines inhibit autophagic control of intracellular Mycobacterium tuberculosis[J].Immunity,2007,27: 505-517.
[20]王超,潘庆军,冯永民,等.系统性红斑狼疮患者外周血Th1细胞自噬相关标记物的表达[J].中国免疫学杂志,2013,29(8) : 812-820.
[21]Choi J,Kim ST,Craft J.The pathogenesis of systemic lupus erythematosus-an update[J].Curr Opin Immunol,2012,24(6) : 651-657.
[22]Liu WJ,Luo MN,Tan J,et al.Autophagy activation reduces renal tubular injury induced by urinary proteins[J].Autophagy,2014,10(2) : 243-256.
[23]Clarke AJ,Ellinghaus U,Cortini A,et al.Autophagy is activated in systemic lupus erythematosus and required for plasmablast development[J].Ann Rheum Dis,2015,74(5) : 912-920.
[24]Zhou XJ,Cheng FJ,Zhang H.Emerging view of autophagy in systemic lupus erythematosus[J].Int Rev Immunol,2015,34(3) : 280-292.
[25]Jung JW,Overgaard NH,et al.Does the nature of residual immune function explain the differential risk of non-melanoma skin cancer development in immunosuppressed organ transplant recipients [J].Int J Cancer,2015(ahead of print) .
[26]Swerdlow S,McColl K,Rong Y,et al.Apoptosis inhibition by Bcl-2 gives way to autophagy in glucocorticoid-treated lymphocytes [J].Autophagy,2008,4(5) : 612-620.
[27]Miller B C,Zhao Z,Stephenson LM,et al.The autophagy gene ATG5 plays an essential role in B lymphocyte development[J].Autophagy,2008,4(3) : 309-314.
[收稿2015-03-28修回2015-04-13]
(编辑倪鹏)
·临床免疫学·
doi:10.3969/j.issn.1000-484X.2015.10.018
通讯作者及指导教师:刘华锋(1969年-),男,教授,博士生导师,主要从事免疫性肾小球疾病发病机制方面的研究,E-mail: hf-liu@ 263.net。潘庆军(1978年-),男,博士,副教授,硕士生导师,主要从事自身免疫性疾病防治方面的研究,E-mail: stilwapan@ gmail.com。
作者简介:陈燕文(1989年-),女,主要从事自身免疫性疾病的防治研究,E-mail: cyw1025@ 126.com。
文章编号1000-484X(2015) 10-1380-06
文献标志码A
中图分类号R392