一株木质素降解菌的筛选、鉴定及其漆酶发酵条件的优化
冯 波,林元山,胡 超,刘 婷
(湖南农业大学a.生物科学技术学院,b.东方科学技术学院,中国长沙 410128)
木质素是一类由苯基丙烷单元通过醚键和碳碳键等连接而成的聚酚类三维网状高分子化合物,极难被降解,在植物细胞壁中与半纤维素以共价键形式结合,包埋住纤维素分子,构成更加复杂的聚合物,阻碍了对植物纤维素材料等可再生资源的有效利用[1].自然界能够降解木质素的微生物主要分为白腐菌、褐腐菌和软腐菌.其中,白腐菌的酶系较完全、酶活较高,其不仅能分泌木质素降解酶,同时还分泌纤维素酶、半纤维素酶和果胶酶等[2].木质素降解酶系中起主导作用的酶有3 种,即漆酶(Laccase,Lac)、木质素过氧化物酶(Lignin Peroxidase,LiP)、锰过氧化物酶(Manganese Peroxidase,MnP)[3].其中漆酶由于存在的广泛性、催化底物的多样性以及酶活、稳定性都相对较高而得到广泛的研究与应用[4].漆酶(Laccase,EC1.10.3.2)是一类含铜的多酚氧化酶,主要产酶菌株为担子菌(Basidimycetes),如黄孢原毛平革菌(Phanerchaeto chrysosporium)、毛栓菌(Trametes hirsuta)、长绒毛栓菌(Trametes villosa)、脉射菌(Phlebia radiata)、凤尾菇(Pleuortus pulmonanus)等[5-7].漆酶能够催化多种底物氧化水解,广泛用于染料脱色,纸浆漂白,有机污染物降解,饮料澄清与色泽控制,药物制备以及新材料、生物传感器、生物监测等领域的开发与应用[8-10].目前,野生型菌株的木质素降解能力和漆酶活力普遍不高,因此,筛选漆酶高产野生型菌株具有重要的现实意义.
1 材料与方法
1.1 材料
1.1.1 菌种 试验筛选样品来源于从岳麓山、浏阳河等地采集的腐土和朽木.
1.1.2 试剂 ABTS 购于Sigma 公司;其余分析纯和化学纯药剂购于国药集团化学试剂有限公司;土豆、麸皮、豆饼粉、稻草粉等购于当地市场.
1.1.3 培养基
(1)筛选培养基为愈创木酚-PDA 固体培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂18 g/L,愈创木酚0.4 g/L,微量VB1,pH 自然.
(2)苯胺蓝(Azure-B)固体培养基:马铃薯汁200 g/L,葡萄糖20 g/L,琼脂18 g/L,8 μmol/L Azure-B,微量VB1,pH 自然.
(3)摇瓶复筛培养基:葡萄糖20 g/L,麸皮20 g/L,pH 自然.
(4)种子培养基:麸皮汁50 g/L,葡萄糖10 g/L,pH 自然.
(5)液体发酵基础培养基:葡萄糖20 g/L,硫酸铵5 g/L,MgSO4·7H2O 0.5 g/L,CuSO4·5H2O 0.05 g/L,MnSO40.05 g/L,pH 自然.
1.2 试验方法
1.2.1 木质素酶产生菌株的筛选 称取样品材料10 g,捣碎后加入装有90 mL 无菌水和少量玻璃珠的三角瓶中,振荡30 min 后静置,按10 倍稀释法涂布0.2 mL 于愈创木酚-PDA 平板上,30 ℃培养至菌落长出.观察菌落颜色和形状的变化,并分别测定其菌落圈和变色圈的直径,计算其变色系数(菌落圈半径d1/变色圈半径d2).挑取单菌落纯化至Azure-B 培养基平板中央,30 ℃恒温培养,观察菌株是否产生脱色圈.
1.2.2 菌种鉴定 观察PDA 培养基与液体摇瓶培养基中的菌体形态特征;并于显微镜下拍照记录;菌种送北京三博远志生物科技公司测序,并通过BLAST 与GenBank 中的序列进行比对,构建系统发育树进行鉴定.1.2.3 种子液的制备 挑取活化后的菌种接入装有100 mL 种子培养基的三角瓶中,在30 ℃,150 r/min 恒温摇床中培养3 d,制得种子液.
1.2.4 液体摇瓶发酵及粗酶液的制备 取2 mL 种子液接入装有100 mL 液体发酵培养基的三角瓶中,于30 ℃,150 r/min 恒温摇床中培养3~7 d.发酵液用四层纱布过滤,滤液在12 000×g 条件下离心5 min,上清即为粗酶液.
1.2.5 酶活力的测定 采用ABTS 法[6,11]:取0.1 mol/L pH3.0 醋酸-醋酸钠缓冲液1.95 mL 和0.5 mmol/L ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸))2.00 mL,置于30 ℃水浴10 min 后,加入0.05 mL 酶液启动反应,以灭活的酶液作空白对照,测定反应前5 min 内420 nm 处吸光度的增加值ΔOD420.定义每分钟氧化1 μmol ABTS 所需的酶量为1 个酶活力单位(U).计算公式为:酶活力(U/L)=ΔOD420×V总×106/(ε×Δt×V酶),式中ε 为ABTS 氧化态的摩尔消光系数(36 000 L·mol-1·cm-1),Δt 为反应时间.
2 结果与分析
2.1 愈创木酚-PDA 平板初筛及Azure-B 平板定性检测
本试验通过愈创木酚-PDA 培养基平板的初筛,经分离纯化后共获得约110 株菌.菌株均能在愈创木酚-PDA 平板上产生褐色变色圈,说明有产生木质素酶的能力;部分菌株相关数据见表1,变色系数越大,相对菌落的木质素酶活力越小.从表1 中可知,菌株Lys2833 变色系数为0.43,菌落木质素酶的活力相对较大,但菌落较小,酶活力总量不大;菌株Lys2988 的变色系数为1.37,木质素酶的活力相对较小,但菌落较大,生长较好,其优先降解纤维素;菌株Lys3002 变色系数为0.65,木质素酶的活力较大,且菌落最大,生长良好,酶活力及酶总量最大,进一步经愈创木酚平板定性检测发现,该菌变色圈颜色最深,为红褐色(图1a,彩图见封三),且该菌能够分泌木质素过氧化物酶氧化培养基中蓝色的Azure-B 而出现脱色圈(图1b,彩图见封三),显示出菌株Lys3002 具有分泌木质素酶系的能力,并且其中漆酶活力较高,因此选择该菌株进行下一步深入研究.
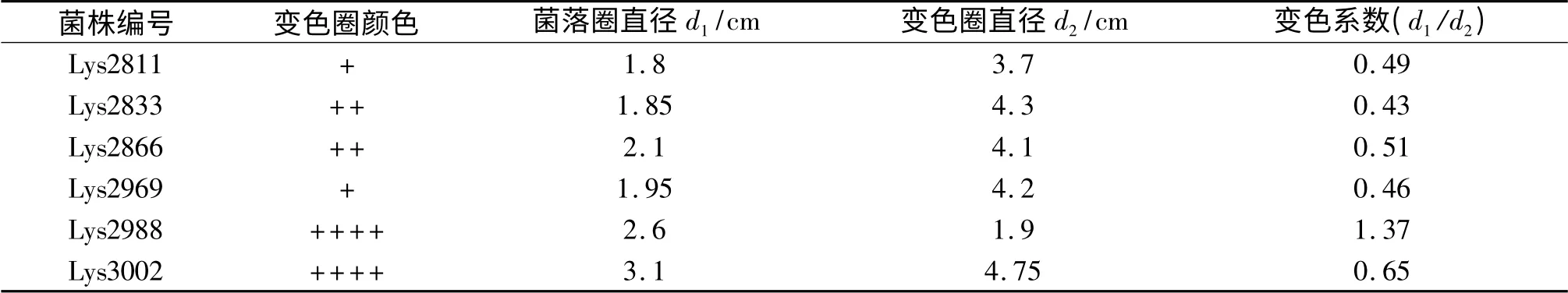
表1 菌株在愈创木酚平板上的生长及显色反应Tab.1 The color reaction of different strains on culture media contained guaiacol

图1 菌株Lys3002 平板显色及显微观察Fig.1 Coloration of the strain Lys3002 on media and microscopic observation
2.2 摇瓶发酵复筛
根据愈创木酚-PDA 平板初筛及Azure-B 平板定性检测结果对菌株Lys3002 进行液体摇瓶发酵复筛,测定3~7 d 内漆酶活力的大小(见图2).从图2 可知该菌株第5 天木质素酶系中漆酶活力达到最高449.6 U/L,之后有所减少,因此菌株Lys3002 的最佳发酵周期为5 d.
2.3 菌株Lys3002 的鉴定
菌株Lys3002 在PDA 平板上的菌落形态呈白色圆形,菌丝为致密的短绒状,紧贴平板生长,前期生长较慢,2~3 d 后有菌丝长出,此后生长较快,4~5 d 可长满整个平板;该菌的显微镜形态见图1,菌丝细长,有较多分支(图1c),孢子呈柱状或球状(图1d),菌丝有隔膜(图1e,箭头所示),可观察到锁状联合结构(图1f);在4 ℃冰箱长期斜面保存,偶有黄棕色小子实体长出;在液体摇瓶培养基中可形成白色绒状的圆形菌丝球.经北京三博远志生物技术有限责任公司测序,其ITS 序列已提交GenBank 数据库,登录号为KJ840830;该序列与库中已知的真菌序列BLAST 检索比对,构建出系统发育树(图3).从图3可知,菌株Lys3002 与毛栓菌亲缘最近,ITS 序列的同源度达99%以上,结合形态分析,该菌株鉴定为毛栓菌(Trametes hirsuta).

图2 菌株Lys3002 发酵产漆酶曲线Fig.2 Curve of laccase production by strain Lys3002
2.4 发酵条件的优化
2.4.1 碳源的影响 分别选取20 g/L 葡萄糖、蔗糖、可溶性淀粉、麸皮、稻草粉为碳源,5 g/L 硫酸铵为氮源的液体发酵基础培养基,培养5 d 后分别测定漆酶活力.从图4 可知,总体酶活力不高,处于150~210 U/L之间,可能与硫酸铵作为氮源的影响有关.但麸皮为碳源时,酶活力达到206.7 U/L,与其他的碳源差异显著(P <0.05),因此确定麸皮为菌株Lys3002 液态发酵培养基的最佳碳源.
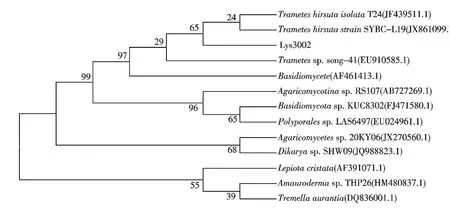
图3 菌株Lys3002 的系统发育树Fig.3 Phylogenetic tree of the strain Lys3002
2.4.2 氮源的影响 分别选取5 g/L 硫酸铵、尿素、豆饼粉、蛋白胨、牛肉膏为氮源,20 g/L 麸皮为碳源的液体发酵基础培养基,培养5 d 后分别测定漆酶活力.从图5 可知,不同氮源对漆酶的影响差异显著(P <0.05),有机氮源豆饼粉、蛋白胨、牛肉膏的酶活力较高,其中豆饼粉酶活力最大,达到480.0 U/L,因此确定豆饼粉为菌株Lys3002 液态发酵培养基最适氮源.
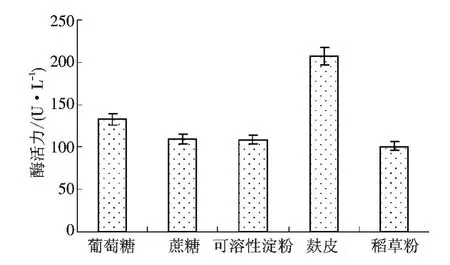
图4 碳源对菌株Lys3002 产酶的影响Fig.4 Effect of carbon sources on laccase production by strain Lys3002
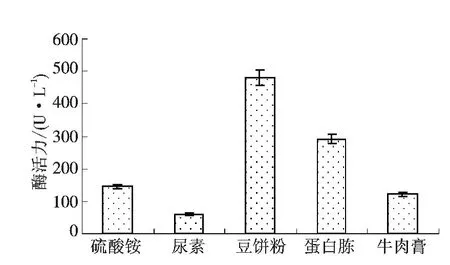
图5 氮源对菌株Lys3002 产酶的影响Fig.5 Effect of nitrogen sources on laccase production by strain Lys3002
2.4.3 培养基起始pH 的影响 以碳源(20 g/L 麸皮)、氮源(5 g/L 豆饼粉)优化后的培养基为液体培养基,分别调节初始pH 为3.0,4.0,5.0,6.0,7.0,接种菌株Lys3002 种子液后培养5 d.从图6 可知,在pH 4.0~7.0 范围内,菌体生长良好,说明菌株Lys3002 有较宽的pH 适应范围.培养基初始pH 在5.0~6.0 范围内酶活力无显著差异,漆酶活力达500 U/L 以上.由于在自然条件下此培养基pH 值为5.6~6.0,灭菌后略有下降,因此菌株Lys3002 在进行液态发酵时无需控制其pH 值.
2.4.4 培养基中金属离子的影响 研究表明[8],微生物液态发酵分泌漆酶的过程中,培养基中的金属离子对产酶具有重要影响.因此本试验进一步研究了Cu2+,Mn2+和Mg2+对菌株Lys3002 发酵产漆酶的影响,从图7 可知,培养基中添加Cu2+、Mn2+、Mg2+时漆酶活力最大,达479.3 U/L,说明Cu2+,Mn2+和Mg2+对漆酶活力均有促进作用,Mg2+的促进作用较Cu2+和Mn2+更为明显,这与文献报道一致.

图6 pH 条件对菌株Lys3002 产酶的影响Fig.6 Effect of pH value on laccase production by strain Lys3002
2.4.5 正交试验分析 根据单因素试验结果,选取对产酶影响较大的4 个因素(麸皮、豆饼粉、Mg2+、温度)进行L9(34)的正交试验.从表2 可知:通过9 组发酵条件组合进行试验,酶活力得到较大提高,最高达到591.11 U/L;从R 值的大小RA>RC>RD>RB可以看出影响因素由强到弱依次为麸皮、Mg2+、温度、豆饼粉;从K 值分析可得出最佳发酵条件组合为A2B2C3D2,即麸皮20 g/L,豆饼粉6 g/L,Mg2+0.5 g/L,温度30 ℃.经重复验证,培养基配方为麸皮20 g/L,豆饼粉6 g/L,MgSO4·7H2O 0.5 g/L,MnSO40.05 g/L,CuSO4·5H2O 0.05 g/L,培养基初始pH 自然,培养温度30 ℃,发酵周期5 d,酶活力可达597.82 U/L.

图7 金属离子对菌株Lys3002 产酶的影响Fig.7 Effect of metal ions on laccase production by strain Lys3002
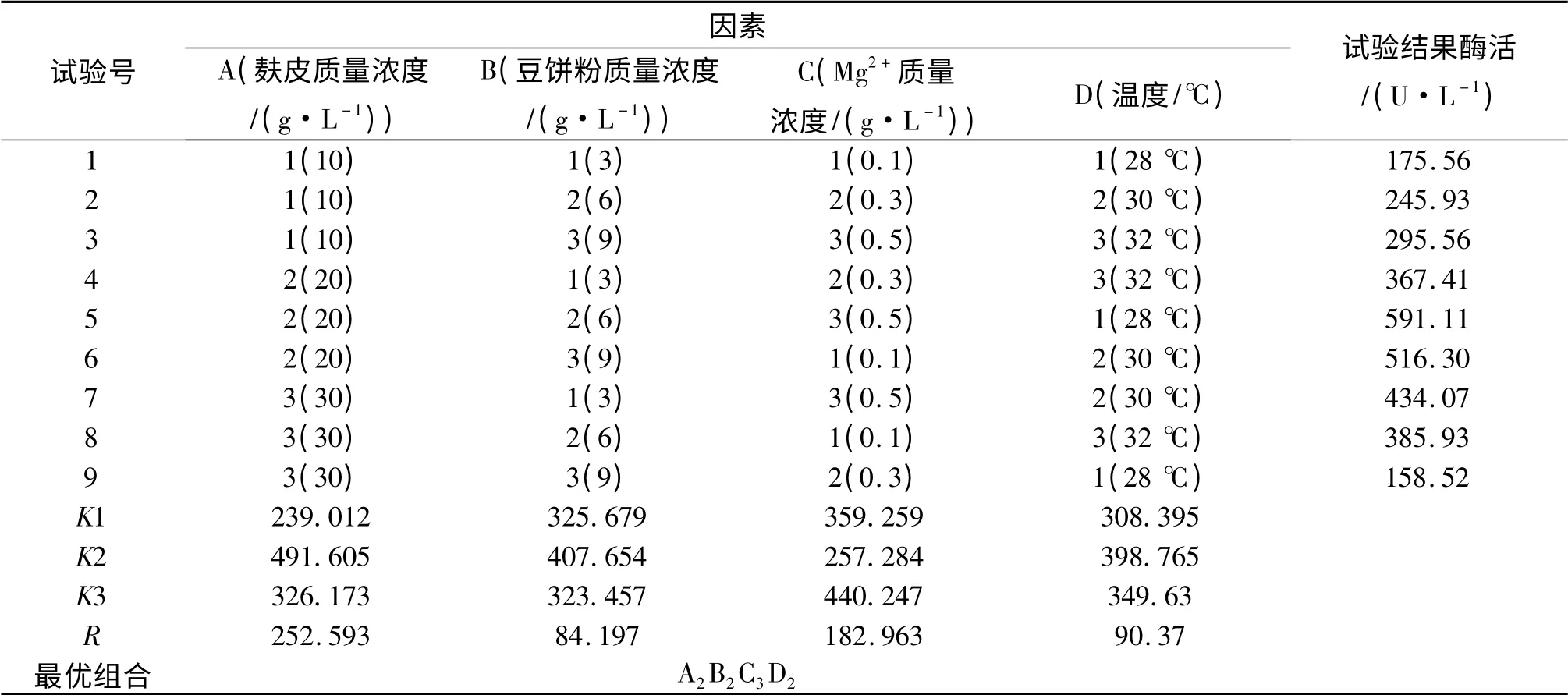
表2 发酵条件正交试验结果分析Tab.2 The analysis of the orthogonal for the fermentation conditions
3 结果与讨论
大量研究表明,白腐菌是目前已知的自然界中降解木质素能力最强的一类真菌[1].本研究先后设计含有愈创木酚和Azure-B 的初筛培养基、摇瓶复筛等多重筛选,获得了一株降解木质素能力较高的白腐真菌Lys3002,经鉴定该菌为毛栓菌(Trametes hirsuta).采用单因素试验和正交试验,进一步研究了菌株Lys3002液态发酵生产漆酶的最佳条件,结果表明:碳源和氮源的种类及浓度对产酶具有较大影响,国内外很多学者利用不同的无机、有机或复合的碳源和氮源来研究微生物的产漆酶能力,林娟等[6]研究表明,漆酶在最佳氮源为酒石酸铵的高氮低碳培养基中活力较高,而本研究中菌株Lys3002 在有机氮培养基中的漆酶活力明显高于无机氮培养基中的酶活,这与杜海英等[12]报道的一株白腐真菌液体发酵产漆酶的氮源条件较为一致;菌株Lys3002 在pH 4.0~7.0,28~32 ℃范围内生长良好,在pH 5.0~6.0,30 ℃条件下产漆酶活力较高;漆酶是一种含铜的多酚氧化酶,Cu2+对漆酶的产生有一定的诱导作用,因此在培养基中添加一定量的Cu2+,Mn2+和Mg2+等微量元素可提高漆酶产量;最优发酵培养基为麸皮2.0%,豆饼粉0.6%,MgSO4·7H2O 0.05%,CuSO4·5H2O 0.005%,MnSO40.005%,发酵5 d 漆酶活力高达597.82 U/L,高于燕红等[13]报道的木质素降解菌的漆酶活力144 U/L.作为一株原始野生菌,该菌株产酶能力很可观,有望进一步通过诱变育种或基因改良,获得产酶能力更高的突变菌株或基因工程菌,具有一定的应用潜力.
[1]王 巍,李秋菊,张 英,等.木质素酶及其高产菌株选育的研究进展[J].畜牧与饲料科学,2011,32(1):58-60.
[2]GURRA G,DMINGUEZ O,RMOS-LEAL M,et al.Production of laccase and manganese peroxidase by white-rot fungi from sugarcane bagasse in solid bed:Use for dyes decolourisation[J].Sugar Tech,2008,10(3):260-264.
[3]MIKIASHVILI N,ELISASHVILI V,WASSER S,et al.Carbon and nitrogen sources influence the ligninolytic enzyme activity of Trametes versicolor[J].Biotechnol Lett,2005,27(13):955-959.
[4]TONG P G,HONG Y Z,XIAO Y Z,et al.High production of laccase by a new basidiomycete,Trametes sp.[J].Biotechnol Lett,2007,29(2):295-301.
[5]RIVA S.Laccases:blue enzymes for green chemistry[J].Trends Biotechnol,2006,24(5):219-226.
[6]林 娟,兰帅琼,杨 捷,等.高产漆酶真菌的筛选及产酶条件研究[J].中国食品学报,2013,13(8):110-116.
[7]GUO L Q,LIN S X,ZHENG X B,et al.Production,purification and characterization of a thermostable laccase from a tropical white-rot fungus[J].World J Microbiol Biotechnol,2011,27(3):731-735.
[8]ZHU Y S,ZHANG H B,CAO M L,et al.Production of a thermostable metal-tolerant laccase from Trametes versicolor and its application in dye decolorization[J].Biotechnol Bioprocess Eng,2011,16(5):1027-1035.
[9]刘文华,蔡宇杰,范晶晶,等.毛栓菌产漆酶条件优化及该酶对合成染料脱色的特性[J].生物学通报,2013,40(5):727-738.
[10]曹治云,郑 腾,谢必峰,等.漆酶在生物检测中的应用进展[J].传感器技术,2004,23(8):1-4.
[11]林俊芳,刘志明,陈晓阳,等.真菌漆酶的酶活测定方法评价[J].生物加工过程,2009,7(4):1-8.
[12]杜海英,李海山.产漆酶菌株的筛选及其发酵条件的初步优化[J].华北农学报,2011,26(S1):261-266.
[13]燕 红,苏 俊,于彩莲,等.高效木质素降解菌株的分离筛选[J].浙江大学学报:农业与生命科学版,2011,37(3):259-262.

