S1P通路在胆盐所致HL-7702细胞毒性损伤中的作用*
梁君铭曾 宽邹堂斌
S1P通路在胆盐所致HL-7702细胞毒性损伤中的作用*
梁君铭①曾 宽②邹堂斌③
目的:探讨S1P通路在胆盐所致HL-7702细胞毒性损伤中的作用。方法:应用甘氨鹅脱氧胆酸盐(GCDC)处理HL-7702细胞建立胆盐损伤肝细胞模型,应用CCK-8试剂盒-8检测细胞存活率,ELISA方法检测细胞培养上清液S1P的表达,Western blot法测定caspase-3蛋白的表达水平。结果:应用150 μmol/L GCDC处理HL-7702细胞24 h可引起毒性损伤,10 μmol/L VPC23019(S1PR1抑制剂)预处理30 min可对抗GCDC引起的损伤,使细胞存活率升高,凋亡细胞数目和cleaved caspase-3表达均减少。结论:GCDC可以引起HL-7702细胞毒性,S1P通路介导GCDC对HL-7702细胞的损伤作用。
甘氨鹅脱氧胆酸盐; 凋亡; S1P; SphK1激酶; HL-7702细胞
胆汁淤积性黄疸病因复杂,能引起肝脏等损害,胆汁淤积胆酸盐所致肝实质细胞毒性损伤是胆汁淤积性黄疸肝损害的重要机制[1-3]。其中甘氨鹅脱氧胆酸盐(Glycochenodeoxcholate,GCDC)是引起肝细胞损伤的主要胆汁酸,在胆汁淤积性黄疸时浓度升高最为明显[4]。新近研究表明,鞘磷脂在肝脏生理和病理中有重要作用,1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)是鞘磷脂的重要代谢产物,而鞘氨醇激酶(Sphingosine kinase,SphK)是调控鞘脂代谢平衡的关键酶,S1P信号通路可能参与肝癌、胆汁淤积所致肝实质细胞损伤,但是S1P信号通路与胆汁淤积胆酸盐引起肝脏实质细胞损伤的机制尚不明确[1-3]。因此,本研究在HL-7702细胞建立胆酸盐损伤细胞模型,探讨S1P信号通路在GCDC损伤HL-7702细胞中的作用及其有关机制[2]。
1 资料与方法
1.1 一般资料 GCDC和VPC23019购自美国Sigma-Aldrich公司,CCK-试剂盒-8购自日本Dojindo公司,DMEM-F12培养基以及特级胎牛血清FBS购自美国Gibco BRL公司,Cleaved-caspase-3抗体购自美国Cell Signaling Technology公司,S1P ELISA测定试剂盒购自上海前尘生物科技有限公司,人HL-7702肝细胞株购自深圳市百恩维生物科技有限公司。
1.2 方法
1.2.1 CCK-8法测定HL-7702细胞存活率 当HL-7702细胞生长融合度至70%~80%时,给予含GCDC或VPC23019的培养基干预24 h或30 min后,根据CCK-8试剂盒说明书检测细胞存活率。每孔加入10%无血清培养基稀释的CCK-8工作液100 μL,37 ℃细胞培养箱孵育3 h,用Multiskan MK3酶标仪测定450 nm波长处的吸光度。取4孔光密度OD平均值,按照说明书公式计算细胞存活率,重复实验3次后收集数据行统计分析。
1.2.2 Western blot法检测caspase-3蛋白的表达 接种于60 mm培养皿的HL-7702细胞5×106,给予含GCDC或VPC23019的培养基干预24 h或30 min后,用冷PBS洗两次,加入适量细胞裂解液,4 ℃静置30 min,使用细胞刮子刮下细胞,置入2 mL离心管中,12 000 rpm离心10 min,取上清约2 μL采用BCA法进行蛋白定量,剩余上清液保存于低温冰箱以备电泳。总蛋白经聚丙烯酰胺凝胶电泳分离后,蛋白转移到PVDF膜上。5%脱脂奶粉封闭60 min,然后在兔抗人caspase-3抗体(美国Bioworld Technology公司)孵育液中4 ℃过夜,接着与相应的二抗室温孵育90 min。用ECL发光液显色后,暗室曝光到X线片,扫描后用ImageJ 1.410软件进行半定量分析。
1.2.3 双抗体夹心ELISA方法检测上清液S1P的表达 接种于96孔板的HL-7702细胞,给予含GCDC或VPC23019的培养基干预24 h或30 min后,取100 μL细胞培养上清液,加到S1P抗体预先包被的酶标板中,37 ℃培养箱孵育90 min,然后吸去上清液,接着加入S1P抗体继续37 ℃培养箱孵育60 min,TBS漂洗3次后,加入生物素标记的二抗37 ℃培养箱孵育30 min,加入TMB显色,终止液终止反应后,用Multiskan MK3酶标仪(入=450 nm)记录吸光度。取3孔吸光度的平均数,按公式计算上清液S1P的表达。
1.3 统计学处理 使用SPSS 13.0软件进行统计分析,实验数据(mean±SE)表示,组间差异采用单因素方差分析,两两比较按照最小显著性差异进行,以P<0.05为差异有统计学意义。
2 结果
2.1 S1P通路介导GCDC引起的HL-7702细胞毒性 根据笔者前期的实验研究,应用150 mol/L GCDC处理HL-7702细胞24 h建立胆酸盐损伤肝细胞模型,CCK-8试剂盒测定细胞存活率。未经任何处理的对照组细胞存活率为100%,150 μmol/L GCDC组处理HL-7702细胞24 h可明显地产生细胞毒性,使细胞存活率为(60.8±5.2 630)%明显降低,两组比较差异有统计学意义(P<0.01);1.25 μmol/L及2.5 μmol/L浓度的VPC23019(S1PR1抑制剂)未能抑制GCDC引起的HL-7702细胞毒性作用,细胞存活率分别为(61.6±4.0 373)%、(62.8±4.3 243)%,与GCDC组比较差异均无统计学意义(P>0.05);5~20 μmol/L浓度范围内的VPC23019(S1PR1抑制剂)能抑制GCDC引起的HL-7702细胞毒性作用,其中10 μmol/L VPC23019+GCDC预处理30 min的抑制作用最显著,表现为细胞存活率升高分别为(70.2±2.5 884)%、(80.4±2.7 018)%、(70±2.9 154)%,与GCDC组比较差异均有统计学意义(P<0.01),见图1。单独10 μmol/L VPC23019预处理对细胞存活率无明显影响。
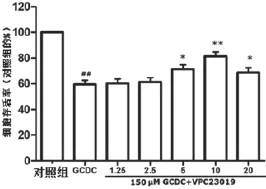
图1 S1P通路介导GCDC引起的HL-7702细胞毒性*P<0.05,**P<0.01,与GCDC组比较;##P<0.01,与对照组比较
2.2 S1P通路介导GCDC引起的HL-7702细胞凋亡 免疫印迹法测定cleaved caspase-3表达(是反映细胞凋亡的一个指标),未经任何处理的对照组cleaved caspase-3/β-actin比值为(0.5±0.0 894),150 μmol/L GCDC处理组HL-7702细胞24 h比值为(1.2±0.1 788)可明显地诱导细胞凋亡,与对照组比较差异有统计学意义(P<0.05)。但是,在GCDC作用HL-7702细胞前,10 μmol/L VPC23019预处理30 min能抑制GCDC对cleaved caspase-3表达的上调作用其比值为(0.8±0.0 894),可抑制GCDC的促凋亡作用,与GCDC组比较,差异有统计学意义(P<0.01)。10 μmol/L VPC23019单独处理HL-7702细胞24 h对细胞凋亡无明显的影响,其比值为(0.53±0.0 806),与对照组比较差异无统计学意义(P>0.05),见图2。

图2 S1P通路介导GCDC所致HL-7702细胞凋亡**与对照组比较,P<0.01,##与GCDC组比较,P<0.01
2.3 SphK1抑制剂阻抑GCDC对HL-7702细胞S1P表达的上调作用 ELISA测定培养上清液中S1P的含量,未经任何处理的对照组培养上清液S1P浓度为(119.6±9.3 950)pmol/mL,150 μmol/L GCDC组处理HL-7702细胞24 h可使S1P表达明显增多为(160.3±8.9 442)pmol/mL,两组比较差异有统计学意义(P<0.01);但是,在GCDC作用HL-7702细胞前,应用10 μmol/L VPC23019预处理30 min可明显地拮抗GCDC对S1P表达的上调作用,上清液S1P浓度为(140.8±7.0 894)S1P,与GCDC组比较差异有统计学意义(P<0.01),提示SphK1通路参与了GCDC对S1P表达的上调作用。单独10 μmol/L VPC23019预处理对培养上清液S1P浓度无影响为(121.53±9.0 774)pmol/mL,见图3。
3 讨论
磷脂是细胞膜的重要组分,主要包含有两大类磷脂,即由甘油构成的甘油磷脂(phosphoglyceride),由神经鞘氨醇构成的鞘磷脂(sphingolipid)。鞘磷脂(sphingomyelin)是含硝氨醇或二氢鞘氨醇的磷脂,其分子不含甘油,是一分子脂肪酸以酰胺键与鞘氨醇的氨基相连。人体含量最多的鞘磷脂是神经鞘磷脂,由鞘氨醇、脂肪酸及磷酸胆碱构成,常与卵磷脂存在于细胞膜外侧。鞘磷脂的代谢产物为神经酰胺(ceramide,Cer)、鞘氨醇(sphingosine,Sph)和1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)等。1-磷酸鞘氨醇(S1P)是重要的磷脂代谢产物,参与细胞增殖、存活和迁移等广泛的生物学效应。S1P在细胞内由鞘氨醇激酶(SphK)使鞘氨醇磷酸化而形成。S1P代谢的异常调节已经成为多种肿瘤发生发展的重要机制。靶向SphK-S1P信号通路的抑制剂、激动剂及抗体等已经成为众多肿瘤的新治疗策略。越来越多的证据表明,鞘磷脂参与调控细胞的生长、周期和凋亡等,鞘磷脂的重要活性代谢产物1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P),鞘氨醇激酶(sphingosine kinase1,SphK1)是鞘氨醇生成S1P的关键限速酶,SphK1/ S1P信号通路在肝细胞存活或凋亡中有重要作用[4-6]。近来有研究表明,胆汁淤积性黄疸引起肝实质细胞损伤是急慢性肝病的病因之一,其中不同浓度的胆汁酸对肝实质细胞的损害程度相同,胆汁酸低浓度时诱导细胞凋亡,高浓度的胆汁酸则可导致细胞坏死[7-9]。细胞内鞘脂代谢平衡对于维持细胞增殖、分化和凋亡发挥重要作用,鞘脂代谢物包括神经酰胺、神经鞘氨醇、鞘氨醇-1-磷酸盐等,可作为重要的信号分子,在肝细胞损伤和肿瘤的发生发展中有重要作用[10-17]。

图3 S1P通路介导GCDC所致HL-7702细胞S1P的生成**与对照组比较,P<0.01;##与GCDC组比较,P<0.01
本研究结果显示,胆汁酸中的甘氨鹅脱氧胆酸盐(GCDC)能引起人HL-7702细胞明显的毒性损伤,其表现为GCDC剂量依赖性地导致细胞存活率下降,及细胞凋亡增加,其中150 μmol/L GCDC处理HL-7702细胞24 h细胞存活率下降显著,这与先前研究结果相吻合[5-8]。引人注意的是,本研究也发现,在GCDC处理HL-7702细胞前,10 μmol/L VPC23019能抑制GCDC所致肝细胞毒性损伤和促凋亡作用,表现为细胞存活率升高,以及细胞凋亡减少。以上研究结果提示,S1P/S1PR1信号通路可能介导了胆汁酸(GCDC)对肝实质细胞(如HL-7702细胞)的毒性损伤,而胆汁酸(GCDC)对肝实质细胞的毒性损伤是否通过受体下游MAPK、STAT3等信号通路呢?这期待将来进一步深入研究探索。
综上所述,本研究首次证实S1P/S1PR1通路可介导了胆汁酸(GCDC)对肝实质细胞(如HL-7702细胞)引起的细胞毒性及致凋亡作用,本文为临床防治胆汁淤积性肝脏损伤提供了新的实验依据。
[1]肖敏,李琛,袁汉尧,等.鞘氨醇激酶2与蛋白激酶D参与调控丁酸钠诱导的人肝癌细胞凋亡[J].第三军医大学学报,2014,36(3):262-266.
[2]赛岩,代学强,白纪民,等.鞘氨醇激酶通过调控血管发生促进肝癌转移[J].中国医药生物技术,2012,7(3):171-177.
[3]易军,鲁茁壮,段海峰,等.肝细胞生长因子通过鞘氨醇激酶途径诱导内皮细胞迁移作用的研究[J].中国应用生理学杂志,2006,22(2):230-234.
[4]陈海英,高艳景,刘慧亚,等.鞘鞍醇激酶1对肝癌细胞凋亡特性的影响[J].中国现代普通外科进展,2011,14(1):6-8.
[5]陈海英,高艳景,刘慧亚,等.鞘氨醇激酶1对肝癌耐药细胞生物学特性的影响[J].中华肝胆外科杂志,2011,17(12):1001-1004.
[6]陈念平,周军,秦勇,等.甘氨鹅脱氧胆酸盐对人正常肝细胞HL-7702的影响[J].广东医学,2010,31(14):1773-1775.
[7]姜大磊,高艳景,刘慧亚,等.SPK/S1P信号途径对人肝癌细胞增殖、凋亡的作用[J].山东大学学报(医学版),2009,47(11):76-79.
[8] 刘慧亚,高艳景,姜大磊,等.SPK1/S1P信号途径对人肝癌耐药细胞株BEL-FU凋亡、侵袭力及耐药特性的影响[J].山东大学学报(医学版),2010,48(6):67-71.
[9]姜大磊,高艳景,付金栋,等.SPK/S1P信号途径对人肝癌细胞VEGF表达的作用[J].山东大学学报(医学版),2007,45(3):250-252.
[10]孙旻,陈剑群.鞘氨醇激酶在恶性肿瘤中的研究进展[J].徐州医学院学报,2010,30(6):412-414.
[11]吕冰洁,杨阳,张建初.鞘磷脂代谢物与肺癌关系的研究进展[J].华中科技大学学报(医学版),2014,43(5):603-605.
[12]张丽志,温克.1-磷酸鞘氨醇对恶性肿瘤生物学行为调控的研究进展[J].肿瘤,2012,32(11):936-939.
[13]邓晓杨,朱晓莺,徐蕾.鞘氨醇-1磷酸盐对宫颈癌HeLa细胞生长及细胞侵袭的影响[J].广西医学,2014,36(12):1695-1698.
[14]雷烨,许晓倩,王健民.SphK-S1P-S1PR信号通路在肿瘤发病机制中的作用[J].国际肿瘤学杂志,2014,41(6):412-415.
[15]单海霞.鞘氨醇激酶在恶性肿瘤中作用的研究[J].徐州医学院学报,2012,32(3):205-207.
[16]刘君,孙艳,邓爱军.1-磷酸鞘氨醇对人视网膜色素上皮细胞增殖的影响[J].中国医学创新,2010,7(20):21-22.
[17]孙艳,刘君,邓爱军.1-磷酸鞘氨醇对体外培养的人视网膜色素上皮细胞α-SMA表达的影响[J].中国医学创新,2010,7(20):6-7.
Role of S1P Pathway in Bile Salt-induced Injury in HL-7702 Cells
LIANG Jun-ming,ZENG Kuan,ZOU Tangbin.//Medical Innovation of China,2015,12(20):015-017
Objective: To explore the role of S1P pathway in the bile salt-induced injury in HL-7702 cells.Method:HL-7702 cells were treated with glycochenodeoxycholate (GCDC) to establish a bile salt-induced cellular injury model,cell viability was detected by CCK-8 kit. The expression of S1P in the cell culture supernatant was detected by ELISA,and the expression level of caspase-3 protein was determined by Western blot assay.Result:Exposure of HL-7702 cells to 150 μmol/L GCDC for 24 h markedly enhanced cell apoptosis.Pretreatment of HL-7702 cells with 10 μmol/L VPC23019(a S1PR1 inhibitor) for 30 min before exposure to GCDC inhibited the cytotoxicity induced by GCDC, it made cell viability increase,the number of apoptotic cells and expression of cleaved caspase-3 decrease. Conclusion:GCDC can induced cytotoxicity in HL-7702 cells,S1P pathway mediates the GCDC-induced injury in HL-7702 cells.
Glycochenodeoxcholate; Apoptosis; S1P; SphK1 kinase; HL-7702 cells
10.3969/j.issn.1674-4985.2015.20.005
2015-03-17) (本文编辑:周亚杰)
广东省科技计划项目(2013B031800016);东莞市科技计划项目(2014108101053)
①广东省佛山市顺徳区第一人民医院附属杏坛医院 广东 佛山528325
②中山大学附属孙逸仙纪念医院
③广东医学院公共卫生学院
邹堂斌
First-author’s address:The First People’s Hospital of Shunde Affiliated Xingtan Hospital,Foshan 528325,China

